慢病毒载体介导的层黏连蛋白受体稳定抑制细胞株的建立
武瑞琴,朱旭东,周晓巍,黄培堂
军事医学科学院a.生物工程研究所;b.疾病预防控制所;北京 100071
层黏连蛋白受体(laminin receptor,LR)又称层黏连蛋白结合蛋白(laminin binding protein,LBP),是细胞表面的跨膜糖蛋白,最早由Terranova 等[1]从人类乳腺癌细胞表面分离得到。已发现多种LR,根据其结构可分为整合素家族与非整合素家族两大类。其中,对非整合素家族中相对分子质量为67×103的LR(67kDa LR)的研究最为深入。67kDa LR通过疏水序列与层黏连蛋白的V 区/β1 链YIGSR 序列结合,广泛分布在上皮细胞、内皮细胞及大部分肿瘤细胞表面。层黏连蛋白、Ⅳ型胶原蛋白等构成的基膜是构成肿瘤细胞转移的主要屏障,因此LR在肿瘤细胞黏附和迁移过程中发挥至关重要的作用[2]。慢病毒是一种导入外源基因的有效手段,通过介导外源基因整合到宿主染色体上,可实现外源基因在宿主中的稳定持续表达。此外,慢病毒的感染效率高,宿主细胞类型广泛,且不易诱发宿主免疫反应,安全性好,在基因的功能性研究中具有明显优势[3]。本研究的目的,是以慢病毒为载体,构建LR 表达稳定抑制的HeLa 细胞株,为深入探讨LR 在肿瘤转移中的作用机制提供基础。
1 材料和方法
1.1 材料
HeLa 细胞、293FT 细胞、慢病毒载体质粒pLenti6/v5-EGFP、质粒pUC-H1、兔抗LR 多克隆抗体均由本实验室保存;包装载体质粒pLP1、pLP2、pLP/VSVG 购自Invitrogen 公司;引物及小发卡RNA(small hairpin RNA,shRNA)序列由北京奥科生物技术有限公司合成;Pfu高保真DNA 聚合酶购自上海生物工程有限公司;各种限制性内切酶购自NEB公司;T4DNA连接酶、DNA质粒提取试剂盒、质粒大提试剂盒Maxipreps DNA purification System 购自Promega 公司;胶回收试剂盒购自Qiagen 公司;细胞培养基DMEM 和Opti-MEM 购自Invitrogen 公司;胎牛血清(FBS)购自杭州四季青公司;羊抗α-actinin、HRP 标记的兔抗羊IgG 购自Santa Cruz Biotechnology 公司;HRP 标记的抗兔IgG 购自Amersham Pharmacia Biotech公司。
1.2 H1启动子的插入
从pUC-H1 载体中PCR 获得H1 启动子,末端加入ClaⅠ位点,同时在H1启动子下游末端ClaⅠ位点之前引入NheⅠ和PacⅠ限制性内切酶位点。扩增H1 的引物为H1-sense(5'-AATTGGATCGATCCATGGAATTCGAACGCTGACG-3')和H1-antisense(5'-AATTGGATATTTAATTAAGCTAGCGTGGTCTCAATACAGAACTTA-3')。PCR 扩增产物经琼脂糖凝胶电泳分离,用胶回收试剂盒对H1 条带进行回收纯化;用ClaⅠ酶切pLenti6/v5-EGFP 载体,经琼脂糖凝胶电泳分离回收酶切产物;将上述回收产物用T4DNA 连接酶连接得到pLenti6/v5-EGFP-H1,转化大肠杆菌JM109 感受态细胞,于含氨苄西林的LB 平板上于37℃倒置培养过夜;菌落PCR筛选阳性克隆,将阳性克隆接种于含氨苄西林的LB 培养液中,37℃振荡培养过夜,送华诺公司测序。
1.3 LR靶向shRNA序列的设计
根据NCBI 中LR 的基因序列和Ambion 公司的pSolencer 说明书设计2条shRNA(表1),由北京奥科生物公司合成。
1.4 LR靶向shRNA序列的插入
将合成的shRNA 序列退火,使其形成双链DNA;分别用PacⅠ和NheⅠ双酶切shRNA 双链和pLenti6/v5-EGFP-H1载体,1%琼脂糖凝胶电泳回收酶切产物,经T4DNA 连接酶连接得到pLenti6/v5-EGFP-H1-shRNA;将上述载体转化大肠杆菌TOP10感受态细胞,转化细菌接种到含氨苄西林的LB平板上,于37℃倒置培养过夜;利用H1 上游引物和引物6、7 下游序列(引物6 antisense:5'-TTAATTAATTC CAAAAACCTTCACT-3';引 物7 antisense:5'-TTA ATTAATTCCAAAAATAACAAGG-3')进行菌落PCR筛选阳性克隆。
1.5 慢病毒的包装和感染
将pLenti6/v5-EGFP-H1-LRshRNA 载体质粒和包装质粒共转染细胞汇合度达到90%的293FT 细胞,以pLenti6/v5-EGFP-H1 为阳性对照。转染后4 h 换成新鲜的DMEM 培养基(含10% FBS,1 mmol/L丙酮酸钠,0.1 mmol/L 非必需氨基酸),转染后72 h收获并浓缩病毒,4℃、3000 r/min 离心15 min,取上清,加入终浓度为5×10-4g/L 的聚合赖氨酸(PLL),轻轻混匀,4℃孵育30 min,4℃、10 000 r/min 离心2 h,用DMEM重悬,分装后于-70℃保存。
HeLa 细胞用DMEM 培养液(含10% FBS、100 U/mL青霉素、100 μg/mL链霉素)于37℃、5% CO2条件下培养,感染前1 d 铺至24 孔板。分别以含有LR-sh6、LR-sh7 及空白对照的病毒感染细胞,感染后48~72 h可在荧光显微镜下观察细胞内的荧光。
1.6 稳定细胞株的筛选
病毒感染后的HeLa细胞于第4 d加入4 μg/mL的杀稻瘟菌素(blasticidin),每隔3 d换一次抗生素,共筛选12 d。筛选后的细胞经胰酶消化后在显微镜下计数,用新鲜培养基稀释后铺96 孔板,保证每孔仅含1 个细胞,于37℃、5% CO2条件下培养,待长出细胞克隆后在荧光显微镜下观察,发出绿色荧光的克隆即为阳性细胞克隆。扩大培养后,最终获得阳性慢病毒感染的HeLa细胞系,即HeLa-LR-sh6和HeLa-LR-sh7。
1.7 real-time PCR 检 测HeLa 细胞中LR 的mRNA表达水平
将HeLa 细胞和稳定表达shRNA 的HeLa-LR 细胞株铺至24 孔板,于37℃、5% CO2条件下培养48 h后提取总RNA。取0.5 μg 总RNA 为模板,以Oligo(dT)为引物进行反转录获得cDNA。将cDNA 稀释后作为模板,加入DNA 缓冲液、上下游引物、dNTP和Taqman 探针,进行real-time PCR,根据所得数据计算LR mRNA的表达水平。
1.8 Western 印迹检测HeLa 细胞中LR 的蛋白表达水平
用NP-40 细胞裂解液裂解已感染病毒的细胞,4℃、12 000 r/min 离心10 min 收集上清,测定蛋白浓度后取一定量的蛋白样品进行SDS-PAGE 分离蛋白,转印至PVDF 膜,用TBST 配制的5%脱脂奶粉室温封闭1 h,LR 兔抗和α-actinin 羊抗稀释后室温孵育1 h,二抗稀释后室温反应1 h,加发光液后显色,检测LR蛋白的表达水平。
2 结果
2.1 H1启动子的扩增和插入
以pUC-H1 质粒为模板扩增H1 启动子,对扩增产物进行琼脂糖凝胶电泳分析,结果显示得到260 bp 的片段(图1)。将扩增片段插入pLenti6/v5-EGFP 载体,对连接转化的菌落进行PCR 鉴定,得到多个阳性克隆(图2)。挑选2、6、9、12 这4 个阳性克隆测序,结果表明插入的H1 启动子序列正确(序列略)。
2.2 pLenti6/v5-EGFP-H1-shRNA的构建
将合成的单链shRNA 序列的正反链缓慢退火形成双链,与经NheⅠ和PacⅠ双酶切的pLenti6/v5-EGFP-H1 载体连接,用H1 启动子上游引物和合成的LR-sh6 和LR-sh7 下游引物对连接转化的菌落进行PCR 鉴定(图3),表明shRNA 片段连入pLenti6/v5-EGFP-H1,构建成pLenti6/v5-EGFP-H1-shRNA载体,测序结果表明插入的外源序列正确(序列略)。
2.3 稳定表达LR 靶向shRNA 的HeLa 细胞株的获得
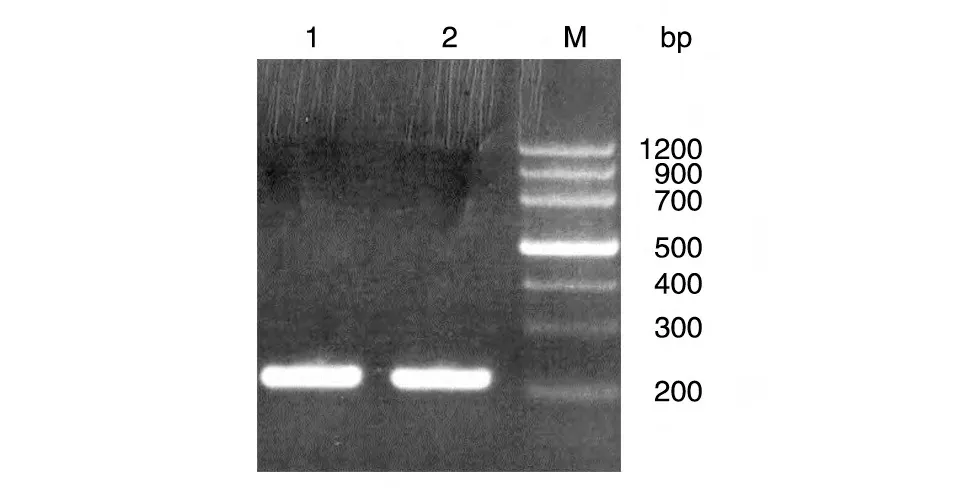
图1 H1启动子PCR扩增产物的琼脂糖凝胶电泳分析
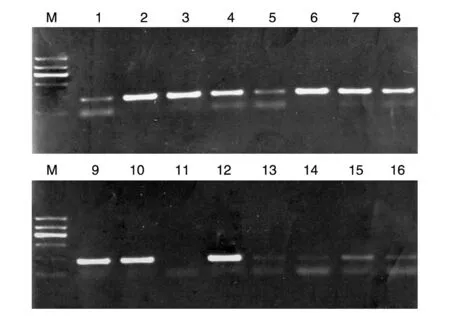
图2 菌落PCR筛选阳性pLenti6/v5-EGFP-H1重组子
用构建的pLenti6/v5-EGFP-H1-LR-sh6 和pLenti6/v5-EGFP-H1-LR-sh7 慢病毒载体包装病毒后感染HeLa 细胞,筛选得到稳定表达LR shRNA 的2 组共34 株HeLa-LR-sh6 和HeLa-LR-sh7 细胞,荧光显微镜下几乎全部细胞均发出绿色荧光(图4)。
2.4 HeLa-LR-shRNA 细胞株中LR的抑制效果
对2组共34株细胞培养2 d后提取总RNA和蛋白,进行real-time PCR 和Western 印迹,分别在转录水平和蛋白水平检测HeLa细胞中LR 的表达。realtime PCR 结果显示34 株细胞中有14 株LR 的表达受到明显抑制,LR-sh6 和LR-sh7 在RNA 水平上都表现出了较好的LR 抑制作用,LR-sh7 的抑制效率最高可达90%(图5)。Western 印迹显示稳定表达shRNA的细胞中LR的蛋白水平明显下降(图6、7)。
3 讨论
层黏连蛋白是重要的细胞外基质成分。大量研究表明,LR 参与多种细胞活动,不仅能够介导病毒和朊蛋白与宿主细胞的相互作用[4-5],而且与肿瘤细胞的转移密切相关,通过信号转导介导细胞之间的识别和组织细胞的衰老过程。
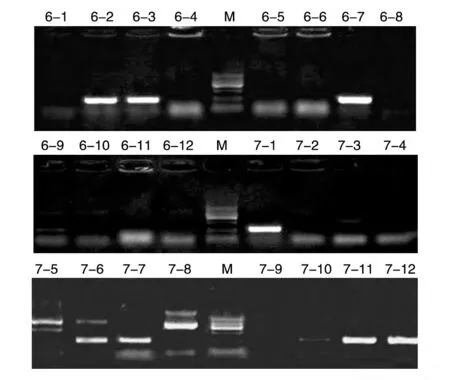
图3 菌落PCR筛选pLenti6/v5-EGFP-H1-shRNA阳性重组子
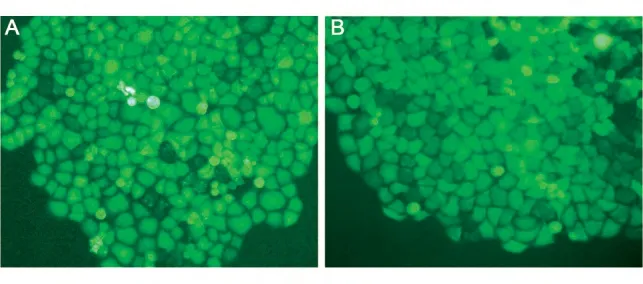
图4 稳定表达LR靶向shRNA的HeLa细胞株
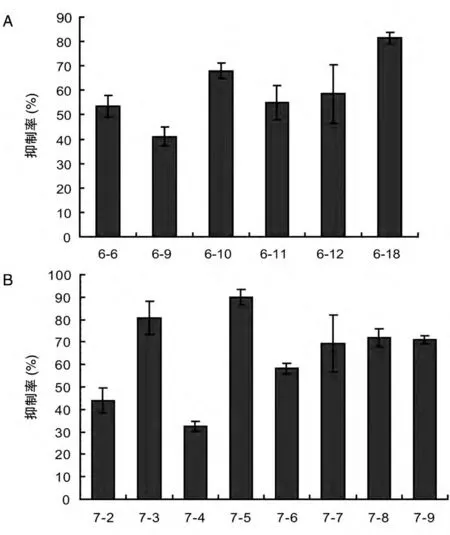
图5 LR shRNA的抑制效率
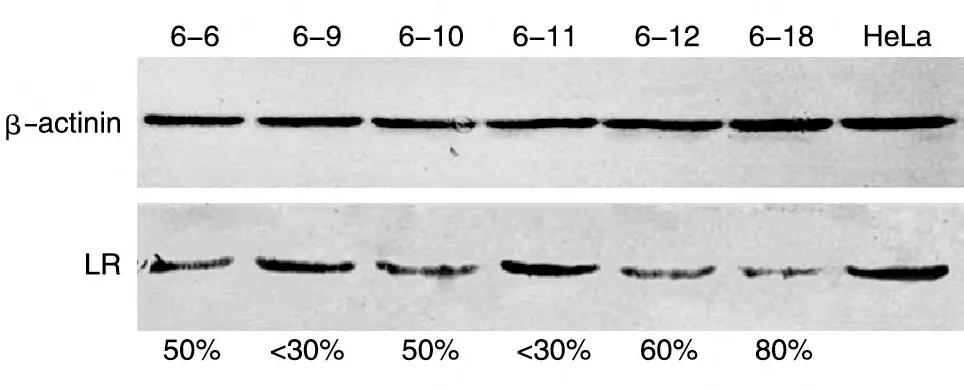
图6 HeLa-LR-sh6细胞LR蛋白的表达
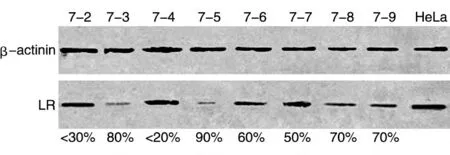
图7 HeLa-LR-sh7细胞LR蛋白的表达
研究表明,LR 的表达水平与很多肿瘤特别是上皮细胞肿瘤的恶性程度有关。在卵巢癌、肺癌及结肠癌中都发现LR 的表达与肿瘤的发展阶段呈正相关。Yow 等[6]的研究结果显示,结肠癌中LR mRNA水平比邻近的正常结肠上皮细胞高出近9 倍。在乳腺癌[7]、肝癌[8]中,LR 的高表达增强了肿瘤的局部浸润和淋巴结转移能力。Berno等[9]针对乳腺癌细胞转移的研究表明,LR 可通过调控肌动蛋白组装,影响细胞的黏附和迁移,同时伴随蛋白水解酶的活化。Horwitz等的研究结果则显示,LR与细胞外基质相互作用影响肿瘤细胞的信号转导,可引起ERK、JNK 和p38MAPK的活化,从而影响肿瘤细胞的转移。
为了深入研究LR在肿瘤转移中的作用机制,我们设计了靶向LR 的shRNA,并构建了慢病毒载体。慢病毒载体可将shRNA 整合到宿主细胞的基因组中,通过筛选获得了稳定表达shRNA 的HeLa 细胞,检测发现内源性LR 在转录和蛋白水平的表达被沉默,而且抑制效果显著。此细胞模型的建立,为体外研究LR 的生物学功能,尤其是LR 在肿瘤转移中的作用机制提供了有力的实验工具。
[1]Terranova V P,Rao C N,Kalebic T,et al.Laminin receptor on human breast carcinoma cells[J].Proc Natl Acad Sci USA,1983,80(2):444-448.
[2]Givant-Horwitz V,Davidson B,Reich R.Laminin-induced signaling in tumor cells:the role of the M(r) 67 000 laminin receptor[J].Cancer Res,2004,64(10):3572-3579.
[3]方芳,朱平.慢病毒载体的改进为基因治疗带来了新的希望[J].中国实验血液学杂志,2013,21(5):1336-1339.
[4]Volkel D,Blankenfeldt W,Schomburg D.Large-scale production,purification and refolding of the full-length cellular prion protein from Syrian golden hamster in Escherichia coli using the glutathione S-transferase-fusion system[J].Eur J Biochem,1998,251(1-2):462-471.
[5]Morel E,Andrieu T,Casagrande F,et al.Bovine prion is endocytosed by human enterocytes via the 37 kDa/67 kDa laminin receptor[J].Am J Pathol,2005,167(4):1033-1042.
[6]Yow H K,Wong J M,Chen H S,et al.Increased mRNA expression of a laminin-binding protein in human colon carcinoma:complete sequence of a full-length cDNA encoding the protein[J].Proc Natl Acad Sci USA,1988,85(17):6394-6398.
[7]Mercurio A M,Bachelder R E,Chung J,et al.Integrin laminin receptors and breast carcinoma progression[J].J Mammary Gland Biol Neoplasia,2001,6(3):299-309.
[8]Kemperman H,Driessens M H,La Riviere G,et al.Adhesion mechanisms in liver metastasis formation[J].Cancer Surv,1995,24:67-79.
[9]Berno V,Porrini D,Castiglioni F et al.The 67 kDa laminin receptor increases tumor aggressiveness by remodeling laminin-1[J].Endocr Relat Cancer,2005,12(2):393-406.

