miR-155对肝癌细胞增殖的影响
南雪 ,曾泉,吕洋,姚海雷,陈琳,岳文,裴雪涛
军事医学科学院 a.野战输血研究所 全军干细胞与再生医学重点实验室,北京 100850;b.华南干细胞与再生医学研究中心,广东 广州 510005
原发性肝癌是世界范围内发病率高、恶性高、预后差的恶性肿瘤之一,它的发病是多因素导致的复杂过程[1-2]。对于肝癌发生、复发与转移分子机制的探讨,依然是目前肿瘤分子生物学研究领域最为重要的问题之一。与其他恶性肿瘤一样,肝癌的发生与发展是包括原癌基因激活或/和抑癌基因失活的多阶段多步骤过程[3-4]。在此过程中,基因突变、染色体扩增等基因遗传学的改变无疑发挥着极其重要的作用。此外,表观遗传学的改变,尤其是microRNA(miRNA)表达改变造成的原癌基因的失活或抑癌基因的沉默也同样发挥着重要作用[5-6]。miRNA 是近年发现的一类长度仅为18~25 个核苷酸的内源性非编码小RNA,成熟miRNA 的5'非翻译区的2~7 个核苷酸的“种子序列”可以与靶mRNA 的3'非翻译区互补结合,在转录后水平上抑制靶基因的表达[7-8]。miRNA 在细胞生长、增殖、发育和凋亡过程中发挥重要作用,并与许多肿瘤的发生、发展相关。miRNA在肿瘤中发挥着相当于癌基因或抑癌基因的作用,调节着肿瘤细胞的多种重要的生物学行为[5-8]。近年来,miRNA 调控肿瘤增殖和转移的研究成为热点,包括miRNA-125b等在内的许多miRNA被证明在肝癌的发生与转移中发挥重要作用[9-10]。
我们在前期工作中发现肿瘤微环境中的基质细胞可以促进肿瘤细胞中miR-155 的表达,但miR-155 对肝癌细胞发挥怎样的影响有待明确[11]。在以上工作基础上,我们在Huh7.5.1 及Hcclm3 肝癌细胞系中过表达miR-155,发现miR-155 的表达明显促进肿瘤细胞的生长。
1 材料与方法
1.1 材料
Huh7.5.1 及Hcclm3 肝癌细胞由本室保存;真核表达载体pcDNA3.0-miR-155 由军事医学科学院放射与辐射医学研究所郑晓飞教授馈赠;限制性内切酶、核酸分子量标记等购自宝生物公司;反转录试剂盒及实时定量用SYBR Green 染料购自Qiagen 公司;CCK8购自同仁株式会社;高糖培养基购自Gibco公司;胎牛血清购自Hyclone 公司;LipofectAMINE 2000 及TRIzol 购自Invitrogen 公司;引物合成由上海英骏公司完成。
1.2 细胞培养与转染
将Huh7.5.1 及Hcclm3 肝癌细胞接种于6 孔板中,用含10%胎牛血清的高糖培养基在37℃、5%CO2条件下培养;用LipofectAMINE 2000 转染细胞,每孔加入溶解于opti-MEM 的10μL LipofectAMINE 2000和4μg pcDNA3.0-miR-155 质粒DNA,对照组加入与实验组等量的LipofectAMINE 2000和pcDNA3.0 质粒DNA;转染第2 d 换液,72 h后收获细胞,用于miRNA的实时定量PCR检测。
1.3 实时定量PCR 检测miR-155 在细胞中的表达水平
转染pcDNA3.0-miR-155 质粒及pcDNA3.0 质粒72 h后,用TRIzol提取Huh7.5.1及Hcclm3细胞的总RNA,经酚氯仿抽提纯化RNA,用反转录试剂盒对总RNA 进行反转录得到cDNA,采用SYBR Green法实时定量PCR 检测。上游引物为5'-TTAATGCT AATCGTGATAGGGGT-3',下游引物为5'-GATTGA ATCGAGCACCAGTTAC-3';PCR 条 件:95℃ 15 min;95℃ 15 s,55℃ 30 s,72℃ 30 s,40 个循环。以U6 基因为内参,上游引物为5'-CGCTTCGGCAG CACATATACTA-3',下游引物为5'-GATTGAATCG AGCACCAGTTAC-3';PCR 条件:95℃15 min;95℃15 s,55℃ 30 s,72℃ 30 s,40 个循环。各组PCR均进行3复孔重复。
1.4 CCK8法及克隆形成实验检测细胞增殖
1.4.1 CCK8 法检测 将转染24 h 后的细胞以每孔2×103/100μL 的密度接种于96 孔板,培养24、72和120 h 后分别进行CCK8 检测。加入10μL CCK8,继续在37℃、5% CO2条件下培养4 h,检测D450nm值,每组均进行6复孔重复。
1.4.2 克隆形成实验 转染后将细胞以2×103/孔的密度接种于6 孔板,37℃、5% CO2条件下培养,每3 d 换液,2 周后弃去培养液,用PBS 洗3 次,加入0.1%结晶紫溶液(含10%福尔马林)固定20 min,用自来水柔和冲洗,自然干燥,照相保存。
1.5 统计学分析
数据以x±s表示;应用t检验进行两均数间的差异性分析。
2 结果
2.1 pcDNA3.0-miR-155真核表达载体的鉴定
用限制性内切酶HindⅢ和XhoⅠ对pcDNA3.0-miR-155 质粒进行双酶切鉴定,酶切产物经琼脂糖凝胶电泳,在350 bp 及5.4 kb 左右出现条带,符合预期结果(图1),测序结果与GenBank中序列一致。
2.2 miR-155 在Huh7.5.1 及Hcclm3 肝癌细胞系中的表达
将Huh7.5.1 及Hcclm3 肝癌细胞培养至密度80%左右(图2),转染pcDNA3.0-miR-155 质粒,72 h后对细胞进行实时定量PCR,检测miR-155的表达情况,以转染pcDNA3.0质粒为阴性对照。结果显示阳性组表达水平比阴性组分别高约431 倍及16 倍(P<0.01)(图3),说明pcDNA3.0-miR-155 质粒能有效地高表达成熟的miR-155。
2.3 miR-125b高表达对细胞增殖的影响
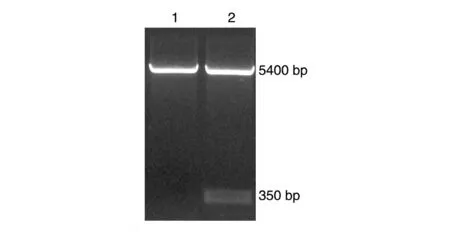
图1 pcDNA3.0-miR-155质粒的HindⅢ/XhoⅠ双酶切鉴定
图2 Hcclm3(A)和Huh7.5.1(B)肝癌细胞
CCK8 法检测结果表明,与转染pcDNA3.0 阴性对照载体组相比,pcDNA3.0-miR-155 质粒转染Huh7.5.1 及Hcclm3 肝癌细胞72 h 后细胞增殖受到明显促进,二者差异非常显著(P<0.01)(图4)。克隆形成实验是将单细胞悬液以较低的细胞密度接种于培养孔板中,经相对较长时间的培养来考察单个细胞的增殖能力,实验结果也说明miR-155 促进了肝癌细胞的增殖(图5)。
3 讨论
肝癌是严重威胁人类健康的疾病,其发生是多步骤多因素过程。与其他恶性肿瘤一样,肝癌依然存在不能早期诊断及预后差等问题。因此,对其发生的分子机理研究依然非常重要。越来越多的研究表明,包括miRNA 在内的表观遗传学调控机制在肝癌的发生发展中扮演了重要角色[4,12-14]。
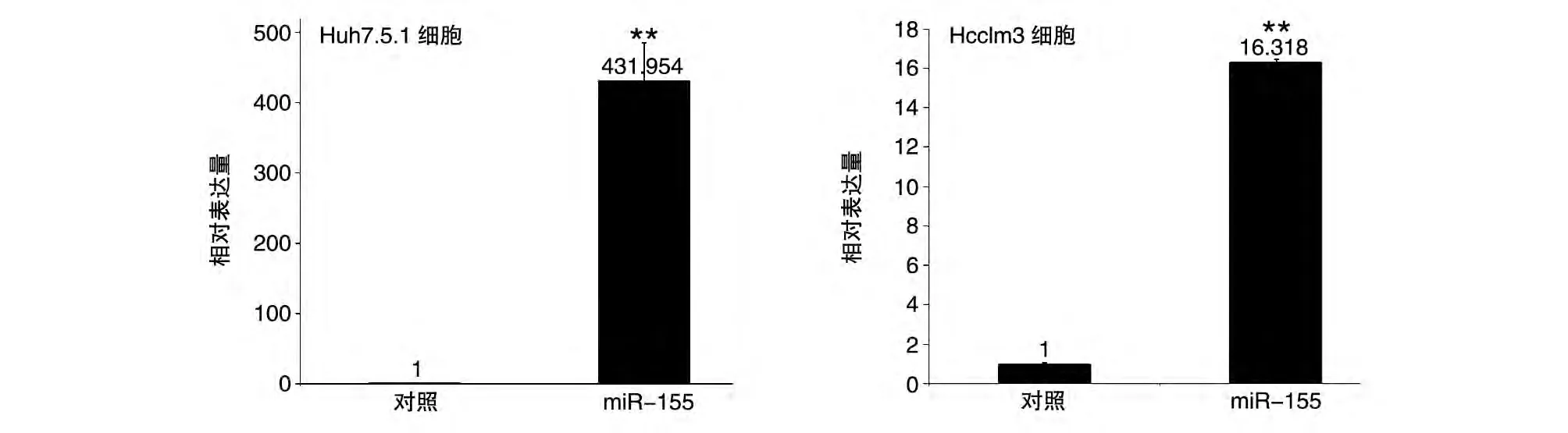
图3 实时定量PCR检测转染72 h后Huh7.5.1及Hcclm3肝癌细胞中miR-155的表达
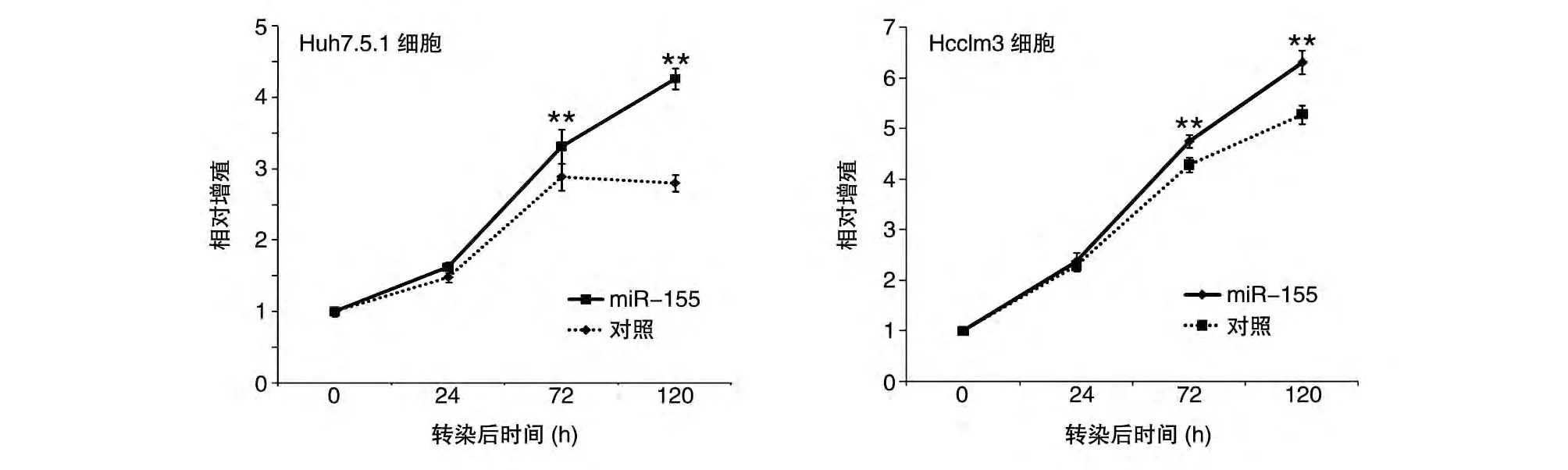
图4 CCK8法检测Huh7.5.1及Hcclm3肝癌细胞的增殖

图5 克隆形成实验证明miR-155促进Huh7.5.1及Hcclm3肝癌细胞的增殖
1993 年,Lee 等在线虫中发现了首个miRNA;之后Calin 等首次在人的慢性淋巴细胞白血病中发现miR-15a及miR-16-1表达异常;此后越来越多的研究证明miRNA 与肿瘤的增殖、分化及凋亡等相关,并且在肿瘤发生、发展中发挥重要作用[15-16]。最新的证据表明,多种miRNA 在肝癌发生发展过程中发生明显变化,包括let-7、miR-29和miR-122 等在内的miRNA 下调,而miR-21、miR-221、miR-51和miR-517a等多种miRNA显著上调[17-20]。探讨这些表达变化的miRNA 对肝癌细胞生物学行为的影响,并研究其临床转化意义,将有助于理解肝癌发生发展的机理,进一步为肿瘤诊断与治疗靶标的发现提供理论依据。
在前期工作中,我们系统研究了肝肿瘤微环境的变化,并探讨这些变化对于肝癌细胞生物学活性的影响[11]。研究发现,微环境中的基质细胞呈激活状态,其表达和分泌的活性因子发生显著性变化,包括S100A4、MMP1、S100A11、HGF、FGF13、FGF5、CCL13、IL-24、S100A3、CXCL12、Gremlin2和WNT2等(http://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE42357),而这些因子的变化无疑将进一步影响肿瘤细胞的生物学活性。我们进一步筛选包括S100A4 等在内的因素对肿瘤细胞的影响,尤其关注肿瘤细胞内miRNA 的变化,发现miR-155 的表达发生了明显上调。那么,进一步明确miR-155 对肝癌细胞的生物学活性,尤其是对肿瘤细胞增殖活性的影响,将有助于进一步了解肿瘤微环境的分子调控机制,具有重要的生物学意义。
综上,本研究通过外源性过表达的分子生物学手段探讨了miR-155 对肝癌细胞增殖能力的影响,结果初步证明了miR-155 促进肿瘤细胞的增殖活性,对于进一步揭示肝癌发生发展的病理机制,尤其是了解肿瘤微环境在肝癌发生中的作用具有重要意义。在未来的工作中,我们将进一步探索miR-155的作用机制,明确其发挥增殖调控作用的靶基因与分子信号通路,研究结果将促进肝癌发生机制及新的肿瘤诊疗靶点的发现。
[1]蔡永娥,乔建锦,孙晓茹,等.我国原发性肝癌研究进展[J].现代肿瘤医学,2008,16(1):141-143.
[2]孙劲松,陈桂明,龙志雄,等.待原发性肝癌综合治疗进展[J].中国肿瘤临床与康复,2005,12(5):468-470.
[3]于秀石,关媛媛,田菊霞.肝癌发生的相关分子机制研究进展[J].健康研究,2010,30(5):390-393.
[4]邓敬桓,秦雪.原发性肝癌发生机制的研究进展[J].环境与健康杂志,2007,24(11):924-926.
[5]周凡,庄诗美.microRNA与肿瘤[J].生命科学,2008,20(2):207-212.
[6]王建军,王泽友.miRNA 与肿瘤的研究进展[J].肿瘤药学,2011,1(3):169-172.
[7]Calin G A,Croce C M.microRNA signatures in human cancers[J].Nat Rev Cancer,2006,6(11):857-866.
[8]Bartel D P.microRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[9]Jiang J X,Gao S,Pan Y Z,et al.Overexpression of miRNA-125b sensitizes human hepatocellular carcinoma cells to 5-fluorouracil through inhibition of glycolysis by targeting hexokinaseⅡ[J].Mol Med Rep,2014,10(2):995-1002.
[10]Liang L,Wong C M,Ying Q,et al.microRNA-125b suppressesed human liver cancer cell proliferation and metastasis by directly targeting oncogene LIN28B2[J].Hepatology,2010,52(5):1731-1740.
[11]Xiong Y,Fang J H,Yun J P,et al.Effects of microRNA-29 on apoptosis,tumorigenicity,and prognosis of hepatocellular carcinoma[J].Hepatology,2010,51(3):836-845.
[12]朱贵忠,聂明.miRNA 在肝癌中的研究进展[J].现代预防医学,2011,38(20):4246-4247.
[13]陈彪.miRNA 在原发性肝癌中的研究进展[J].临床肿瘤学杂志,2012,17(10):946-950.
[14]徐娜,原红霞,林娟,等.miRNA 在肿瘤发生发展机制中的研究进展[J].中国医药指南,2012,10(22):81-82.
[15]Lee R C,Feinbaum R L,Ambros V.The C.elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J].Cell,1993,75(5):843-854.
[16]Calin G A,Cimmino A,Fabbri M,et al.miR-15a and miR-16-1 cluster functions in human leukemia[J].Proc Natl Acad Sci USA,2008,105(13):5166-5171.
[17]Xiong Y,Fang J H,Yun J P,et al.Effects of microRNA-29 on apoptosis,tumorigenicity,and prognosis of hepatocellular carcinoma[J].Hepatology,2010,51(3):836-845.
[18]Parpart S,Roessler S,Dong F,et al.Modulation of miR-29 expression by alpha-fetoprotein is linked to the hepatocellular carcinoma epigenome[J].Hepatology,2014,60(3):872-883.
[19]Liu R F,Xu X,Huang J,et al.Down-regulation of miR-517a and miR-517c promotes proliferation of hepatocellular carcinoma cells via targeting Pyk2[J].Cancer Lett,2013,329(2):164-173.
[20]Toffanin S,Hoshida Y,Lachenmayer A,et al.microRNAbased classification of hepatocellular carcinoma and oncogenic role of miR-517a[J].Gastroenterology,2011,140(5):1618-1628.

