人VHL 基因真核表达载体的构建及其对肿瘤细胞生长的抑制
李玲 ,王婷,梁迎春,张立,冯滢滢,周丽英,冀全博,郭靖,徐小洁,叶棋浓
1.军事医学科学院 生物工程研究所,北京 100850;2.陕西省妇幼保健院 辅助生殖中心,陕西 西安 710003;3.总参警卫局 卫生保健处,北京 100017
von Hippel-Lindau(VHL)病是临床十分罕见的家族性常染色体显性遗传性肿瘤病,包括中枢神经系统血管母细胞瘤、嗜铬细胞瘤、散发性肾透明细胞癌等[1-2]。1993 年,Latif 等将VHL基因定位于染色体3p25-26,并首次克隆了该基因[3]。VHL基因为抑癌基因,该基因的失活会导致正常VHL 蛋白合成障碍,这与肝癌、乳腺癌、肺癌、结直肠癌、胰腺导管癌等肿瘤的发生发展有着密切关系[4-6]。例如,VHLE3 泛素连接酶复合物能诱导癌细胞G1 期停止,减少周期蛋白D1 及雌激素受体(ER)的表达,抑制雌激素依赖型乳腺癌细胞增殖[5]。
本实验拟构建带Myc 标签的VHL真核表达载体,以肝癌和乳腺癌2种细胞系进行VHL功能验证,为进一步研究VHL 在肿瘤发生发展中的关系奠定基础。
1 材料和方法
1.1 材料
人乳腺癌ZR75-1 细胞系、人肝癌HepG2 细胞系、人胚肾293T 细胞系由本室传代培养;人乳腺文库、pXJ-40-myc 载体为本室保存;PCR 试剂、限制性内切酶、DNA 连接酶购自TaKaRa 公司;质粒提取、胶回收试剂盒购自Promega 公司;VigoFect 为威格拉斯生物技术有限公司产品;胎牛血清、DMEM 购自Gibco 公司。引物由北京赛百盛生物技术有限公司合成;测序由北京博迈德科技发展有限公司完成。
1.2 myc-VHL重组质粒的构建与测序
以人乳腺文库为模板,根据GenBank 中的人源VHL序列合成上游引物(5'-CGGGATCCATGCCCC GGAGGGCGGAGAA-3')和下游引物(5'-CCGCTC GAGTCAATCTCCCATCCGTTGATGTG-3'),PCR 法扩增人VHL的编码序列(扩增条件:95℃预变性5 min;95℃变性30 s,58℃退火30 s,72℃延伸1 min,30个循环;72℃再延长7 min)。
将PCR 产物行12 g/L 琼脂糖凝胶电泳,若条带特异且位置正确,则胶回收PCR 产物后用BamHⅠ/XhoⅠ酶切,形成带粘性末端的双链;BamHⅠ/XhoⅠ双酶切pXJ-40-myc 载体,胶回收载体的大片段;将PCR 产物酶切片段用T4DNA 连接酶连接入pXJ-40-myc载体,转化大肠杆菌DH5α感受态后,挑克隆进行菌液PCR,选取阳性克隆培养并提取质粒,再用BamHⅠ/XhoⅠ双酶切鉴定;将酶切鉴定正确的克隆送北京博迈德科技发展有限公司测序。
1.3 转染人胚肾293T细胞和Western印迹检测
用含1%双抗及10%胎牛血清的DMEM 培养基将人胚肾293T细胞接种于2个6 cm 皿中,接种量以转染时70%~80%的细胞密度为宜,转染前1 h换液;将4μL VigoFect 与200μL NaCl 混 合,静 置5 min,期间将10μg 重组质粒与200μL NaCl 混合,然后将上述2 种溶液混匀,室温静置15 min 后加入6 cm 皿中;以同种方法转染pXJ-40-myc 载体作为对照。37℃、5% CO2常规培养,4~6 h 后换液;24 h后收细胞,3000 r/min 离心5 min,弃上清,加入2 倍细胞量的RIPA,于冰上裂解30 min,再加入等量2×SDS 上样缓冲液,沸水煮15 min,12 000 r/min 离心2 min后取上清液进行SDS-PAGE,再电转移至硝酸纤维素膜上;用5%脱脂奶粉于4℃封闭1 h,加入用5%脱脂奶粉以1∶5000 稀释的用HRP 标记的抗myc标签鼠单克隆抗体,室温下轻摇1 h,用1×TBST 洗膜3次,每次5 min;用化学发光法显色10 min,压片显影。
1.4 生长曲线实验
用pXJ-40-myc、5 及10μg 的myc-VHL 质粒分别转染ZR75-1、HepG2 细胞,24 h 后各以每孔3000个细胞的密度接种于5 块96 孔板,每组设3 个复孔,分别在第0、1、2、3、4 d 加入10μL CCK8 后37℃孵育1 h,测定D450nm值,以培养时间为横轴、D450nm平均值为纵轴绘制生长曲线。另收集铺种96 孔板后剩余的细胞进行Western印迹,检测VHL的表达量。
2 结果
2.1 myc-VHL重组质粒的构建与鉴定
以本室保存的人乳腺文库为模板,PCR 扩增人VHL的编码序列,获得长约650 bp 的DNA 片段,与预期大小一致(图1)。将BamHⅠ/XhoⅠ双酶切后的PCR 产物和pXJ-40-myc 载体连接,转化大肠杆菌DH5α感受态,挑克隆后进行菌液PCR 鉴定,若获得与目的条带650 bp 大小接近(图2)的克隆,则初步认为是带有人VHL基因的阳性重组克隆。将所得阳性克隆提质粒,经酶切鉴定,可切出2 条长度分别约为5000和650 bp的条带,且相应的空载体酶切后只见大片段,符合预期结果(图3)。DNA 序列测定结果表明,插入的DNA 序列与人VHL基因的编码序列完全一致(数据略)。
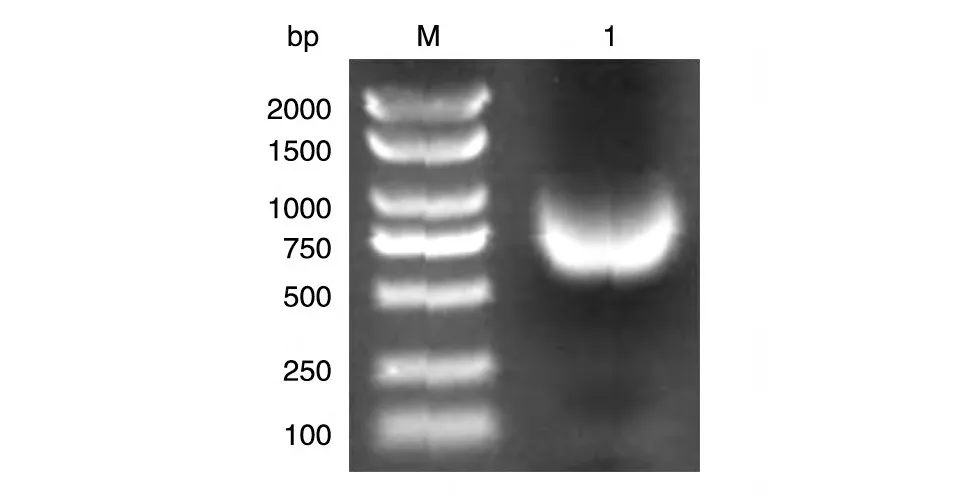
图1 PCR扩增人VHL的编码序列
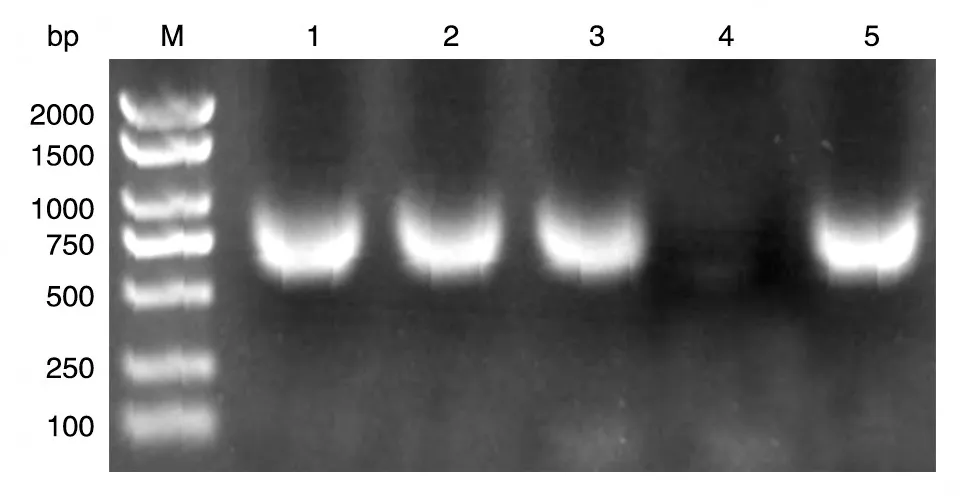
图2 重组质粒pmyc-VHL的菌液PCR结果电泳图谱
2.2 Western 印迹检测myc-VHL 在293T 细胞中的表达
将构建的pmyc-VHL 重组质粒和空载体分别转染293T 细胞系,24 h 后提取蛋白进行SDS-PAGE,Western 印迹检测myc-VHL 蛋白的表达。结果显示,转染重组质粒后,用myc-HRP 抗体可在相对分子质量约26×103处检测到明显的特异性条带,而空载体无条带(图4)。
2.3 CCK8法验证myc-VHL抑制肿瘤细胞系的生长
VHL为抑癌基因,我们用5、10μg 量的pmyc-VHL 真核表达载体及pXJ-40-myc 载体转染乳腺癌ZR75-1、肝癌HepG2 细胞系(图5),通过CCK8 法进行生长曲线实验。结果显示,myc-VHL 能抑制ZR75-1和HepG2 细胞的生长,且转染剂量愈大,其对肿瘤细胞的抑制作用愈明显(图6)。
3 讨论
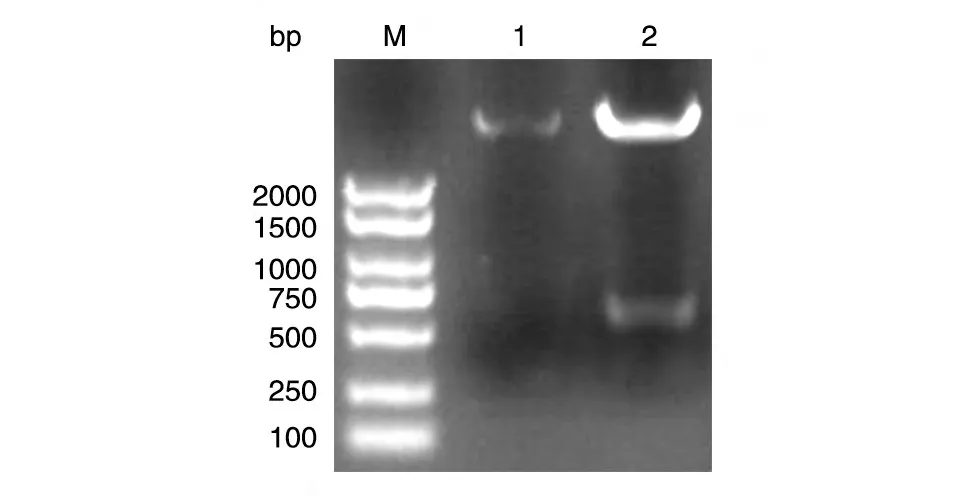
图3 重组质粒myc-VHL的BamHⅠ/XhoⅠ双酶切电泳图谱
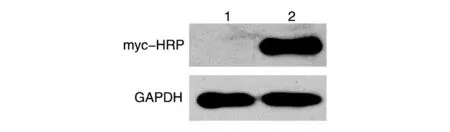
图4 Western印迹检测融合蛋白的表达
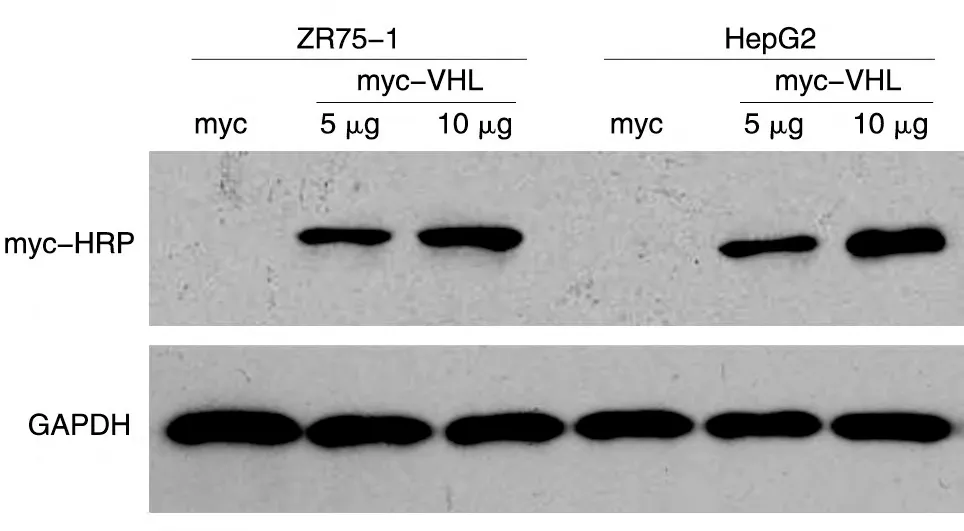
图5 不同剂量myc-VHL在乳腺癌ZR75-1细胞和肝癌HepG2细胞中的表达
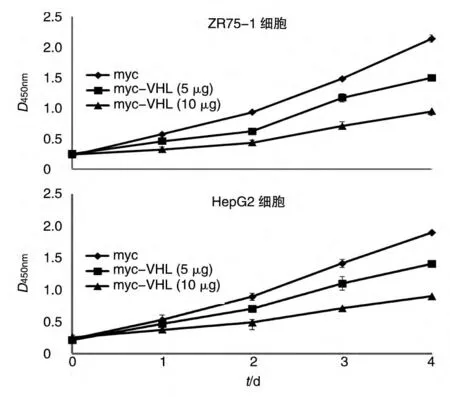
图6 VHL抑制肿瘤细胞生长
VHL基因是抑癌基因,具有典型肿瘤抑制基因的特征,通过多种途径抑制肿瘤的形成。其产物VHL与Wnt信号通路、缺氧诱导因子、氧化磷酸化的调控有关。研究表明,VHL通过参与形成E3泛素连接酶复合体并与低氧诱导因子(HIF-α)结合[7-9];VHL基因失活时VHL 不能正常表达,导致HIF 的含量增加,从而使得GLUT-1、VEGF、EPO、TGF-α等细胞因子表达,这些细胞因子广泛参与细胞内的能量代谢、血管生长、细胞周期、细胞凋亡等生理过程,与肿瘤的发生发展密切相关[10-11]。
目前对于VHL基因的结构与功能及其调控途径的研究已取得重要进展,已明确VHL基因的失活机制主要包括基因突变、杂合性缺失和甲基化,通过对VHL基因失活机制的研究,有助于筛选用于肿瘤早期诊断与预后的新分子标志物。如Volker 等[12]发现肝脏VHL基因缺失后肝组织严重变性;Kong 等[13]发现miRNA-155 通过靶向VHL促进肿瘤血管生成,并与三阴性乳腺癌不良预后相关。但目前的VHL研究还不够全面,例如上调VHL基因表达是否能够预防和治疗肿瘤,还有待于对其更深入的探讨。
综上所述,我们构建的myc-VHL 重组质粒在真核细胞中获得表达,能够抑制肿瘤细胞系如乳腺癌、肝癌细胞系的生长[4,14]。该重组质粒的构建,为后续研究VHL 的抑癌机制,以及从分子水平了解肿瘤的发生发展相关机制奠定了基础,有助于为肿瘤的早期诊断和特异性治疗开辟新的途径。
[1]Sevim A,Ismet Y,Hakan V,et al.Genetic evaluation of von Hippel-Lindau disease for early diagnosis and improved prognosis[J].Int Urol Nephrol,2008,40(3):615-620.
[2]Melanie G H,Rosanne G,Paul K,et al.von Hippel-Lindau disease in pregnancy:a brief review[J].J Clin Neurosci,2009,16(5):611-613.
[3]Latif F,Tory K,Gnarra J,et a1.Identification of the von Hippel-Lindau disease tumor suppressor gene[J].Science,1993,260(5112):1317-1320.
[4]Patard J J,Leray E,Rioux-Leclercq N,et a1.Prognostic value of histologic subtypes in renal cell carcinoma:a multicenter experience[J].Clin Onco,2005,23(12):63-71.
[5]Rodriguez-Gonzalez A,Cyrus K,Salcius M,et al.Targeting steroid hormone receptors for ubiquitination and degradation in breast and prostate cancer[J].Oncogene,2008,27(57):7201-7211.
[6]Nyhan M J,O'Sullivan G C,McKenna S L.Role of the VHL(von Hippel-Lindau) gene in renal cancer:a multifunctional tumor suppressor[J].Biochem Soc Trans,200836(3):472-478.
[7]Kibel A,Iliopoulos O,DeCaprio J A,et a1.Binding of the von Hippel-Lindau tumor suppressor protein to Elongin B and C[J].Science,1995,269(5229):1444-1446.
[8]Heir P,Sufan R I,Greer S N,et al.DCNL1 functions as a substrate sensor and activator of cullin 2-RING ligase[J].Mol Cell Biol,2013,33(8):1621-1631.
[9]Pause A,Lee S,Worrell R A,et al.The von Hippel-Lindau tumor-suppressor gene product forms a stable complex withhuman CUL-2,a member of the Cdc53 family of proteins[J].Proc Natl Acad Sci USA,1997,94(6):2156-2161.
[10]Maxwell P H,Pugh C W,Ratclife P J,et a1.The pVHLHIF-1 system.A key mediator of oxygen homeostasis[J].Adv Exp Med Biol,2001,502:365-376.
[11]Ivanov S V,Ivanova A V,Salnikow K,et al.Two novel VHL targets,TGFBI(BIGH3) and its transactivator KLF10,are up-regulated in renal clear cell carcinoma and other tumors[J].Biochem Biophys Res Commun,2008,370(4):536-540.
[12]Volker H H,Jonathan N G,Merav S,et al.Vascular tumors in livers with targeted inactivation of the von Hippel-Lindau tumor suppressor[J].Proc Natl Acad Sci USA,2001,98(4):1583-1588.
[13]Kong W,He L,Richards E J,et a1.Upregulation of miRNA-155 promotes tumor angiogenesis by targeting VHL and is associated with poor prognosis and triple-negative breast cancer[J].Oncogene.2014,33(6):679-689.
[14]Rodriguez-Gonzalez A,Cyrus K,Salcius M,et al.Targeting steroid hormone receptors for ubiquitination and degradation in breast and prostate cancer[J].Oncogene,2008,27(57):7201-7211.

