第三代慢病毒包装系统优化及Rev表达质粒对慢病毒包装效率作用初探
阮峥,王文天,杨洋,段永娟,胡晓
中国医学科学院、北京协和医学院 血液学研究所血液病医院实验血液学国家重点实验室,天津 300020
慢病毒基因表达系统是目前广泛使用的基因操作工具。该表达系统由用于表达特定基因的目的质粒及病毒gag/pol、Rev和VSVG等组分的包装质粒组成,其中包装质粒提供了病毒基因组mRNA 包装成完整毒粒所必需的结构蛋白、聚合酶和包膜蛋白。获得高滴度的病毒是后期开展基因功能研究的关键。在实际工作中,研究人员大多采用商业化的慢病毒包装产品,或仅将各个包装质粒进行简单混合,通常难以获得针对所研究目的基因的最优化的病毒包装效率。Kumar 等[1]系统研究了不同慢病毒载体质粒的包装能力,发现随着插入片段的延长,病毒滴度呈半对数形式下降,目的质粒愈长则包装活力毒粒的能力愈下降。当研究的目的基因较大时,选择优化后的病毒包装体系才可能得到高效率的病毒毒粒。然而,针对病毒包装体系各组分以获得高效病毒的研究尚为欠缺。我们利用目前广泛应用的三质粒包装体系,对慢病毒包装时目的质粒及各包装质粒的比例进行多个条件的包装效率比较研究,初步分析了慢病毒包装各组分的作用意义,着重比较了Rev表达质粒对提高包装病毒效率的作用,以期建立高效的可用于多种细胞感染的慢病毒包装系统。
1 材料与方法
1.1 材料
293T 细胞与K562 细胞由中国医学科学院血液病医院(血液学研究所)实验血液学国家重点实验室细胞库提供(购自ATCC);感受态大肠杆菌DH5α购自TIANGEN 公司;慢病毒包装的目的质粒pLVXEF1a-GFP-N1(pHEGP)购 自TaKaRa Clontech 公司;病毒包装质粒pLP1-gag/pol、pLP2-Rev和pLPVSVG购自Invitrogen公司。
IMDM、DMEM、OPTI-MEM 低血清培养基、PBS、胎牛血清(FBS)和0.25%胰酶-EDTA 购自Gibco 公司;LipofectAMINE 2000 购自Invitrogen 公司;polybrene 购自Sigma 公司;质粒提取试剂盒为QIAGEN Plasmid Mini Kit 及Maxi Kit;超速离心管购自Nalgene 公司;0.45μm 滤器购自Millipore 公司;低温超高速离心机为Beckman Coulter 公司的Avanti J-30I;数字化分析型流式细胞仪为BD公司的LSRII。
1.2 细胞培养与质粒制备
293T 细胞培养于含10% FBS 的DMEM 培养基中,当细胞密度达到90%时经0.25%胰酶-EDTA 消化传代培养;K562 细胞培养于含10% FBS 的IMDM培养基中,于37℃、5% CO2培养箱中培养,每48~72 h 离心换液。复苏实验室保藏的pLVX-EF1a-GFP-N1(pHEGP)、pLP1、pLP2和pLP-VSVG等5 株大肠杆菌DH5α,振荡培养过夜后用QIAGEN 大提试剂盒提取质粒,经测序验证正确。
1.3 慢病毒包装
慢病毒包装系统由目的质粒、pLP1、pLP2和pLP-VSVG共4 种质粒按一定比例组成,考虑到细胞对质粒的转染存在饱和度,因此在控制总质粒量不变的原则下(10μg/60 mm 中皿),同时改变2 个变量,考察2 个变量间的比例关系及重要性。混合质粒通过脂质体(LipofectAMINE 2000)转染293T 细胞,48 h 后收取含病毒粒子的上清,离心、过滤后置于4℃或-80℃保存。
1.4 病毒感染293T及K562细胞
感染前一天于6 孔板中接种5×105的293T 或K562 细胞,感染时加入1 mL 病毒上清(对照组为1 mL PBS)、1 mL DMEM 或IMDM 完全培养基及终浓度为8μg/mL 的polybrene,加入病毒后12 h 换液,3 d 后荧光镜检观察GFP 荧光,并用流式细胞分析仪检测GFP+细胞百分率,计算病毒感染阳性率。
2 结果
2.1 目的质粒量是影响病毒包装效率的首要因素
以采用不同质粒比例进行病毒包装获得的病毒上清感染293T 细胞,由于目的质粒表达GFP 荧光蛋白,因此感染后GFP 细胞阳性率可用于反映病毒的感染率差异。流式细胞检测结果显示,不同条件获得的病毒上清感染293T 细胞的GFP 阳性率最低组仅11.5%,最高组可达66.8%,说明改变质粒比例会显著影响病毒包装效率。
首先分析目的质粒pHEGP与其余3个包装质粒对病毒包装效率的影响。当pLP1-gag/pol和pLPVSVG质粒均为2.5μg 时,3.5μg pHEGP、1.5μg pLP2-Rev组比1.5μg pHEGP、3.5μg pLP2-Rev组细胞的阳性率提高到约3 倍(图1)。在pHEGP 与pLP1-gag/pol以 及pHEGP 与pLP-VSVG的比较 中,同样发现提高目的质粒量同时递减某一包装质粒量可显著提升GFP 阳性率(数据未示)。以上结果说明,与几个包装质粒相比较,目的质粒的量是影响病毒包装效率的首要因素。
2.2 不同包装质粒的重要性有差异,pLP2-Rev是影响病毒滴度的关键因素
明确目的质粒量对病毒包装效率的决定性地位后,进一步分析3 个包装质粒之间的重要性。将目的质粒pHEGP 固定为3.5μg、3 个包装质粒总量定为6.5μg,分别依次提供低剂量(1.5μg)Rev、gag/pol和VSVG。当提供低剂量VSVG质粒时,病毒感染293T 细胞的GFP 细胞阳性率为66.8%;提供低剂量Rev质粒时,GFP 细胞阳性率低至45.1%;提供低剂量gag/pol质粒时,GFP 细胞阳性率居中为54.9%(图2A)。说明Rev质粒量对高效病毒包装具有至关重要的作用。降低Rev剂量导致病毒包装效率下降最为显著,而减少VSVG用量仍可高效包装病毒。将gag/pol和Rev与VSVG剂量间的相互作用进行对比发现,当采用低剂量VSVG时,增加Rev相对含量较增加gag/pol含量能更好地提升病毒滴度(图2B)。
2.3 白血病细胞系K562 中再现包装病毒的感染效率差异
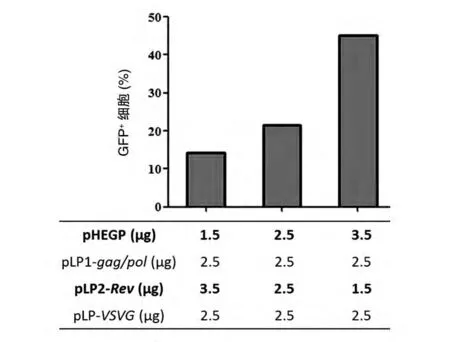
图1 比较目的质粒量对病毒包装效率的影响
血液细胞及干细胞通常较贴壁细胞的病毒感染效率低,因此对病毒的滴度更为敏感。基于采用贴壁的293T 细胞感染筛选优化的病毒包装条件,我们进一步利用白血病细胞系K562 细胞考察不同条件包装病毒的感染效率。由流式细胞分析GFP阳性细胞的结果发现(图3),采用不同质粒比例包装的病毒在K562细胞中同样导致差异的病毒感染率,并且分别改变Rev、gag/pol和VSVG表达质粒的剂量均可取得与感染293T细胞相同趋势的结果。
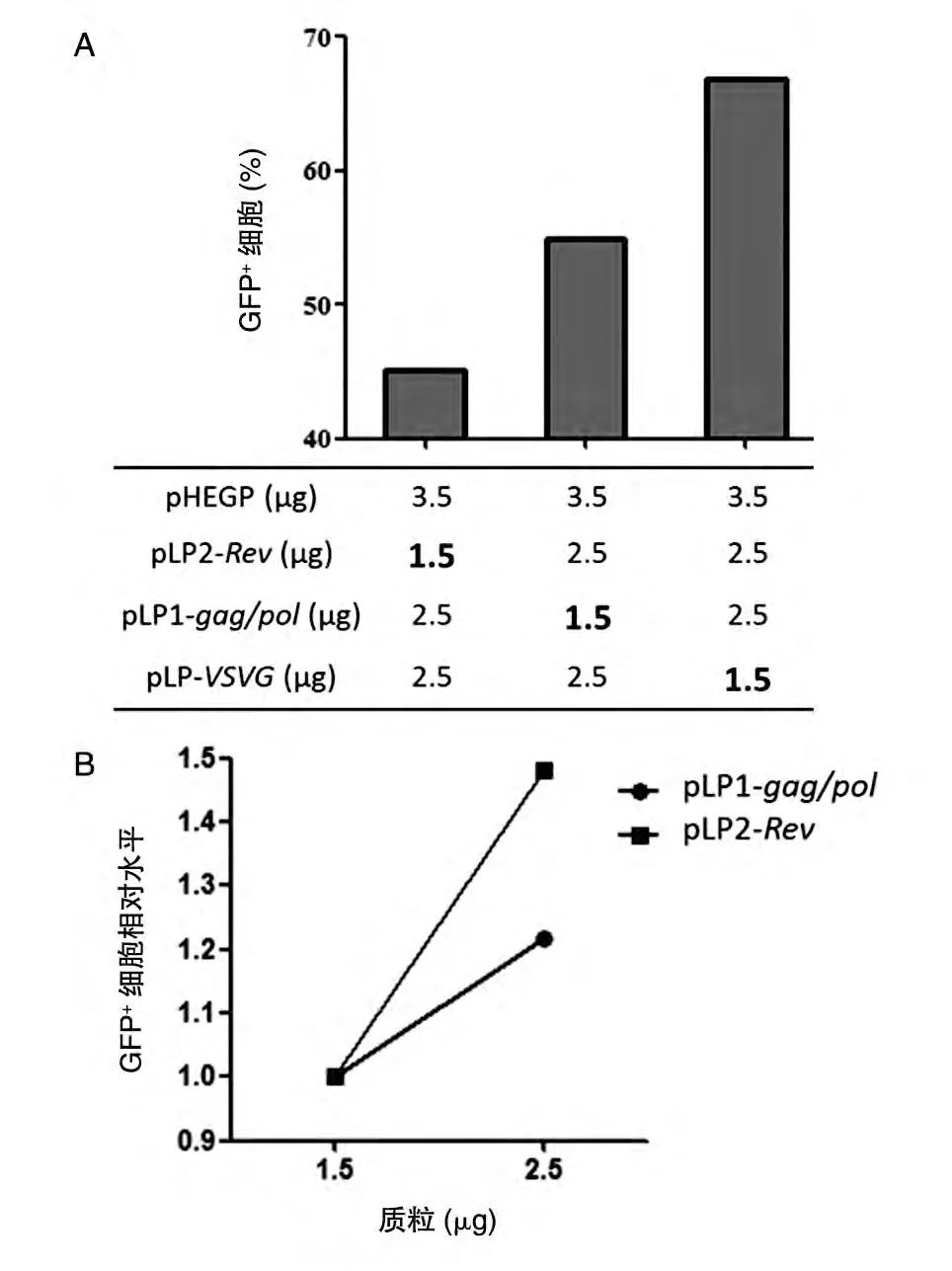
图2 各包装质粒量对病毒包装效率的影响
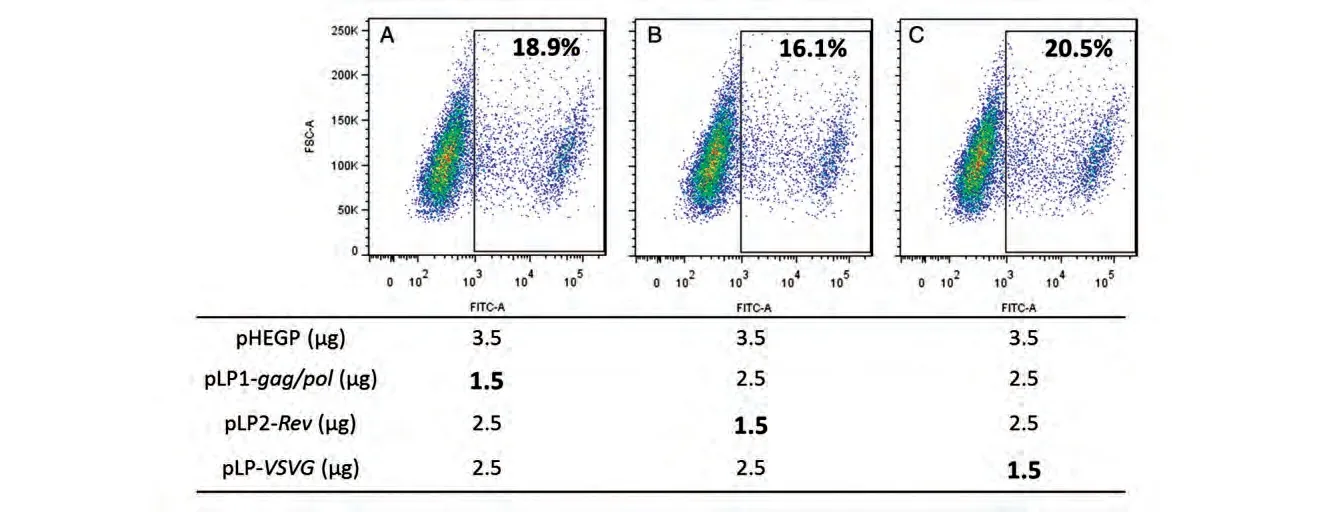
图3 比较不同包装条件获得的病毒感染红白血病恶性细胞系K562细胞的结果
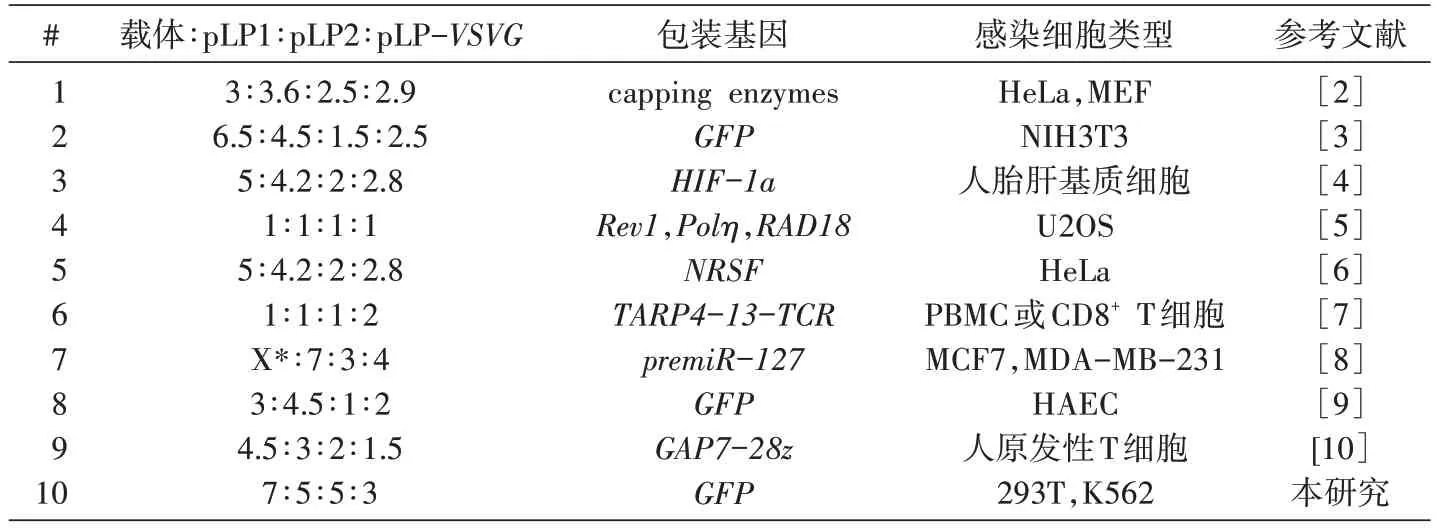
表1 第三代慢病毒包装系统用于不同研究中的质粒比例
3 讨论
基于HIV的慢病毒载体系已成为在哺乳动物细胞中研究基因功能的主流方法,但目前国内外学者采用包装系统中的质粒比例却不尽相同(表1)。大部分研究者在工作中仅采用商业化质粒或简单比例混合,尚未对慢病毒包装系统各成分进行系统优化,尤其是并未意识到pLP2-Rev的比例在病毒滴度提升中的重要性,因此本研究工作具有现实意义。
本研究表明目的质粒量是影响病毒滴度的决定条件,并首次发现Rev 蛋白是影响有效毒粒的关键因素。Cochrane 等发现Rev 蛋白与病毒基因组mRNA上的特定序列RRE(Rev response element)元件结合形成稳定的Rev-RNA 二级结构,该结构对于基因组mRNA 的出核运输具有关键作用[11]。该结合位点突变会导致Rev-RNA 结构异常,进而扰乱病毒的核输出。此外,BSA偶联的Rev激活结构域(BSAR)能够显性抑制Rev 介导的RNA 核输出[12]。可见Rev蛋白对于形成完整长度的病毒基因组RNA 至关重要,病毒基因组RNA 的核输出是保证完整病毒RNA 的关键步骤。这些观点支持了我们的实验结果——高比例的Rev 蛋白可显著提高病毒的感染效率。高剂量Rev蛋白才能实现病毒基因组RNA的高效核输出,避免其被细胞自身的防御系统降解。相对Rev 而言,gag/pol 的重要性次之,pLP1-gag/pol主要提供病毒的结构蛋白及反转录酶和整合酶特性,对于慢病毒活性毒粒必不可少。而VSVG 作为包膜蛋白,仅在细胞与病毒融合时发挥作用[13],对于整个病毒的活性周期而言处于较次要的地位。综上,我们得出了慢病毒包装系统中4 个质粒的相对优先重要性等级,即目的质粒>Rev>gag/pol>VSVG。
已有的研究表明目的质粒中插入片段长度与病毒滴度呈半对数形式负相关[1],探索慢病毒包装优化体系应选择较长的目的质粒作为实验对象,因此实验中选用了此前构建的GFP 表达载体pHEGP。该载体在5'-LTR 与3'-LTR 间插入约2 kb 的片段,大小接近中等长度的基因插入片段。在此情况下进行病毒包装效率的改进,可以更好地模拟实际基因功能研究中体系优化的差异性。实验中对病毒包装效率的评价采用未经浓缩的病毒上清,是基于两方面的考虑,一方面排除超速离心或超速过滤过程中的干扰因素,另一方面排除高滴度浓缩病毒可能对感染率差异的掩盖。
针对建立稳定表达细胞系或难以进行普通转染的实验,通过慢病毒进行基因扰动是当前基础医学的主流方法。慢病毒不仅具有高效率滴度,而且对于发育早期的多能干细胞,尤其是造血干细胞具有不可替代的优势。慢病毒包装作为各大实验室及公司的重要技术基础,建立优化包装体系以提高长基因过表达效率非常重要。我们的实验结果表明,相对低剂量的pLP-VSVG和相对高剂量的pLP2-Rev是优化第三代慢病毒包装体系的重点,这点在低MOI的293T 细胞系及较高MOI 的K562 细胞系中都得到验证,为实现在血液细胞中相关基因的稳定表达和后续功能研究奠定了技术基础。
[1]Kumar M,Keller B,Makalou N,et al.Systematic determination of the packaging limit of lentiviral vectors[J].Human Gene Ther,2001,12(15):1893-1905.
[2]Chu C,Shatkin A J.Apoptosis and autophagy induction in mammalian cells by small interfering RNA knockdown of mRNA capping enzymes[J].Mol Cell Biol,2008,28(19):5829-5836.
[3]May T,Eccleston L,Herrmann S,et al.Bimodal and hysteretic expression in mammalian cells from a synthetic gene circuit[J].PloS One,2008,3(6):e2372.
[4]Ji L,Liu Y X,Yang C,et al.Self-renewal and pluripotency is maintained in human embryonic stem cells by co-culture with human fetal liver stromal cells expressing hypoxia inducible factor 1alpha[J].J Cell Physiol,2009,221(1):54-66.
[5]Hicks J K,Chute C L,Paulsen M T,et al.Differential roles for DNA polymerases eta,zeta,and REV1 in lesion bypass of intrastrand versus interstrand DNA cross-links[J].Mol Cell Biol,2010,30(5):1217-1230.
[6]Zhang J,Wang S,Yuan L,et al.Neuron-restrictive silencer factor(NRSF) represses cocaine-and amphetamine-regulated transcript(CART) transcription and antagonizes cAMP-response element-binding protein signaling through a dual NRSE mechanism[J].J Biol Chem,2012,287(51):42574-42587.
[7]Hillerdal V,Nilsson B,Carlsson B,et al.T cells engineered with a T cell receptor against the prostate antigen TARP specifically kill HLA-A2+prostate and breast cancer cells[J].Proc Natl Acad Sci USA,2012,109(39):15877-15881.
[8]Chen J,Wang M,Guo M,et al.miR-127 regulates cell proliferation and senescence by targeting BCL6[J].PloS One,2013,8(11):e80266.
[9]Krasner N M,Ido Y,Ruderman N B,et al.Glucagon-like peptide-1(GLP-1) snalog liraglutide inhibits endothelial cell inflammation through a calcium and AMPK dependent mechanism[J].PloS One,2014,9(5):e97554.
[10]Zhang G,Wang L,Cui H,et al.Anti-melanoma activity of T cells redirected with a TCR-like chimeric antigen receptor[J].Sci Rep,2014,4:3571.
[11]Cochrane A W,Chen C H,Rosen C A.Specific interaction of the human immunodeficiency virus Rev protein with a structured region in the env mRNA[J].Proc Natl Acad Sci USA,1990,87(3):1198-1202.
[12]Fischer U,Huber J,Boelens W C,et al.The HIV-1 Rev activation domain is a nuclear export signal that accesses an export pathway used by specific cellular RNAs[J].Cell,1995,82(3):475-483.
[13]Emi N,Friedmann T,Yee J K.Pseudotype formation of murine leukemia virus with the G protein of vesicular stomatitis virus[J].J Virol,1991,65(3):1202-1207.

