TPP1基因慢病毒干扰载体的构建及鉴定
张金丁,金蕊,杨丹丹,王亚楠,黄君健,苏金为
1.福建农林大学 生命科学学院,福建 福州 350002;2.军事医学科学院 生物工程研究所,北京 100850;3.沈阳农业大学 生物科学技术学院,辽宁 沈阳 110866
端粒是真核生物细胞染色体末端的天然保护结构,由DNA重复序列TTAGGG和结合在端粒DNA序列上的端粒蛋白复合体组成,对稳定基因组起到至关重要的作用[1]。端粒蛋白复合体(在哺乳类动物中被称为shelterin)由6 个独立的蛋白组成,分别是TRF1(端粒重复结合因子1)、TRF2、RAP1(阻抑蛋白/激活蛋白1)、TIN2(TRF1 相互作用蛋白1)、TPP1(TINT1[2]/PIP1[3]/PTOP1[4])和Pot1(端粒保护蛋白1)。其中TRF1和TRF2 结合在双链DNA 的端粒重复序列上,而Pot1 结合在单链悬突上,这些端粒DNA 结合蛋白通过TPP1和TIN2 的相互作用连接起来,在染色体末端保护和端粒长度调控中至关重要[5]。
有关TPP1 的研究表明,在肿瘤细胞中,TPP1 与Pot1的相互作用具有将Pot1带入细胞核并端粒定位的功能,并在端粒末端负责聚集端粒酶,维持端粒长度的稳态。也有相关研究表明,TPP1和TIN2 是调控装配该蛋白复合体的关键元件,TRF1和TRF2 亚复合体的连接也需要TPP1和TIN2 的作用[6]。TPP1有助于稳定TRF1-TIN2-TRF2 之间的相互作用,并促进6个蛋白复合体的形成。TPP1高表达可以加强TIN2-TRF2 的结合,敲低TPP1 后会降低内源TRF1与TRF2复合体结合的能力,并且蛋白复合体的形成也会受到严重影响[5]。我们利用质粒载体pll3.7构建了抑制人TPP1基因的短发夹RNA(shRNA)干扰载体,用于抑制端粒结合蛋白TPP1 的表达,为后期进一步研究TPP1的生物学功能提供基础。
1 材料和方法
1.1 材料
细胞株293T、HT1080、HepG2,大肠杆菌DH5α,质粒pll3.7(图1),慢病毒包装载体RRE、REV、VSVG由本实验室保存;质粒pCDH-Flag-Pot1、pCDHFlag-TPP1 为本课题组构建;质粒提取试剂盒购自Exygen公司;胶回收试剂盒购自北京天根生物公司;限制性内切酶HpaⅠ、XhoⅠ、EcoRⅠ,T4DNA 连接酶均购自NEB 公司;Flag 抗体和GAPDH 抗体、辣根过氧化物酶标记的抗兔二抗均购自Sigma 公司;Western 印迹显色试剂盒购自Thermo 公司;核酸电泳系统、蛋白质电泳系统、半干转膜仪均购自Bio-Rad公司;其他试剂均为国产分析纯产品。
1.2 靶向TPP1的shRNA设计
根据shRNA设计原则[5],参考GenBank公布的人TPP1序列(NM_000391.3),利用Invitrogen 公司在线设计软件设计shRNA 序列(表1),进行BLAST 同源性分析,保证序列的惟一性。为方便克隆,在其5′端和3′端分别引入HpaⅠ和XhoⅠ酶切位点(为方便后期酶切鉴定,设计序列时将酶切位点的最后一个碱基削掉),反义链的3′端接终止信号TTTTTT,以终止转录。序列由英骏公司合成。
1.3 TPP1干扰载体的构建
将合成的寡核苷酸链退火形成双链DNA(95℃5 min,72℃10 min,自然降至室温),同时将shRNA载体pll3.7 用HpaⅠ/XhoⅠ双酶切,酶切产物纯化后,把退火形成的产物DNA 双链与酶切回收的线性化载体片段于20℃连接4 h,并转化大肠杆菌DH5α感受态细胞,将其涂布在含氨苄西林的LB 平板上,于37℃培养箱中培养过夜,每个平板挑4 个菌落进行培养扩增,提质粒,用EcoRⅠ/HpaⅠ酶切鉴定,将已插入shRNA片段的载体送北京博迈德公司测序。
1.4 慢病毒的包装与感染
将293T 细胞接到10 cm 皿中,于37℃、5% CO2培养箱内培养,当细胞密度达70%~80%时,将慢病毒包装载体RRE∶REV∶VSVG 与干扰质粒按照4.2∶2.1∶3.1∶4μg 混合,加入氯化钠注射用水500μL 混匀,40μL 转染试剂PEI 中同样加入氯化钠注射用水500μL 混匀,然后将两者混合均匀,静置15 min,加入293T 细胞中,72 h 后收上清,用0.45μm的滤膜过滤,得到的上清液即为包装好的病毒,用于感染事先准备好的稳定表达外源蛋白Flag-TPP1 的HT1080 细胞,其余的病毒分装于EP 管中,-80℃冻存,用于反复感染细胞,直到感染效率达90%以上。
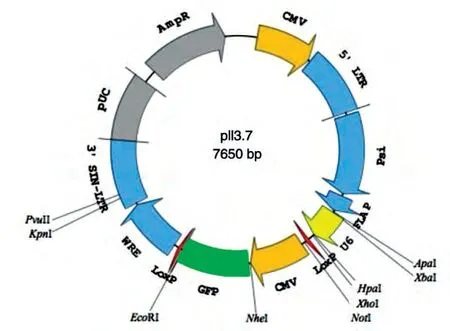
图1 质粒载体pll3.7的结构图谱
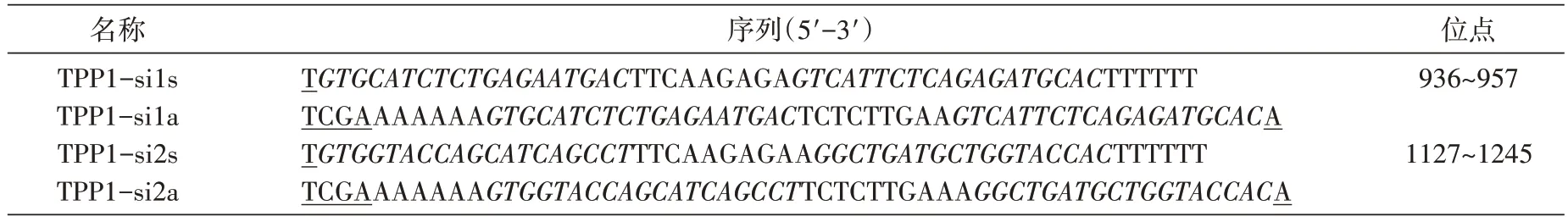
表1 根据人的TPP1基因设计的2对shRNA序列
1.5 TPP1的shRNA干扰效果检测
1.5.1 检测TPP1的shRNA的干扰效果[7]将稳定表达外源蛋白Flag-TPP1 的HT1080 细胞铺到6 孔板中,于37℃、5% CO2培养箱内培养,待细胞密度为60%~80%时进行病毒感染,次日换液并再次感染,在倒置显微镜下观察绿色荧光蛋白的表达情况。在慢病毒表达24和96 h后收取50%的细胞量,按如下程序进行Western印迹检测。
根据样品蛋白分子量大小选择合适浓度的SDS-PAGE 胶进行电泳分离,电泳结束后将目的胶取下,用半干转膜仪将蛋白转移至NC 膜上,注意滤纸、胶和膜要剪成大小一致,防止短路,上层滤纸切勿接触到下层滤纸,转膜电压和时间按照目的蛋白大小进行适当调整;用5%脱脂奶粉(用1×TBST 配制)于室温下摇床封闭1 h 左右;加入用5%脱脂奶粉按一定比例稀释的一抗,室温轻摇1 h 或于4℃冰箱中过夜,1×TBST 洗膜3 次,每次5 min;加入用5%脱脂奶粉按一定比例稀释的二抗,室温轻摇1 h,1×TBST 洗膜3 次,每次5 min;按Thermo 公司的Western 印迹显色试剂盒说明书进行显色2~3 min,压片显影。
1.5.2 检测稳定表达外源蛋白Flag-Pot1 的端粒定位 将稳定表达外源蛋白Flag-Pot1 的HepG2 细胞铺到6 孔板中,于37℃、5% CO2培养箱内培养,待细胞密度为60%~80%时进行感染病毒,次日换液并再次感染,在倒置显微镜下观察绿色荧光蛋白的表达情况。在荧光蛋白表达量达到80%以上时消化细胞,铺12孔板,按如下程序进行免疫荧光试验[8]。
将消化好的细胞用含10%胎牛血清的DMEM混匀后,接种到事先加入盖玻片的12 孔板中,于37℃、5% CO2培养箱内培养,24 h 后观察细胞密度,达到70%~80%后取出12 孔板,弃DMEM 培养液,用1×PBS 洗1 次;每孔加入500μL 4%多聚甲醛,室温固定10 min,弃固定液;每孔加入500μL 封闭液,室温摇床上振荡30 min,弃封闭液,1×PBS 洗3 次,每次5 min;按抗体说明书的要求,用1×PBS 稀释一抗,每片盖玻片孵25~30μL 稀释抗体,于37℃恒温孵育箱中结合1 h 或在4℃冰箱中过夜,在避光条件下用1×PBS 洗膜3 次,每次5 min;用1×PBS 按照一定比例稀释DAPI,每孔加入500μL 染核液,避光染核5~10 min,荧光显微镜下观察染色情况。
2 结果
2.1 TPP1的shRNA序列设计
根据人的TPP1序列设计4 条shRNA 序列(表1),经BLAST 分析人基因数据库序列,TPP1-si1和TPP1-si2 未发现同源序列,说明设计的序列特异性良好。
2.2 TPP1 shRNA干扰载体的鉴定
按前述构建方法构建出逆转录病毒介导的shTPPl 质粒,分别命名为pll-TPP1-si1和pll-TPP1-si2。pll3.7 空载体上有EcoRⅠ酶切位点(第4431 位碱基),同时用EcoRⅠ和HpaⅠ(第2935 位碱基)进行酶切时,可以切下1500 bp 左右的片段,而所构建的干扰质粒在设置酶切位点时被削掉一个碱基,载体与片段连接后无法再被识别,使得pll-TPP1-si1和pll-TPP1-si2 质粒不能被HpaⅠ识别,而只被EcoRⅠ识别,单酶切成线性DNA。鉴定结果如图2,表明外源片段shRNA 序列TPP1-si1和TPP1-si2 已插入pll3.7 载体。将测序结果与原设计的序列用DNAMAN 软件进行比对,匹配率为100%,表明正确插入了外源片段序列。
2.3 pll-shRNA抑制TPP1蛋白表达的效果检测
用构建的干扰质粒及空载体pll3.7 进行慢病毒的制备,转染效率如图3 所示。将制备的慢病毒pll3.7、pll-TPP1-si1和pll-TPP1-si2 感染高表达外源性TPP1 蛋白的HT1080 细胞,分别在表达后24和96 h 收细胞进行Western 印迹,结果用PhotoShop 7.0 软件分析(图4),设计的2 条shRNA 对TPP1 都有不同程度的抑制效果,且抑制效果随感染时间的延长而增强,24 h的抑制效果分别为34.88%、30.59%,96 h 的抑制效果分别为70.56%、67.71%,其中pll-TPP1-si1对TPP1蛋白表达的抑制效果最好。
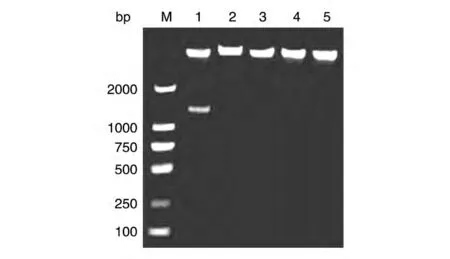
图2 干扰质粒双酶切鉴定的琼脂糖电泳
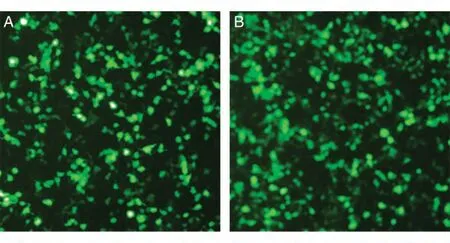
图3 空载体pll(A)和shRNA序列(B)对293T细胞的转染效率
2.4 shRNA 敲低TPP1 蛋白表达水平后,检测稳定表达外源蛋白Pot1的端粒定位
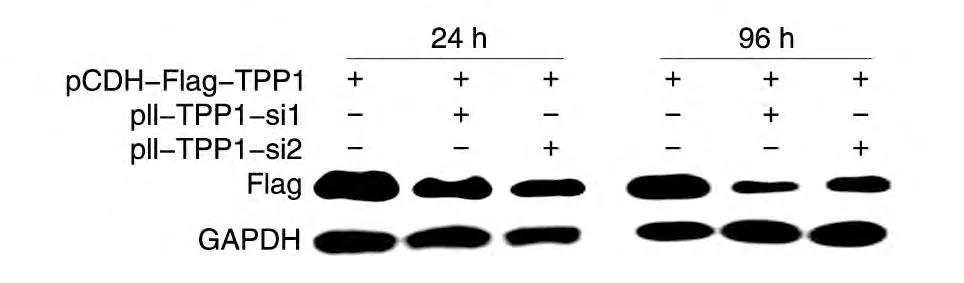
图4 Western印迹检测pll-TPP1-si1和pll-TPP1-si2病毒对高表达外源TPP1的HT1080细胞的抑制效果
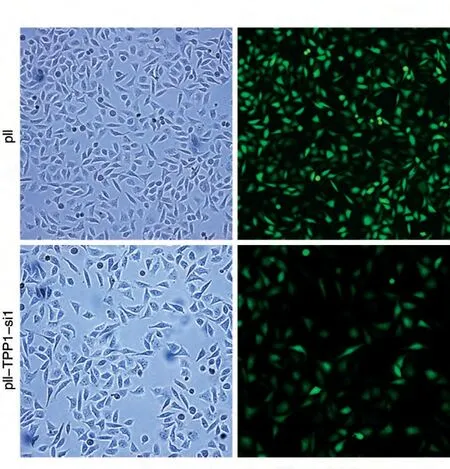
图5 荧光观察空载体pll和pll-TPP1-si1病毒对HepG2细胞的感染效率
选取抑制效果好的pll-TPP1-si1 病毒,以空载体pll 慢病毒为对照,感染稳定表达外源蛋白Flag-Pot1的HepG2细胞,多次感染直到感染效率达80%~90%时(图5)将细胞铺到12 孔板中,24 h 后进行免疫荧光试验,结果如图6。相关研究报道端粒蛋白Pot1 进入细胞核及端粒定位需要TPP1 的介导[9]。感染空载体pll和pll-TPP1-si1慢病毒的试验组HepG2细胞在绿色荧光下呈现绿色荧光。Pot1由于内源性TPP1 受到抑制,使得Pot1 能入核,但无法端粒定位,在红色荧光下观察不到端粒的点状聚集;而对照组由于不带有TPP1shRNA 干扰序列,不能抑制内源TPP1 的表达水平,从而不影响Pot1 进入细胞核并端粒定位,在红色荧光下观察到有红色点状聚集。以上免疫荧光分析表明构建的pll-TPP1-si1 干扰质粒能有效抑制内源性TPP1的表达。
3 讨论
肿瘤细胞中的端粒及端粒结合蛋白一直是研究热点之一。有研究报道,端粒在确保基因组的稳定性和完整性上至关重要[10],端粒内稳态在癌症治疗,尤其是放射治疗方面具有很好的潜能[11]。哺乳动物细胞通过端粒特有的蛋白可以区分正常染色体末端,使其不被识别为损伤的DNA 而诱发ATM(ataxia-telangiectasia mutated)或ATR(ataxia-telangieetasia and Rad3 related)介导的DNA 损伤反应,出现DNA 损伤蛋白53BPl和γ-H2AX 在端粒的聚集,导致细胞增殖衰竭或凋亡[12]。
端粒蛋白TPP1 在Pot1 功能调控上具有多层次意义,涉及Pot1入核、入核后的端粒定位及Pot1到达端粒后最终发挥功能等多个过程步骤[5]。Pot1 蛋白在端粒上具有重要的功能,能够保护和决定染色体DNA的5′端序列[13]。RNA干扰敲低Pot1后会导致端粒延长,出现染色体的不稳定性[14],TPP1敲低后也会出现类似现象,并抑制Pot1 募集到端粒[15]。Pot1 与TPP1 相互作用能够调控端粒酶到达染色体末端,并且保护端粒免受DNA 损伤[4]。而且,也有体外试验表明Pot1 与TPP1 相互作用能增强端粒酶的合成能力[16]。大多数肿瘤细胞在分裂增殖过程中保持稳定的端粒长度,进行持续分裂[17]。因而,在肿瘤细胞中通过敲低端粒蛋白来诱导其端粒功能障碍有可能成为一种新的治疗方案。
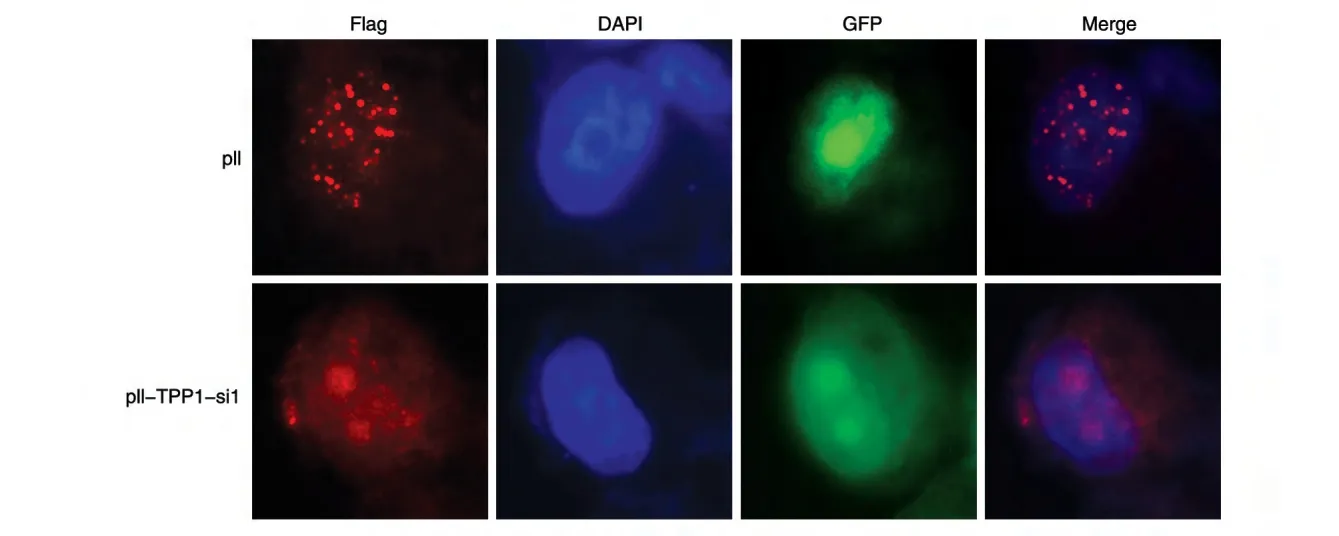
图6 免疫荧光观察稳定表达Flag-Pot1的HepG2细胞感染pll和pll-TPP1-si1病毒
我们采用shRNA 设计原则构建出2 个抑制TPP1基因的shRNA 干扰载体,Western 印迹初步鉴定能够有效抑制TPP1蛋白的表达,并且在稳定表达外源蛋白Flag-Pot1 的HepG2 细胞中进行了功能验证,免疫荧光结果表明感染pll-TPP1-si1 病毒的细胞由于内源TPP1蛋白受到抑制,从而导致其介导的Pot1 不再端粒定位。总之,本试验为后期探讨TPP1的生物学功能奠定了基础。
[1]Takai K K,Kibe T,Donigian J R,et al.Telomere protection by TPP1/POT1 requires tethering to TIN2[J].Mol Cell,2011,44(4):647-659.
[2]Liu D,Safari A,O'Connor M S.POTOP interacts with Pot1 and regulates its localization to telomeres[J].Nat Cell Biol,2004,6(7):673-680.
[3]Houghtaling B R,Cuttonaro L,Chang W,et al.A dynamic molecular link between the telomere length regulator TRF1 and the chromosome end protector TRF2[J].Curr Biol,2004,14:1621-1631.
[4]Ye J Z,Hockemeyer D,Krutchinsky A N,et al.Pot1-interacting protein PIP1:A telomere length regulator that recruits Pot1 to the TIN2/TRF1 complex[J].Genes Dev,2004,18:1649-1654.
[5]O'Connor M S,Safari A,Xin Huawei,et al.A critical role for TPP1 and TIN2 interaction in high-order tel omeric complex assembly[J].Proc Natl Acad Sci USA,2006,32:11874-11879.
[6]Kibe T,Osawa G A,Keegan C E,et al.Telomere protection by TPP1 is mediated by POT1a and POT1b[J].Mol Cell Biol,2010,30(4):1059-1066.
[7]Han X,Liu D,Zhang Y,et al.Akt regulates TPP1 homodimerization and telomere protection[J].Aging Cell,2013,12(6):1091-1099.
[8]Bhanot M,Smith S.TIN2 stability is regulated by the E3 ligase Siah2[J].Mol Cell Biol,2012,32(2):376-384.
[9]Chen L Y,Liu D,Zhou S Y.Telomere maintenance through spatial control of telomeric proteins[J].Mol Cell Biol,2007,27:754-761.
[10]Taylor D J,Podell E R,Taatjes D J,et al.Multiple POT1-TPP1 proteins coat and compact long telomeric single-stranded DNA[J].J Mol Biol,2011,410(1):10-17.
[11]Yang Lei,Wang Wenbo,Hu Liu,et al.Telomere-binding protein TPP1 modulates telomere homeostasis and confers radioresistance to human colorectal cancer cells[J].PLoS One,2013,8:1-11.
[12]d'Adda di Fagagnn F,Teo S H,Jackson S P.Functional links between telomeres and proteins of the DNA-damage response[J].Genes Dev,2004,18(15):1781-1799.
[13]Hockemeyer D,Sfeir A J,Shay J W,et al.POT1 protects telomeres from a transient DNA damage response and determines how human chromosomes end[J].EMBO J,2005,24:266-2678.
[14]Veldman T,Etheridge K T,Counter C M.Loss of hPot1 function leads to telomere instability and a cut-like phenotype[J].Curr Biol,2004,14:2264-2270.
[15]Liu D,Safari A,O'Connor M S,et al.PTOP interacts with POT1 and regulates its localization to telomeres[J].Nat Cell Biol,2004,6:673-680.
[16]Latrick C M,Cech T R.POT1-TPP1 enhances telomerase processivity by slowing primer dissociation and aiding translocation[J].EMBO J,2010,29:924-933.
[17]Deng Yibin,Chang S.Role of telomeres and telomerase in genomic instability,senescence and cancer[J].Lab Invest,2007,87(3):107l-1076.

