端粒蛋白复合物shelterin的结构及功能研究进展
王 晗,倪 娟,2,薛京伦,汪 旭,2,*
(1.云南师范大学生命科学学院,云南 昆明 650500;2.云南师范大学生物能源持续开发与利用教育部工程研究中心,云南昆明 650500;3.复旦大学生命科学学院,上海 200433)
端粒(telomere)位于真核生物线性染色体末端,是稳固真核生物染色体、保护遗传信息完整的必要组分。端粒长度的调节对维持端粒结构及功能的稳定至关重要,也在维护染色体末端的完整性及稳定性方面起重要作用[1]。端粒缩短与衰老相关,而当细胞在端粒极短时继续存活,则会引起端粒结构和功能紊乱,导致基因组不稳定性发生,增加疾病发生风险[2]。目前,端粒长度已成为退行性疾病如心血管疾病、阿尔兹海默症、风湿性关节炎等的重要生物指标[3]。端粒酶(telomerase)、端粒蛋白复合物(shelterin)以及众多与端粒相互作用的因子,均参与调控端粒长度。任何端粒相关蛋白因子表达改变均与端粒功能失调、细胞衰老加速相关,进而导致基因组不稳定性以及疾病的发生和发展[4]。
其中,shelterin复合物对端粒结构及功能的重要维护作用逐渐凸显。近年来研究发现,shelterin复合物表达异常、蛋白质结构改变或发生基因突变,容易引起端粒脱帽、端粒长度改变,对端粒结构和功能产生严重影响,易引起染色体末端融合、基因组稳定性下降等恶性事件的发展,与疾病发生密切相关。Shelterin复合物各组分的结构及其端粒维护功能甚至非端粒功能的研究,对端粒生物学、端粒相关的退行性疾病研究均具有重要意义,也在癌症早期诊断、干预和治疗过程中具有潜在作用。本文对shelterin复合物的结构和各组分的功能研究进展进行综述。
1 端粒蛋白复合物shelterin
在结构上,端粒序列由双链DNA区和一个富含G的3′端悬突即单链DNA区组成。Shelterin复合物可通过与端粒特异性结合,使端粒末端类似DNA双链断裂(DNA double-strand break,DSB)结构形成端粒环(telomere-loop,T-loop),帮助端粒成帽,保护染色体末端免遭DSB识别,抑制DNA损伤应答(DNA damage response,DDR),维护端粒结构和功能完整,保护染色体末端稳定[5]。人的shelterin复合物由6种核心蛋白质组成:端粒重复结合因子1和2(telomeric repeat-binding factors 1 and 2,TRF1,TRF2),TRF1相互作用蛋白 2(TERF 1-interacting protein 2,TIN2),TRF2相互作用蛋白1(TRF2-interacting protein 1,RAP1),端粒保护蛋白1(protection of telomeres 1,POT1)以及POT1结合蛋白1(telomere-binding protein POT1-interacting protein 1,TPP1)[6]。其中,TRF1 和TRF2与端粒双链DNA结合;TPP1与POT1结合后募集POT1到端粒区;POT1可特异性识别端粒单链DNA;RAP1通过与TRF2相互作用定位到端粒;最后,TIN2起到桥梁作用将POT1-TPP1与TRF1、TRF2连接,从而将整个shelterin复合物结合到一起,稳定端粒结构(图1所示)。
Shelterin复合物可抑制端粒区包括ATM和ATR信号传导、非同源末端连接、同源重组等介导的DNA损伤信号通路及DNA修复途径激活,并通过螯合端粒3′端悬突来阻止外切核酸酶对端粒区的降解,它还可通过影响端粒酶到达端粒区的进程来调控端粒长度[8]。Shelterin复合物完成对端粒稳定维护的前提,必须是shelterin各组分的结构和功能完整。
2 TRF1和TRF2
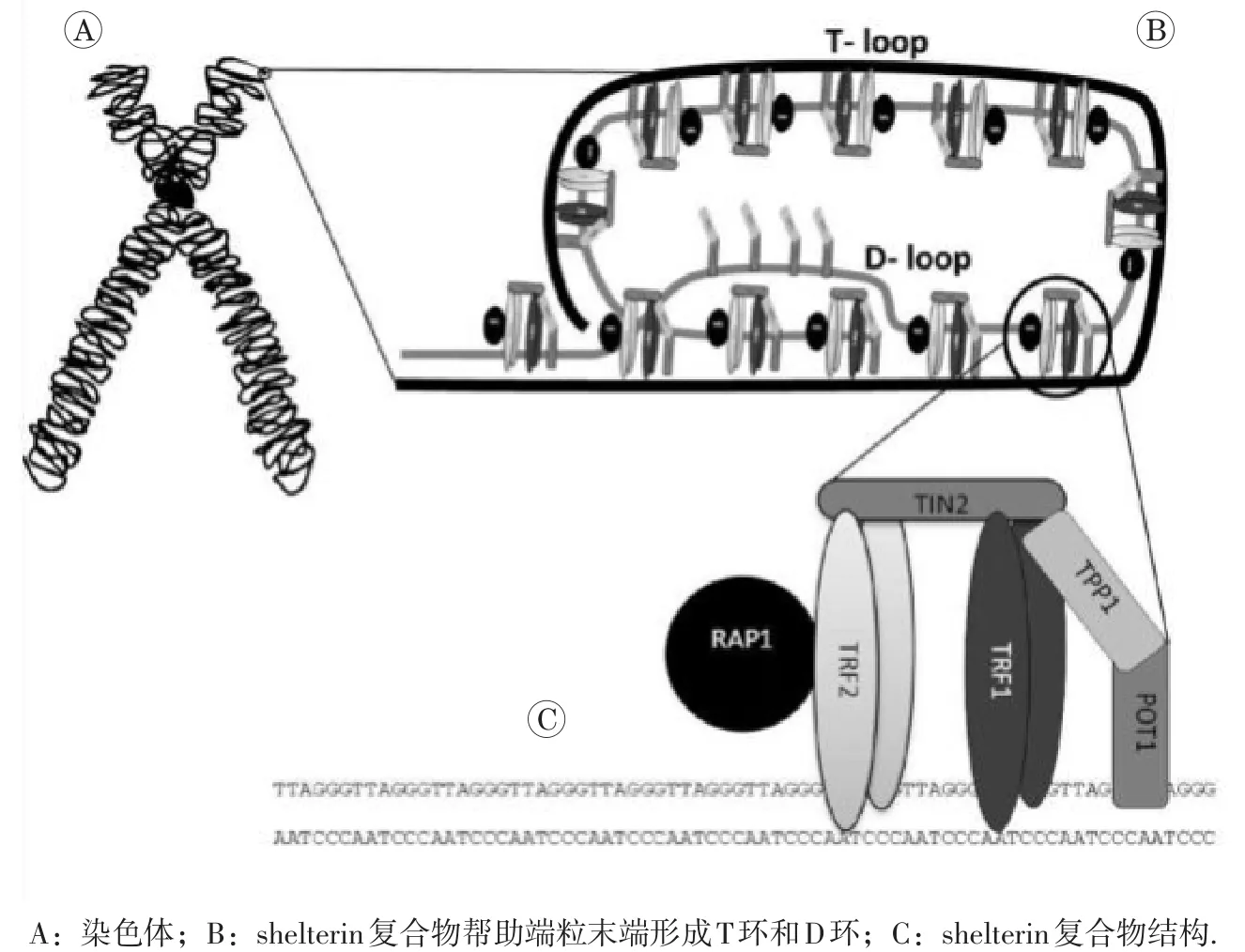
图1 端粒与shelterin复合物[7]
Shelterin的两个亚基TRF1和TRF2均具有对端粒双链DNA特异性结合的C端Myb-SANT DNA结合结构域、铰链结构域和二聚化结构域,TRF2还具有RAP1结合基序[9]。TRF1和TRF2必须先构成同源二聚体,才能与端粒序列紧密结合。TRF2具有拓扑异构酶活性,可帮助端粒3′端悬突插入双链DNA中形成T-loop,有效隐藏了端粒末端,它还负责端粒成帽,对保护端粒完整性至关重要[10]。
研究发现,TRF1最主要的作用是负向调控端粒长度[11],并参与端粒DNA复制[12]。TRF1删除会阻止ATM-TRF1相互作用,阻碍P53和CHK2募集,使DNA损伤区域的复制叉继续前进,最终导致细胞分裂异常和基因组不稳定[13]。而TRF2可正向调控端粒长度,TRF2同源二聚体结构还可特异性抑制端粒区ATM依赖的DNA损伤信号,这个结构是许多修复蛋白如Apollo、SLX4、RTEL1的结合中心,TRF2的表达减少可激活端粒区ATM激酶通路,导致非同源末端连接引起的端粒融合[10,14-15]。端粒锌指相关蛋白(telomeric zinc finger-associated protein,TZAP)可与TRF2竞争结合到端粒区来调控端粒长度,开启并触发端粒修剪(telomere trimming),设定端粒长度上限,维护基因组稳定,但在TRF2过表达的细胞中定位到端粒区的TZAP会大大降低,说明TRF2过表达会取代TZAP的位置[16]。
细胞中TRF1和TRF2表达改变在癌症发生、发展过程中出现。Diehl等[17]发现,TRF2表达下降引起端粒缩短,促使乳腺癌恶化。Pal等[18]发现,在肾细胞癌中,TRF1和TRF2的转录水平和蛋白水平均呈高表达状态,而沉默TRF1和TRF2可引起肾癌细胞A498细胞周期阻滞,凋亡发生。TRF1和TRF2的表达状况可能在肿瘤早期诊断中成为指标。
3 POT1和TPP1
POT1可高特异性、高亲和性结合端粒单链DNA,在端粒区,POT1与TPP1会形成异源二聚体,并依赖POT1的寡核苷酸结合折叠(OB-fold)结构域结合到端粒3′端,阻止复制蛋白的募集,抑制端粒区类似DNA双链损伤的激活[19]。人POT1有3个OB-fold结构域,它们负责与端粒DNA结合,并对POT1与TPP1相互作用构成紧密的异源二聚体非常重要。TPP1与POT1的结合,可提高POT1与单链DNA的紧密程度,促进POT1与端粒区单链DNA结合,保护染色体末端稳定[20]。TPP1的N端OB-fold结构域还可与端粒酶重要组分TERT相互作用,将端粒酶募集到染色体末端,并且与POT1一起增加端粒酶延伸活性,调节端粒长度[21]。
POT1还是癌症中最常见的突变型shelterin组分。由于POT1抑制DNA损伤信号传导和修复激活的能力均需要OB-fold的参与,所以有研究认为OB-fold突变促进了基因组不稳定性且可引发肿瘤[22]。Chen等[23]发现POT1 C端的A364E、P371T、E572K等突变位点可破坏POT1与TPP1结合,引起POT1蛋白改变,导致基因组不稳定性增加。Rice等[19]也发现POT1 C端的P446Q、C591W、Q623H等位点突变可扰乱POT1的C端折叠,或破坏POT1-TPP1结合及POT1-TPP1与端粒的亲和力,导致基因组不稳定并促进如黑色素瘤等癌症发生。
除基因突变外,POT1或TPP1删除或表达改变,同样与疾病产生相关。Qiang等[24]发现在利用ALT延长端粒的U2OS细胞中,TPP1删除导致端粒缩短、凋亡发生和细胞辐射敏感性增强。Ahmad等[25]在吸烟者、肺气肿和慢阻肺病患者中发现TPP1表达降低,并伴随持续的端粒DNA损伤和细胞衰老,他们发现吸烟会破坏TPP1与去乙酰化酶的相互作用,导致TPP1乙酰化和蛋白降解增加。
4 TIN2
TIN2是POT1-TPP1复合物与TRF1、TRF2相连接的桥梁,也起到稳定TRF1、TRF2与双链DNA连接的作用。研究发现,TIN2的异常会引起shelterin复合物不能完整组装并紧密结合到端粒区。先天性角化不良(dyskeratosis congenita,DC)患者的统一特征是端粒异常缩短,Frescas等[26]研究证实携带TIN2突变的DC患者将具有更短的端粒且伴随有疾病加重的现象。Chen等[27]在TIN2敲除的细胞中也观察到TRF2功能的降低,在TIN2敲除的细胞中,过表达TRF2并不能完全抑制ATM激酶信号通路的激活,TRF2突变引起TIN2结合的改变也会引起ATM信号通路的部分激活。
除TIN2的端粒功能外,近几年有研究发现了TIN2的非端粒功能。Sullivan等[28]发现,定位于线粒体的TIN2可减少ATP的产生并增加ROS的生成,而线粒体长期缺失TIN2会导致细胞代谢增殖加速,引起细胞增殖的异常,易诱导细胞癌变。
5 RPA1
抑制因子激活蛋白1(repressor/activator protein 1,RAP1),是shelterin中保守度最高的组分。人RAP1包含4个蛋白质相互作用域:N末端的BRCT结构域,两个中心Myb结构域以及C末端的RPA1蛋白相互作用即RCT结构域,其中,RCT结构域在RAP1与TRF2的相互作用中起关键作用[29]。RAP1通过与TRF2相互作用结合到端粒序列上,形成稳定的复合物,但其对端粒成帽却是一个非必须蛋白[30]。即使如此,RAP1和TRF2之间的相互作用对端粒功能和染色体末端维护仍然重要[29]。Kabir等[31]发现在没有Ku 70/80的情况下,RAP1-TRF2复合物可有效抑制染色体末端的同源性修复。Benarroch等[32]也发现在端粒保护机制受损时,端粒区RAP1可作为防止非同源末端连接的备用机制,保护端粒末端稳定。RAP1表达还与肾细胞癌相关[33],RAP1通过其端粒相关作用稳固端粒结构,RAP1表达改变同样可导致疾病发生。
6 展望
端粒结构和功能完整对基因组稳定性维持起重要作用,端粒异常与基因组不稳定性相关,容易增加疾病风险。大量研究已证实,shelterin复合物起到维持端粒稳定和调控端粒酶进程的重要作用,因shelterin复合物表达异常或结构改变引起端粒功能失调可推动癌症发生、发展。目前,已发现通过抑制TRF1来诱导癌细胞端粒脱帽,进而引起端粒损伤以及细胞死亡,可将TRF1作为肺癌治疗潜在靶点,同时,多种肿瘤中均发现TRF2、TPP1表达上调,也突出shelterin成员有希望作癌症早期诊断、干预和治疗的潜在靶点[34],而检测POT1的N端及C端突变位点也可在预防和治疗癌症中起到关键作用。任何shelterin复合物组分发生表达、结构改变,都将影响整个shelterin复合物与端粒区的稳定结合,因此shelterin组分精细结构及特定功能的全面深入研究,对清晰解读端粒生物学、预防和治疗癌症等方面将有极大的促进作用。

