富含羧基的多肽基双亲水杂化共聚物控制碳酸钙的形成*
黄玉刚,褚曰环,何明辉,曾兆华,杨建文
(1.广州医科大学药学院化学教研室,广东广州 510183;2.中山大学化学与化学工程学院//聚合物复合材料及功能材料教育部重点实验室,广东广州 510275)
生物矿物质精确和高超的结构与功能都反映了生物大分子,尤其是蛋白质对其形貌、尺寸及晶体取向的控制作用。蛋白质与矿物质相互作用,扮演结构指导剂的角色。Addadi和 Morse[1-2]发现,软体动物的可溶性壳蛋白对构成其外壳的CaCO3的晶型与取向起决定性作用。大自然这种神奇的功能激发了科学家们利用合成化合物来模拟生物大分子结构和功能的兴趣。CaCO3是自然界最为广泛存在的矿物质之一,它对生物有机体起着重要的作用。因此,利用合成材料来模拟CaCO3的生物矿化过程是目前的研究重点之一。CaCO3的生物矿化过程可用聚合物来模拟,例如明胶、己内酯-丙烯酸嵌段共聚物等[3-4]。尽管这些材料对 CaCO3晶体的取向或晶型等起到一定的调控作用,但是它们的本身结构却与蛋白质完全不同。基于多肽的嵌段共聚物是更为理想的材料,因为多肽和蛋白质一样具有α-螺旋或 β-折叠的二级结构,分子组成也近似。Yu和Cofen[5-7]利用基于多肽的嵌段共聚物或共聚多肽来控制CaCO3在DMF相中的矿化,成绩卓著。不过这些多肽结构比较简单,侧链的羧基含量也比较少,而且CaCO3在水相环境下的生物矿化更有意义。
本文中,结合N-羧基-环内酸酐开环聚合和“巯-炔”光点击反应 (Thiol-Yne)制备了侧链富含羧基的多肽基双亲水杂化共聚物,利用它来指导CaCO3在水溶液中的生物矿化,并探讨多肽的浓度、构象如何对CaCO3的形貌、尺寸和晶型产生影响。多肽嵌段共聚物的制备过程如示意图1所示,其中端氨基的聚乙二醇单甲醚 (PEO-NH2)为引发剂,γ-炔丙基-L-谷氨酸酯 (PLG-NCA)为开环单体,得到的聚合物记为PEO-b-PPLG;多肽侧链的炔基在紫外光条件下用3-巯基丙酸 (MPA)改性,目标产物记为 PEO-b-PPLG-g-MPA。
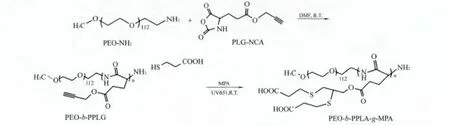
图1 PEO-b-PPLG-g-MPA 的合成路线Fig.1 A route for synthesis of polypeptide-based polymer of PEO-b-PPLG-g-MPA containing rich carboxyl groups
1 实验部分
1.1 原料
3-巯基丙酸 (MPA)(w>97%)和 ω-氨基 -聚乙二醇单甲醚 (PEO-NH2,Mn=5000 g/mol)购自Sigma-Aldrich,没有进一步纯化。透析袋 (相对分子质量为4000)使用前用热水浸泡。N,N-二甲基甲酰胺 (DMF)加入氢化钙过夜,蒸馏,加入0.4 nm分子筛保存备用。光引发剂UV651(2,2-二甲氧基-1,2-二苯乙酮)为工业级,用甲醇重结晶。紫外光光源采用中压汞灯点光源,光照强度为20 mW/cm2。
1.2 样品合成
1.2.1 PLG-NCA、PEO-b-PPLG 和 PEO-b-PPLG-g-MPA 的合成 PLG-NCA 根据文献方法合成[8]。PEO-b-PPLG的合成是在反应瓶中将 PLG-NCA(0.8 g,3.70 ×10-3mol)用 4 mL DMF 溶解,N2鼓泡 20 min。再将溶有 0.2 g PEO-NH2的 2 mL DMF溶液用注射器注入。磁力搅拌下整个体系持续地通入N2,室温条件反应3 d,整个过程用干燥装置保护。反应结束后将溶液缓慢滴加到60 mL乙醚中沉淀出产物 PEO-b-PPLG,然后分别用乙醚、甲醇和水洗涤,减压干燥。
将0.1 g PEO-b-PPLG 溶于1.5 mL DMF 中,然后按炔基和MPA比例为1∶4加入适量MPA。待聚合物完全溶解后再添加φ=5%的UV-651,室温下用20 mW/cm2紫外光照射30 min。透析法提纯产物,最终得到产物 PEO-b-PPLG-g-MPA。
1.3 测试和表征
1H NMR由Varian 300核磁共振仪采集,室温下以DMSO-d6、CDCl3或 D2O为溶剂;GPC曲线由Waters高效凝胶色谱系统采集,PS柱子为固定相;CD采用JASCO-810圆二色谱仪在室温条件下测定,首先将聚合物溶解在pH为12的水溶液中,然后稀释至0.1 mg/mL,50 nm/min中速扫描,响应时间为1 ms,光径为1 cm;由JSM-6330F冷场发射SEM观察CaCO3形貌,将含有CaCO3颗粒的水滴在载玻片上,多余的水用滤纸吸干,然后放在干燥器内自然挥发,样品测试前不经热处理。XRD采用Rigaku D-MAX 2200 VPC粉末X射线衍射仪在室温下收集,扫描速率8(°)/min。Cu Kα1激发,波长0.15406 nm,范围20°~70°。CaCO3的尺寸由 Nano Measurer 1.2.5软件统计。
1.4 CaCO3在水溶液中的生物矿化的模拟
在实验室利用Na2CO3水溶液和CaCl2水溶混合的方法来模拟CaCO3的生物矿化过程,本实验采用两种方法,与Colfen[5]采用的方法类似。具体可分为双注射法和单注射法,双注射法具体过程为:先配制一系列浓度不同的5 mL聚合物水溶液,pH调整到10或12;然后向聚合物溶液中同时注入0.16 mL、0.5 mol/L的Na2CO3水溶液和同等体积、浓度的CaCl2水溶液,流速均为0.03 mL/min。注入完毕,在室温下保持CaCO3结晶,定时取样进行形貌分析;单注射法具体过程为:先配制一系列浓度不同的5 mL聚合物水溶液,pH调整到10或12;向聚合物溶液中注入0.16 mL、0.5 mol/L的CaCl2水溶液,室温静置12 h。此时再以0.03 ml/min的速度注入同等体积、浓度的Na2CO3水溶液,定时取样进行形貌分析。
2 结果与讨论
2.1 多肽基双亲水杂化共聚物的合成、表征及构象性质

图2 PPLG 和 PEO-b-PPLG-g-MPA 的核磁图Fig.2 1H NMR spectra of PEO-b-PPLG and PEO-b-PPLG-g-MPA

图3 PEO 和 PEO-b-PPLG 的 GPC曲线Fig.3 GPC chromatograms of PEO and PEO-b-PPLG determined in DMF at 50 and in the presence of 0.1 mol/L LiBr
PEO-b-PPLG 采用 PLG-NCA 单体的开环聚合法,以数均相对分子质量为5000的PEO-NH2为大分子引发剂。MPA与侧链炔基之间的Thiol-Yne点击反应在365 nm的紫外光照射下,添加光引发剂UV-651辅助进行,目标产物记为 PEO-b-PPLG-g-MPA。一个炔基可以和两个巯基分子发生反应,因此与传统的聚谷氨酸基嵌段共聚物相比,明显地增加了羧基含量。PEO-b-PPLG 和 PEO-b-PPLG-g-MPA的1H NMR见图2所示,其中包含反应前后各个质子峰的位置。在图3中PEO和PEO-b-PPLG的GPC曲线中后者为一单峰,表明成功合成了目标聚合物,Thiol-Yne点击产物的具体表征见本课题组前期报导[8]。本方法具有“点击”反应的特征,无须基团保护,提纯简单,效率高,最大的优势是Thiol-Yne点击反应无需使用铜盐做催化剂,避免了铜盐的生物细胞毒性。多肽链段的长度可以通过PEO-NH2和 PLG-NCA的质量比例来控制,当m(PEO-NH2)∶m(PLG-NCA)分别为 1∶200 和1∶250时,根据图2中质子峰a和e的面积比,得到多肽组分的聚合度分别为170和224,因此经MPA 改性后的产物 PEO-b-PPLG-g-MPA 简写为 P170和 P224。PEO-b-PPLG 及 PEO-b-PPLG-g-MPA 的相对分子质量及其分布、Thiol-Yne效率等参数列于表1。Thiol-Yne反应非常高效,辐照10 min内,炔基的转化率 (或巯基的接枝效率)即可超过92%[8]。PEO-b-PPLG 可以在 CHCl3、THF、DMF、DMSO 等溶剂中溶解。PEO-b-PPLG-g-MPA 在大部分常见溶剂中都不能够溶解,不过在碱性水溶液中可溶,在DMSO中可以有限溶解。溶解度低的原因是多肽的螺旋构象导致其分子链非常僵硬,而且侧链引入了的大量羧基,侧链之间强烈的相互作用降低了其溶解性,这也从侧面证明了Thiol-Yne反应的高效性。

表1 多肽基杂化共聚物的表征参数Table 1 Parameters for characterization of polypeptide-based hybrid copolymers
PEO-b-PPLG-g-MPA 中多肽链段的二级结构可由CD测定,其结果如图4所示。不同pH条件下P170中的多肽链段采取的构象不一样。当pH低于4.9时,酸性条件下出现的以222和208 nm为中心的两个负Contton效应峰是多肽α-螺旋构象的特征峰,它们分别由n1-π*和π0-π*平行极化的激子跃迁所导致[9]。而当pH高于6.9时,以218 nm为中心的正的Contton效应峰是多肽呈无规线团的特征峰,说明此时多肽呈现无规线团二级构象。因此,CD光谱分析表明,pH低于4.9时,多肽采取α-螺旋构象,当水溶液pH继续升高时,侧链带负电荷,侧链间的静电排斥导致螺旋构象解体,pH诱导多肽发生了构象转变,慢慢转变成无规线团状,转变区间是 4.9~6.9。由此可见,当用PEO-b-PPLG-g-MPA 做为蛋白质模板指导 CaCO3的生物矿化时,因CaCO3只能在碱性条件下存在,故多肽只能采取无规线团的二级结构。

图4 不同pH条件下P170在水溶液中的CD曲线Fig.4 CD spectra of P170in aqueous solution with concentration of 0.1 mg/mL
2.2 CaCO3在水溶液中的形貌分析及其调控
2.2.1 肉眼观察CaCO3的生物矿化过程 可以直接从表观上观察多肽对CaCO3矿化过程的影响。图5给出了采用双注射法时该混合体系的外观。图5(a,b,c)显示,当1 min时,含有P170的水相体系呈现出稍许淡蓝色,并无肉眼可见的颗粒出现(图中白色物为搅拌子);3 min时该体系淡蓝色比较明显,不过仍无肉眼可见的固体颗粒出现,淡蓝色暗示了颗粒的尺度在1000 nm以内;5 min后CaCl2溶液和 Na2CO3溶液同时滴加完毕,此时保持体系不再被搅动,60 min时有肉眼可见固体颗粒出现,底部有固体颗粒沉积,不过体系上层仍保持浑浊状。而图5(d,e,f)显示,如若无P170,1 min时体系即出现肉眼可见颗粒,也没有淡蓝色;3 min时体系中已有大量固体颗粒;5 min后同样保持体系不再被搅动,60 min时发现底部有大量固体颗粒沉积,体系上层澄清。这些直观的实验现象说明,多肽基杂化双亲水共聚物中的多肽组分的确对CaCO3晶核的形成和晶体生长有所影响,它延迟了晶核的形成和晶体的生长,至少在尺度上起到了指导作用。
2.2.2 CaCO3生物矿化过程中多肽浓度的影响

图5 采用双注射法肉眼观察P170在水溶液中对CaCO3结晶形成的控制Fig.5 Visual inspection of biomineralization of CaCO3in aqueous solution in the presence or absence of P170,double-jet method
多肽作为CaCO3的矿化指导剂,其浓度可能会对CaCO3晶体的形貌有所影响,利用SEM可观测各种多肽浓度条件下CaCO3的形貌。图6(a,b,c,d)显示了在pH为10时,改变多肽浓度,36 h后CaCO3晶体的形貌。在浓度为0~0.05 mg/mL区间,多肽失去了对CaCO3形貌的控制,因为从图6(c)和6(d)中看出,0.008 mg/mL时,CaCO3晶体是典型的六面体,与不加多肽时 (0 mg/mL)的形貌一样,六面体的尺度也都在1~8 μm之间。当浓度增加到0.05 mg/mL时,可以观察到除了有六面体晶体,还有少量尺寸为1~2 μm的CaCO3微球出现,此时六面体的尺度也在1~2 μm之间(图6(b)),比多肽浓度为0.008 mg/mL时的尺寸小了很多,这表明在该浓度下多肽已经对CaCO3的形貌、晶核的形成及生长有了一定程度的控制作用。而当浓度增加到1 mg/mL时,可以明显观察到一定数量的尺度在1.5~3.5 μm之间的 CaCO3微球,此时还有很多尺寸为几百纳米CaCO3颗粒,它们的边缘钝化成弧形。这说明多肽对CaCO3的形貌已经有较好的控制,也可以指导晶核的形成及其生长速度。有意思的是,浓度为1 mg/mL的条件下,结晶18 h时取样观察可看到有橄榄形的CaCO3出现,它们的长轴尺寸平均为 1.5 ~3.0 μm之间,平均约1.7 μm,与图6(a)中的微球尺寸一致,这说明在0~36 h之内CaCO3并不是直接转变成微球,而是从橄榄形过渡到球形。假若矿化过程时间足够长,图6(a)和6(f)中边缘钝化成弧形的CaCO3晶体小颗粒几乎全部生长成微球状,这将在下面论述。图6(d)和6(e)分别是不含多肽的情况下结晶36 h和30 min后CaCO3的形貌,它们彼此之间并无差别,说明若无多肽,CaCO3的形貌始终为典型的六面体形,其尺寸也相近,故可知矿化过程无法得到调控。PEO-b-PPLG-g-MPA 由两部分组成,PPLG-g-MPA可与矿物相互作用,PEO不与矿物相互作用,这种结构对CaCO3晶体的生长起模板作用。多肽侧链的羧基阴离子对Ca2+有高度的亲合性,为Ca2+提供结合点,使Ca2+浓度局部过饱和,加快成核过程出现。晶核形成后,PPLG-g-MPA链段与纳米晶体的表面相互作用,选择性地吸附在晶粒表面,而不同的PEO链段彼此缠绕,这样的结构稳定纳米晶粒并控制其生长[10]。多个纳米晶体也可以形成无序或有序的聚集体,最终呈现出特定的形貌。不过聚合物模板形成并发挥调控作用的机理十分复杂,目前并无确定的结论。

图6 采用双注射法用SEM观察可变条件下CaCO3的形貌Fig.6 SEM morphologies of CaCO3in variable conditions in pH=10 aqueous solution,double-jet method
2.2.3 CaCO3形貌的调控 大自然中由生物蛋白所控制的CaCO3形貌具有多样性,因此本研究进一步探讨我们所得到的多肽基双亲水杂化共聚物PEO-b-PPLG-g-MPA 对 CaCO3形貌的调控作用。图7是可变条件下CaCO3的SEM照片。CaCO3形貌的调节可以通过改变双亲水杂化共聚物中多肽嵌段的长度来实现。在 pH为10、聚合物浓度为1.0 mg/mL的条件下,当多肽嵌段的长度为224个重复单元时,CaCO3呈棒状,其长短不一,但横截面尺寸平均为520 nm,如图7(a)所示;同等条件下,降低多肽的长度至170个重复单元,CaCO3为表面光滑的微球,尺寸在1.0~3.7 μm 之间,平均约2.4 μm,结果如图7(b)所示。改变体系的pH值,也可以调节CaCO3的形貌。如图7(c)所示,保持多肽长度为170个重复单元,浓度同样为1.0 mg/mL,当pH上升到12,CaCO3为超结构微球,其表面不再光滑,堆满了片状的CaCO3小颗粒。

图7 在7 d后采用双注射法观察可变条件下后CaCO3的形貌Fig.7 Morphologies in CaCO3under variable conditions after 7 days,double-jet method
甚至改变CaCO3矿化过程的操作方法,也可以得到形貌多样的CaCO3晶体。以上都是采用双注射法,图8展示了采用单注射法得到的CaCO3的形貌。如图8(a)所示,当pH为10时,在P170浓度为1.0 mg/mL的条件下,24 h后单注射法得到的CaCO3呈“花瓣状”,该“花瓣状”聚集体由多根CaCO3纳米棒聚集而成,而同等条件下双注射法得到的CaCO3为表面光滑的微球 (图8(b))。在pH为12、P224浓度为1.0 mg/mL的条件下,单注射法得到的CaCO3也是表面堆满了小颗粒的超结构微球,这与图7(c)中CaCO3的形貌一样。由此可见,在pH较高的条件下,多肽链段的长度、结晶时间甚至注射方法式都不是影响CaCO3的主要因素,pH高,则多肽侧链的羧基阴离子就较多,这个条件下可能对CaCO3形貌的控制作用就比较稳定,而其他影响因素则得到抑制。

图8 在24 h后采用单注射法观察可变条件下CaCO3的形貌Fig.8 Morphologies of CaCO3in variable conditions using single-jet method after 24 h
2.2.3 CaCO3的晶型 用XRD研究了所得到的CaCO3的晶型。CaCO3主要有三种晶型:方解石(calcite)、文石 (aragonite)和球霰石 (vaterite),其中前两者是最常见的稳定晶型,第三种是热动力学不稳定晶型,在自然界中比较少见[1,11]。XRD(图9)结果显示,在实验条件下所有的CaCO3都为方解石晶型,其最稳定的晶型。林嘉平等[12]用聚 (N-异丙基丙烯酰胺)-b-聚谷氨酸嵌段共聚物来调控CaCO3的生物矿化,可以得到不稳定的球霰石,其中聚合物胶束对CaCO3的晶型有重要影响。这里,我们制备的多肽基共聚物是双亲水的,碱性条件下并不形成胶束,因此CaCO3结晶过程主要受羧酸阴离子的控制,多肽的构象也可能调控晶核的生长[12]。
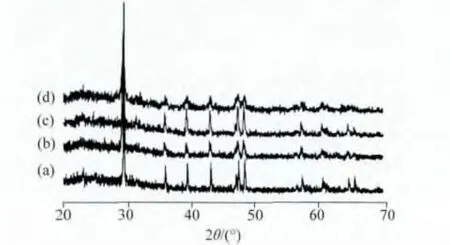
图9 在7 d后CaCO3的XRD曲线Fig.9 XRD patterns of CaCO3after 7 days
3 结论
结合N-羧基-环内酸酐开环聚合和“巯-炔”点击反应制备了侧链富含羧基的多肽基双亲水杂化共聚物 (PEO-b-PPLG-g-MPA)。该多肽基共聚物可以模拟蛋白质指导CaCO3在水溶液中的形貌和尺寸。多肽可以有效地调控CaCO3的生物矿化,不过此时其为无规线团构象,而不是其更为有序的α-螺旋或β-折叠构象。CaCO3形貌是可控的,可以通过调整体系pH值、多肽长度等手段实现,其形貌可以是表面光滑微球、超结构微球、纳米棒或呈“花瓣状”聚集的纳米棒。
[1]FALINI G,ALBECK S,WEINER S,et al.Control of aragonite or calcite polymorphism by mollusk shell macromolecules[J].Science,1996,271:67 -69.
[2]BELCHER A M,WU X H,CHRISTENSEN R J,et al.Control of crystal phase switching and orientation by soluble mollusc-shell proteins[J].Nature,1996,381:56 -58.
[3]付丽红,程惊秋,来国莉.明胶基质作用下碳酸钙的仿生合成[J].化学学报,2005,63:1626-1632.
[4]李翠珍,张琰,胡小毅,等.聚己内酯-b-聚丙烯酸胶束溶液对碳酸钙结晶的研究[J].化学学报,2011,69:471-476.
[5]KAŠPAROVÁP,ANTONIETTI M,CÖLFEN H.Double hydrophilic block copolymers with switchable secondary structure as additives for crystallization control[J].Colloid Surfaces A:Physicochem Eng Aspects,2004,250:153-162.
[6]GUO X H,YU S H,CAI G B.Crystallization in a mixture of solvents by using a crystal modifier:morphology control in the synthesis of highly monodisperse CaCO3microspheres[J].Angew Chem Int Ed,2006,45:3977 -3981.
[7]GUO X H,XU A W,YU S H.Crystallization of calcium carbonate mineral with hierarchical structures in DMF solution under control of poly(ethyleneglycol)-b-poly(L-glutamic acid):effects of crystallization temperature and polymer concentration[J].Cryst Growth Des,2008,8:1233-1242.
[8]HUANG Y G,ZENG Y H,YANG J W,et al.Facile functionalization of polypeptide by thiol-yne photochemistry for biomimetic materials synthesis[J].Chem Commun,2011,47:7509-7511.
[9]HOLTZWARTH G,DOTY P.The ultraviolet circular dichroism of polypeptides[J].J Am Chem Soc,1965,87:218-228.
[10]YU S H,COLFEN H.Bio-inspired crystal morphogenesis by hydrophilic polymers[J].J Mater Chem,2004,14:2124-2147.
[11]De OLIVEIRA D B,LAURSEN R A.Control of calcite crystal morphology by a peptide designed to bind to a specific surface[J].J Am Chem Soc,1997,119:10627-10631.
[12]朱文杰,蔡春华,林嘉平.碳酸钙在聚合物胶束控制下的仿生合成[J].高分子学报,2011(4):335-339.

