4-苄氧基苯酚与鲱鱼精DNA相互作用的研究*
胡亚敏,鲁俊良,王兴明,杨 欢
(西南科技大学材料科学与工程学院化学系,四川绵阳 621010)
天然酚类化合物是动植物体内最为丰富的次生代谢产物之一[1],这些酚类化合物均具有很好的生物活性。酚类化合物由于其螯合特性,被证实了具有抗炎症、抗变态反应、抗病毒以及抗癌症等特性[2-5]。许多酚类或者酚类衍生物都具有很强的抗氧化能力而对人体健康起着非常重要的作用,如葡萄酒、茶、咖啡等等中的酚类化合物。酚类化合物结构中由于含有一个或者多个酚性羟基而很强的抗氧化能力以及自由基清除的能力,所以酚类化合物都具有独特的药理活性以及生理功能,对于疾病的预防与治疗都起着非常积极的作用,正是因为如此,酚类化合物引起了许多研究者的兴趣[6-9]。目前,由于DNA以及多酚类化合物及酚类衍生物结构的复杂多变性,人们对于酚类化合物抗肿瘤细胞的作用机制还未完全地建立起比较完整的理论,仍需进一步深入研究。4-苄氧基苯酚又叫莫诺苯宗、氢醌苄基醚、对苄氧基苯酚,在工业及精细化工中有着重要用途,在橡胶工业中用作抗氧剂,也是合成选择性雌激素受体调节剂 (SERM)阿左昔芬的重要中间体。酚羟基具有较强的自由基清除功能,而如今的研究表明抗肿瘤机制中也包含了自由基清除作用[10],本文选择4-苄氧基苯酚 (PBP)来研究其与鲱鱼精DNA的相互作用,以便为筛选新的抗肿瘤药物提供一定的依据和参考。4-苄氧基苯酚结构如图1。

图1 4-苄氧基苯酚结构图Fig.1 Structure of 4-Benzyloxyphenol
1 实验
1.1 试剂与仪器
F-4500型荧光光谱仪,日本日立公司;乌式贝德黏度计,上海市青浦县前明玻璃仪器厂;pHS-2C型酸度计,成都方舟科技开发公司;HH-601超级恒温水浴,金坛金南仪器厂。
鲱鱼精DNA(hsDNA,AR,Sigma公司);溴化乙锭 (EB,AR,Sino-American biotec公司产品);三羟甲基氨基甲烷 (Tris,AR,天津科密欧化学试剂开发中心);寡聚核苷酸 (碱基序列为5'-AATCTCTCGG-3',大连宝生物工程有限公司);其它试剂均为分析纯,水为二次蒸馏水。
1.2 实验方法
1.2.1 荧光光谱法 所有样品均先用配制好的Tris-HCl缓冲液 (pH=7.4)溶解配制成高浓度溶液摇匀并静置,当要使用时再稀释成所需浓度。在荧光滴定中精确量取3.00 mL待测定溶液加入到光程为1 cm的石英比色皿中,使用注射针每次加入10 μL溶液,因加入体积很小,故可以忽略体积效应对荧光光谱的影响,测定记录每次滴定后溶液的荧光光谱,在实验中,发射光谱的扫描狭缝均为5 nm,扫描间隔均为1 nm,所有实验的激发波长均为λex=441 nm。
Scatchard法:配制一系列不同比例的小分子与DNA混合液,其中DNA的浓度是固定的,每次比例为 Rt(Rt= [小分子]/[DNA],Rt=0,0.4,0.8,1.2),使用荧光探针EB分别滴定上述溶液并记录荧光光谱变化。
1.2.2 黏度法 使用乌氏贝德黏度计进行黏度法测量研究,室温下,将配制好的DNA溶液加入到干燥好了的黏度计中,将黏度计垂直的固定好并浸泡在水溶液以保持温度的恒定,记录DNA流下的时间,保持DNA浓度不变,每次用小分子滴定后,待溶液混合均匀后记录好溶液流下的时间,每次平行测量3次,取其平均值,发现溶液流下时间均大于180 s。以η/η0为纵坐标,小分子浓度为横坐标作黏度变化图,η为混合溶液相对黏度值,η0为DNA的相对黏度值。
2 结果讨论
2.1 4-苄氧基苯酚与DNA的相互作用
在pH=7.4的模拟生理环境下,保持PBP浓度不变,向PBP溶液中滴加DNA溶液,记录PBP的荧光光谱变化,如图2所示。由图知,当激发波长为441 nm时,PBP的特征发射荧光峰为584 nm,随着溶液中鲱鱼精DNA浓度的不断增加,584 nm处峰值强度明显减弱,同时在553 nm处出现了荧光等色点,等色点的出现说明形成了一种新的复合物。这些现象说明PBP与DNA发生了作用,并形成了新的复合物。一般,当小分子与鲱鱼精DNA相互作用时荧光出现明显猝灭或者红移现象,则小分子与鲱鱼精DNA很有可能存在嵌插作用[11]。为了得知PBP与鲱鱼精DNA结合比例,在584 nm处测定的荧光值变化作摩尔比图,如图3,由图得出PBP与鲱鱼精DNA的结合比为nDNA∶nPBP=1∶2。

图2 DNA对PBP荧光光谱的影响Fig.2 Fluorescence spectra of PBP with different concentrations of DNA

图3 PBP对DNA的摩尔比图Fig.3 Mole ratio plots of DNA-PBP
2.2 PBP与DNA之间相互作用的热力学研究
利用热力学研究可以了解PBP与鲱鱼精DNA之间能否自发相互作用以及它们之间的作用强度。通过热力学研究先计算出在不同温度下的结合常数K,再计算得出各种热力学函数值。用鲱鱼精DNA滴定PBP溶液,记录584 nm处的荧光强度变化,以1/(A0-A)为y轴,1/[DNA]为x轴作图的双倒数曲线图,如图4。由图中可以看出,两条曲线均有良好的线性关系,根据公式:



图4 双倒数曲线图Fig.4 Double reciprocal plots
2.3 EB探针法研究PBP与DNA之间的相互作用
EB是一种常见的阳离子天然荧光染料,它是一个共轭平面分子,EB能强烈而专一的嵌入到DNA双螺旋结构的碱基对中并且发生的经典嵌插作用,使得荧光强度增加,所以,EB是一种常用的探测DNA构象的荧光探针,广泛应用于筛选抗肿瘤药物以及小分子与DNA间相互作用的研究[12-14]。若是DNA分子的构象发生变化时,EB将从DNA分子中游离出来,进而引起荧光猝灭。当小分子与EB-DNA作用时,可以观察EB-DNA的荧光变化可以判别小分子是否与DNA发生了作用以及它们之间是以何种模式发生的作用[15],在溶液环境不变的条件下,若是荧光值降低了,说明EB被PBP挤出来了,则说明PBP此时嵌入到了DNA碱基对中。实验时,向在EB-DNA体系滴定一定浓度的PBP溶液,记录观察EB-DNA荧光光谱变化,荧光光谱变化如图5所示。随着PBP的不断加入,EB-DNA在603 nm处的荧光强度逐渐小幅度下降,这表明有部分PBP嵌入到DNA碱基对,同时将EB-DNA体系中的部分EB挤出,说明PBP与DNA作用与EB同DNA作用存在竞争关系,所以我们可以推断出PBP与DNA之间存在嵌插作用。

图5 PBP对EB-DNA体系的荧光光谱影响Fig.5 Effects of PBP on fluorescence spectra of DNA-EB
2.4 磷酸盐与PBP之间相互作用的研究
磷酸盐与PBP的相互作用研究是为了探究PBP与DNA之间是否存在静电作用。本文使用Na3PO4溶液来研究磷酸盐与PBP之间的作用模式,Na3PO4电离出的离子能很好的模拟DNA分子的磷酸骨架,若是PBP与离子发生作用而致使荧光光谱发生变化,则PBP肯定将会与DNA分子磷酸骨架发生作用,而PBP与磷酸骨架只能通过静电作用模式结合。在PBP溶液中逐渐滴定一定浓度的Na3PO4溶液,记录观察PBP荧光光谱变化如图6。随着Na3PO4溶液浓度的不断增加,荧光光谱显示在584 nm PBP的特征荧光峰不断降低,这说明PBP与离子发生了作用而致使荧光光谱降低,当PBP以静电作用模式与离子发生作用时,PBP中的质子发生转移而被束缚,进而使得荧光发射波长强度降低。所以PBP也将与磷酸骨架结合,这也就是说,PBP与DNA之间存在静电作用。

图6 磷酸盐对PBP荧光光谱的影响Fig.6 Fluorescence spectra of PBP with different concentration of phosphate
2.5 寡聚核苷酸与PBP之间相互作用的研究
为了对PBP与DNA之间作用机制更进一步的了解,本文研究寡聚核苷酸与PBP之间的相互作用,寡聚核苷酸是只有20个以下碱基的短链的核苷酸,因其很容易与它们的互补链对结,所以经常用作探针研究DNA结构。因为寡聚核苷酸只有较短的碱基链而无磷酸骨架以及碱基对,固PBP只能以沟渠作用方式与寡聚核苷酸作用。固定PBP溶液浓度不变,逐渐加入寡聚核苷酸溶液,记录观察荧光光谱变化如图7所示。可以看出,图中荧光值几乎没有发生变化,考虑到误差,认为在PBP溶液中加入寡聚核苷酸不会引起PBP的荧光光谱发生变化,这也就是说,PBP不会寡聚核苷酸发生作用,所以PBP也不会以沟渠作用模式与DNA发生作用。
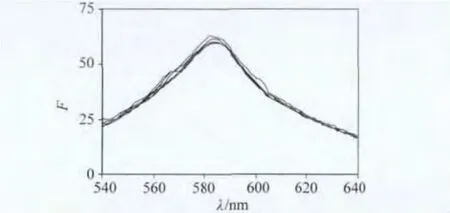
图7 寡聚核苷酸对PBP荧光光谱的影响Fig.7 Fluorescence spectra of PBP with different concentration of oligodeoxynucleotides
2.6 Scatchard法研究 PBP与 DNA之间的相互作用
通过小分子PBP存在下EB和DNA作用的Scatchard法分析,可以进一步判断证实小分子与DNA之间的相互作用方式。在EB-DNA体系中滴加PBP溶液,记录荧光强度变化并作出Scatchard图,如图8。
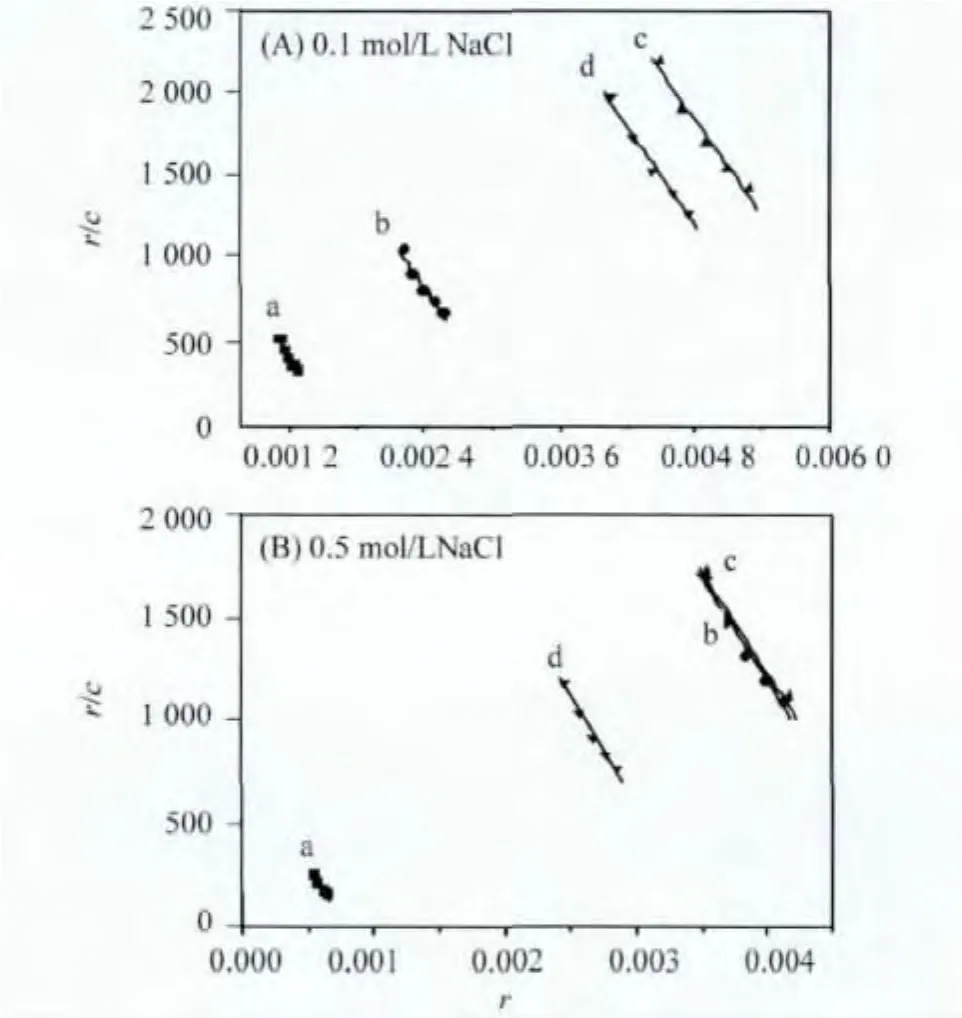
图8 0.1mol/L与0.5mol/L时DNA-EB体系的Scatchard图Fig.8 Scatchard plots of EB-DNA system
在依据 Scatchard方程[16]能够计算出 PBP与DNA的作用位点n以及内在结合常数K,计算结果均列于表1中。从不同PBP浓度下的n值和K值得变化情况就可以大体分析得出PBP与DNA之间的作用方式,若n值不变那么小分子与DNA之间是经典嵌插模式,若K值不变那么小分子与DNA之间是非嵌插作用模式,若n值和K值都在变化,则小分子与DNA之间是以混合模式作用即既存在嵌插方式又存在着非嵌插作用方式。从表中得知n值和K值都在发生变化,这说明PBP与DNA之间为混合作用模式。

表1 PBP与DNA相互作用的Scatchard方程Table 1 Scatchard Equation of interaction between PBP and DNA
为了更进一步了解是哪种非嵌插作用模式存在于PBP与DNA作用中,不同浓度的强电解质NaCl被用于Scatchard分析中而平行进行两次实验。NaCl中的Na正离子将会在DNA分子周围形成离子氛而包围DNA分子,若PBP与DNA之间存在着静电作用,那么NaCl在DNA周围形成的离子氛将会削弱PBP与DNA之间的静电作用力大小,那么溶液中有高浓度NaCl的n值就将比低浓度NaCl的n值低,如若不然则PBP与DNA之间就没有静电作用而很可能为沟槽作用。由表中可以看出,当NaCl浓度变大时n值均降低,这说明PBP与DNA之间存在静电作用。
2.7 黏度法研究PBP与DNA之间的相互作用
一般而言,单独的一种技术所给出的信息量是非常有限的,因此多种技术手段的联用是很有必要的,这样才能为研究小分子与DNA作用模式以及机理提供更加可靠的依据。而黏度测量这种流体力学的方法也是检测小分子与DNA作用方式的一种非常简便有效的方法[17-19]。当小分子PBP完全嵌入DNA碱基中发生嵌插作用时,DNA的链长将增加黏度值也将随之增加;当小分子PBP只以静电或者沟槽方式与DNA结合时,DNA分子结构不会发生形变则黏度值将几乎不发生变化;当小分子PBP是以部分嵌入模式与DNA作用时,DNA分子结构就将发生扭结弯曲变形,此时DNA的黏度将会降低。配制一系列不同比例的DNA-PBP溶液,分别测定并记录其相对黏度值,结果如图9所示。由图知,随着DNA-PBP中PBP比例的逐渐增大,此时黏度值却逐渐减小,这说明PBP只是部分的嵌入到DNA分子中,致使了DNA分子扭结变形而分子长度变短所致。这也就说明PBP与DNA之间的嵌插作用是部分嵌插。

图9 PBP对DNA的黏度影响Fig.9 Influence on DNA viscosity with different concentrations of PBP
3 结论
在生理环境下,本文通过光谱以及黏度法研究了PBP与鲱鱼精DNA之间的相互作用,研究发现PBP可以与鲱鱼精DNA发生作用并以摩尔比为2∶1的比例形成了PBP-鲱鱼精DNA复合物。在通过各种手段检测发现PBP与鲱鱼精DNA之间主要通过部分嵌插以及静电作用方式发生作用。
在实验中还通过热力学研究法计算得出了在不同温度下PBP与鲱鱼精DNA的结合常数=2.16×105L/mol,=9.67×104L/mol,说明在低温时PBP与鲱鱼精DNA的结合力度更大,这也得到了热力学函数中焓变值得证实,降低温度将会有利于反应进行,通过结合常数也计算出了各种热力学函数= -6.18 ×104J/mol,= -1.05×103J/(mol·K),= -3.04×104J/mol。热力学函数值说明了PBP与鲱鱼精DNA是可以自发的进行反应形成PBP-鲱鱼精DNA复合物的,而在这一过程中焓是主要的驱动力。
[1]HASLAM E.Plant polyphenols:vegetable tannis revisited[M].Cambridge University Press,1989:178.
[2]方元超,杨柳,白小佳.茶叶活性成分的功能性质[J].中国食品添加剂,1999(1):9-12.
[3]陈尚武,马会勤,陈雷,等.葡萄酒中的白藜芦醇及其衍生物[J].食品与发酵工业,1999,25(4):53-55.
[4]潘志芬,潘开文.大豆及大豆制品中异黄酮的研究现状[J].四川农业大学学报,1999,17(2):56-57.
[5]PRATT D E.Water soluble antioxidanu activity in soybeans[J].Food Science,1972,37(2):322 -323.
[6]LU Y R,FU L Y.Antioxidant activities of polyphenols from sage(Salvia o.cinalis)[J].Food Chemistry,2001,75:197-202.
[7]IVANOVA D,GEROVA D,CHERVENKOV T,et al.Polyphenols and antioxidant capacity of Bulgarian medicinal plants[J].Journal of Ethnopharmacology,2005,96:145-150.
[8]SKERGET M,KOTNIK P,HADOLIN M,et al.Phenols,proanthocyanidins,flavones and flavonols in some plant materials and their antioxidant activities[J].Food Chemistry,2005,89:191-198.
[9]SOONG Y Y,PHILIP J B.Antioxidant activity and phenolic content of selected fruit seeds[J].Food Chemistry,2004,88:411-417.
[10]HEO S J,PARK E J,LEE K W,et al.Antioxidant activities of enzymatic extracts from brown seaweeds[J].Bioresour Technol,2005,96(14):1613 -1623.
[11]席小莉,杨曼曼,杨频.6-苄氨基嘌呤及其金属配合物与DNA的作用机理[J].无机化学学报,2005,21(12):1847-1852.
[12]YANG H,WANG X M.Spectroscopic studies on the interaction of β-cyclodextrin-8-hydroxyquiuolineinclusioncomplex with herring sperm DNA[J].Journal of Molecular Structure,2013,1036:51 -55.
[13]ZHOU Y L,LI Y Z.Studies of interaction between poly(allylamine hydrochloride)and double helix DNA by spectralmethods[J].Biophys Chem,2004,107(3):273-281.
[14]徐春,何品刚,方禹之.溴化乙锭标记DNA电化学探针的研究[J].高等学校化学学报,2000,21(8):1187-1190.
[15]WU K C,LIPPARD S J.Binding of platinum and palladium metallointercalation reagents and antitumor drugs to closed and open DNAs[J].Biochemistry,1978,15(19):4339-4346.
[16]GUO M L,YANG P,YANG B S.Ethidium bromide as a fluorescent probe for the interaction mode between titanocene dichloride and DNA[J].Chin Sci Bulletin,1996,41:1098–1103.
[17]CHEN Q Y,LI D H,ZHAO Y,et al.Interaction of a novel redregion fluorescent probe,nile blue,with DNA and its application to nucleic acids assay[J].Analyst,1999,124(6):901-906.
[18]龙俊,段雷雨,王兴明,等.β-环糊精-4-苄氧基苯酚包合物与DNA的相互作用[J].中山大学学报:自然科学版,2013,52(6):86-92.
[19]LONG J,WANG X M,XU D L,et al.Spectroscopic studies on the interaction mechanisms of safranin T with herring sperm DNA using acridine orange as a fluorescence probe[J].Journal of Molecular Recognition,2014,27:131-137.
——勇敢者的游戏

