饲料中添加生长激素基因重组蛋白对斜带石斑鱼生长、消化及抗氧化能力的影响*
潘忠超,石和荣,杨慧荣,王树启,赵会宏
(1.华南农业大学动物科学学院水产系,广东广州 510642;2.广东海大畜牧兽医研究院有限公司,广东广州 510630;3.汕头大学广东省海洋生物技术重点实验室,广东汕头 515063)
斜带石斑鱼 (Epinephelus coioides)属鲈形目(perciformes),鮨科 (Serranidae),石斑鱼亚科(Epinephelinae),石斑鱼属,是我国华南沿海及东南亚地区重要的海水养殖鱼类。由于其味道鲜美,营养丰富,受到广大消费者的青睐,具有较高的经济价值。
鱼类生长激素 (GH)是垂体细胞分泌的一种多功能的激素,由173~188个氨基酸组成,相对分子质量为20000~22000。研究表明GH参与众多的生理调控过程,包括代谢、生长、发育、繁殖和渗透压调节等,而且可以增加鱼食欲,提高饲料转化率[1]。目前,超过40多种鱼类的GH基因已经克隆得到[2]。从得到的氨基酸组成分析,同一目的鱼类GH同源性比较高,其氨基酸组成大约有80%是相同的[3]。但是不同目的鱼类GH差异较大,同源性大约只有37% ~58%,表现出明显的种属特异性[4]。将基因重组生长激素通过注射[5-7]、埋植[6-8]、浸泡[6-9]、食道插管或投喂等给药途径[6-9],都可以促进鱼类的生长。因此,在鱼类养殖业中采用GH来促进鱼类生长是可行的。但是,这些给药方法都需要消耗大量的人力、物力,还易引起鱼的应激反应或造成鱼体损伤,是推广应用GH的主要障碍。研究证实,鱼类消化系统具有完整吸收蛋白多肽的能力[10],GH通过投喂的方式处理鱼类,能有效促进鱼体的生长。目前已在金鱼 (Carassius auratus)[11-15]、虹鳟 (Oncorhynchus mykiss)[11-15]、 黑 鲈 (Micropterus salmoides)[11-15]、牙 鲆 (Paralichthys olivaceus)[11-15]、斑 马 鱼 (Daniorerio)[11-15]、 鲤 鱼 (Cyprinus carpio)[11-15]和尼罗罗非鱼 (Tilapia nilotica)[11-15]等鱼类中证明了生长激素具有促进摄食和生长的作用。
本试验研究在饲料中添加重组生长激素的酵母上清液 (其中重组生长激素质量分数为2,4,8 mg/kg),并与空白对照进行对比,通过现场喷涂饲料,养殖试验并测定相关生长指标、血脂、消化酶、抗氧化指标以及组织磷酸酶的活性,探讨重组生长激素对斜带石斑鱼生长的影响,为斜带石斑鱼养殖生产提供基础数据。
1 材料与方法
1.1 试验设计
试验时间:2012年7-10月。
试验动物及管理:斜带石斑鱼幼鱼购自广东省大亚湾水产试验中心。养殖试验在该中心进行。试验鱼暂养于500 L玻璃纤维缸中,用对照组饲料投喂2周,使其逐步适应养殖环境和膨化饲料。试验前挑选出体格健康、规格相近的试验鱼,平均体质量为 (15.15±0.51)g,平均体长 (8.33±0.21)cm进行随机分组,设对照组G0,3个处理组G1、G2、G3,每组3个重复,每缸40尾。
试验在室内流水系统进行,水流速度为3.2 L/min,海水盐度27.45‰~31.26‰。试验期间,气温为 (30.38±1.22)℃,水温为 (29.39±1.49)℃,溶解氧为 (5.96±1.38)mg/L,pH为7.43±0.22,氨氮为 (0.01±0.01)mg/L,亚硝态氮为 (0.02±0.01)mg/L,每天投喂3次,日投喂量为试验鱼体质量的2% ~3%,并根据天气和摄食情况灵活调整。摄食1 h后清理粪便及残饵,自然光照,24 h流动海水并充气,试验养殖周期为10周。
1.2 饲料制备
基础饲料配方和营养成分组成见表1。试验饲料由中山统一饲料有限公司制备。毕赤酵母工程菌由中山大学生命科学学院水生经济动物研究所提供,生长激素重组蛋白在广州大学微生物试验室发酵获得,采用喷涂技术将发酵所得上清混入饲料中。

表1 饲料基础配方及营养组成Table 1 The basical diet and nutrition composition
1.3 试验器材及试剂
剪刀,镊子,解剖刀,注射器,纱布,试验盘,凯氏定氮仪 (Tecato,1030型自动分析仪),索氏抽提系统 (Tecato,Soxtec system HT6),烘箱(MBE,GZC-9246),天平 (JA1003N),水浴锅(上海一恒,DK.8D),酶标仪 (Thermo,MULTISKAN MK3),分光光度计 (MC,UV759S)等。
1.4 样品处理
养殖试验结束后,将试验鱼饥饿24 h。称取每缸鱼的总质量并统计数量。每缸随机选取10尾鱼,取5尾鱼作全鱼体成分分析,剩余5尾鱼用于生化分析采样。首先采血,将血液低温离心 (4℃,3000 r/min,15min)分离血清,低温保存(-40℃)备用。肝脏、肌肉、肠道等组织,称量后加入9倍的生理盐水,研磨均匀,将研磨液低温离心 (4℃,3000 r/min,15 min),取其上清液低温保存 (-80℃)备用。记录每尾鱼体质量、体长以及解剖后的内脏、肝脏、肌肉和肠系膜脂肪的质量,并收集肌肉以测定其粗蛋白和粗脂肪。
1.5 指标测定
1.5.1 生长指标的测定 记录各组鱼的采食量,分别在试验开始和结束时获取鱼体质量、肌肉、肝胰脏和肠系膜脂肪质量数据。
初均质量 (W0)、末均质量 (Wt)、均摄食量(g)、增质量率 (WGR)、体长增长率 (LGR)、特定生长率 (SGR)、饲料系数 (FC)、成活率(%)、肥满度 (CF)、脏体比 (%)、肝体比(%)和脂体比 (%)的计算公式如下:
初均质量 (W0)=初总质量/鱼尾数;末均质量 (Wt)=末总质量/鱼尾数;
均摄食量 (g)=摄食总量/鱼尾数;肥满度(CF)=体质量 (g)/体长 (cm)3;
脏体比=内脏的质量/鱼的体质量;肝体比=肝的质量/鱼的体质量;
脂体比=肠系膜脂肪质量/鱼的体质量;

其中 Lt、Wt、Nt和 L0、W0、N0分别为试验结束时和放养鱼时的平均体长、平均体质量、数量;G为摄饵的总量;T为试验总天数。
1.5.2 样品分析 饲料、全鱼和肌肉的粗蛋白测定采用凯氏微量定氮法 (GB6432-86);粗脂肪采用索氏抽提法测定 (GB/T5009.6-2003);粗灰分采用烧灼法 (GB6438-86);水分的测定采用105℃恒温烘干失重法 (GB6435-86);血脂含量采用高效液相法检测。
采用考马斯亮蓝测定蛋白含量,淀粉酶(AMS)、脂肪酶 (LPS)、胰蛋白酶、超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT)、总抗氧化能力(T-AOC)、丙二醛 (MDA)、碱性磷酸酶 (AKP)和酸性磷酸酶 (ACP)的测定方法均由南京建成生物工程研究所的测试盒提供。
1.6 数据统计分析
所有数据用Excel电子表格记录,用SPSS17.0统计软件进行统计分析。数据以平均数±标准误(means±SE)的形式表示,采用单因素方差分析,显著水平为p<0.05。当差异显著时采用Duncan's多重比较分析组间的差异显著程度。
2 试验结果
2.1 基因重组生长激素对斜带石斑鱼生长性能的影响
饲养试验结束后,斜带石斑鱼的各项生长性能指标见表2。由表2可知,试验组斜带石斑鱼的末均质量、增质量率、摄食量、体长增长率以及特定生长率均高于对照组,其中G2组斜带石斑鱼末均质量最高,达到57.23 g,高出对照组9.97%(p<0.05),增质量率达到293.16%,高出对照组23.75%(p<0.05);G2组斜带石斑鱼的摄食量最多,且高于其它试验组,高出对照组9.99%(p<0.05);体长增长率趋势与摄食量一致,G2组最高,显著高于对照组 (p<0.05);G2组的特定生长率最高,但4组之间无显著差异;饲料系数方面,3个试验组较对照组均低,G2组最低,但4组之间无显著差异。

表2 饲料中添加重组GH对斜带石斑鱼生长、摄食、饲料系数和成活率的影响1)Table 2 Effects of r-gGH on the growth,feeding,feeding rate and survival rate of Epinephelus coioides
2.2 饲料中添加重组GH对斜带石斑鱼形态学和体成分的影响
试验结束时,斜带石斑鱼的形态学指标和鱼体成分分析,见表3和表4。形态学方面,饲料中添加重组GH对斜带石斑鱼的形态学指标均没有显著影响 (p>0.05);G3组斜带石斑鱼肥满度较对照组高出4.7%;G1及G3组斜带石斑鱼脏体比与G0组比较均下降;试验组斜带石斑鱼脂体比与对照组相比有一定程度的下降,其中G1组最低,比G0组下降17.24%。
鱼体成分分析表明,G2组全鱼粗蛋白含量最高,显著高于G0组 (p<0.05)。G2组鱼体肌肉中粗脂肪的含量低于其它试验组,并且显著低于G0组 (p<0.05)。

表3 饲料中添加重组GH对斜带石斑鱼形态学指标的影响Table 3 Effects of r-gGH on morphology of Epinephelus coioides
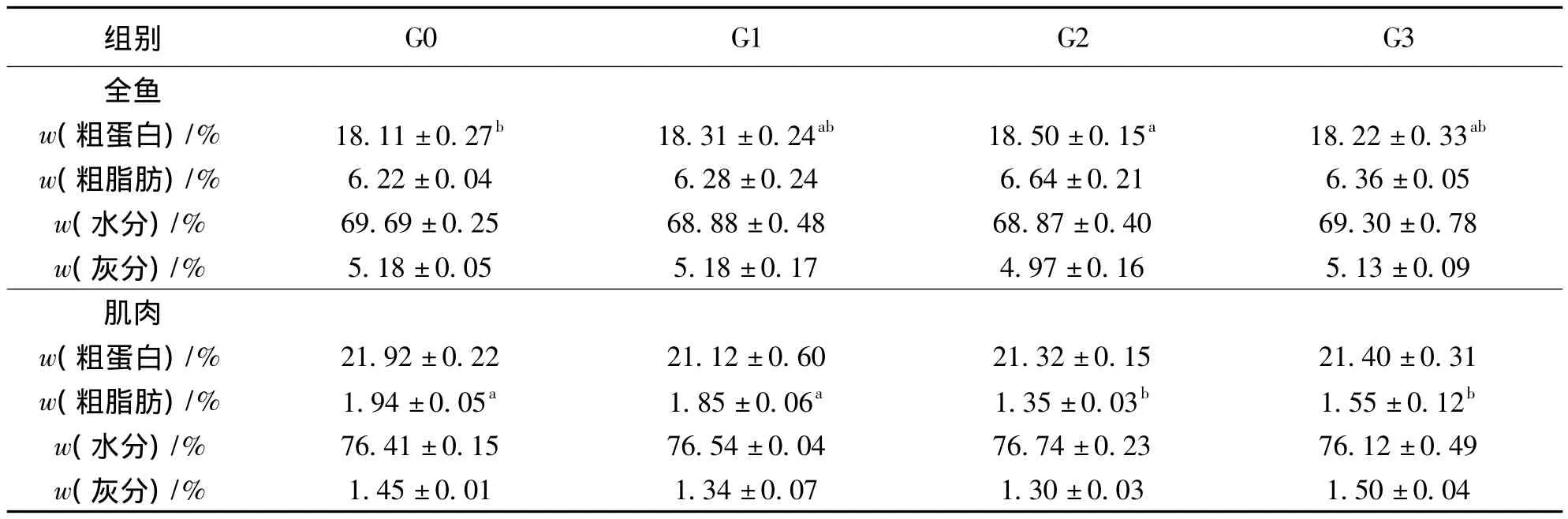
表4 饲料中添加重组GH对斜带石斑鱼体成分的影响1)Table 4 Effects of r-gGH on body composition of Epinephelus coioides
2.3 饲料中添加重组GH对斜带石斑鱼血脂的影响
如表5所示,G1、G2、G3组斜带石斑鱼的胆固醇 (CHOL)、低密度脂蛋白 (LDL)和甘油三酯 (TG)含量均低于对照组,且G1和G2组的低密度脂蛋白 (LDL)含量显著低于G0组 (p<0.05),试验组鱼的高密度脂蛋白含量均高于对照组,其中G2组最高,高出G0组80%。
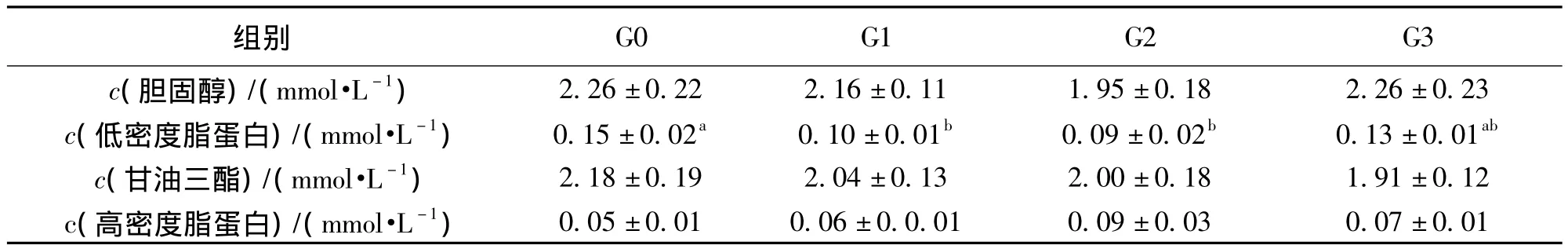
表5 饲料中添加重组GH对斜带石斑鱼血脂的影响1)Table 5 Effects of r-gGH on blood fat of Epinephelus coioides
2.4 饲料中添加重组GH对斜带石斑鱼消化酶活性的影响
试验结束时,取斜带石斑鱼的肠道检测消化酶的活性,试验结果见表6。在斜带石斑鱼的肠道中3种消化酶均有表达,其中胰蛋白酶活性最高;试验组鱼的淀粉酶活性均高于对照组,G2组最高,并且显著高于G0组 (p<0.05);试验组鱼脂肪酶活性均显著高于对照组 (p<0.05)。

表6 饲料中添加重组GH对斜带石斑鱼消化酶活性的影响1)Table 6 Effects of r-gGH on digestive enzymes of Epinephelus coioides
2.5 饲料中添加重组GH对斜带石斑鱼体组织抗氧化指标的影响
试验结束后,对肌肉进行丙二醛 (MDA)含量测定,抗氧化指标均用肝脏组织检测。如表7所示,试验组斜带石斑鱼的MDA水平均低于对照组,并随着浓度的增加而降低,G3组最低并且显著低于G0组 (p<0.05);过氧化氢酶 (CAT)活性与MDA的趋势相反,试验组斜带石斑鱼的CAT活性均高于对照组,并随着浓度的增加而升高,G3组最高且显著高于G0组 (p<0.05);试验组鱼的总抗氧化能力高于对照组,G2组鱼的的总抗氧化能力显著高于G0组 (p<0.05),饲料中添加重组GH对斜带石斑鱼的SOD活性影响不大。
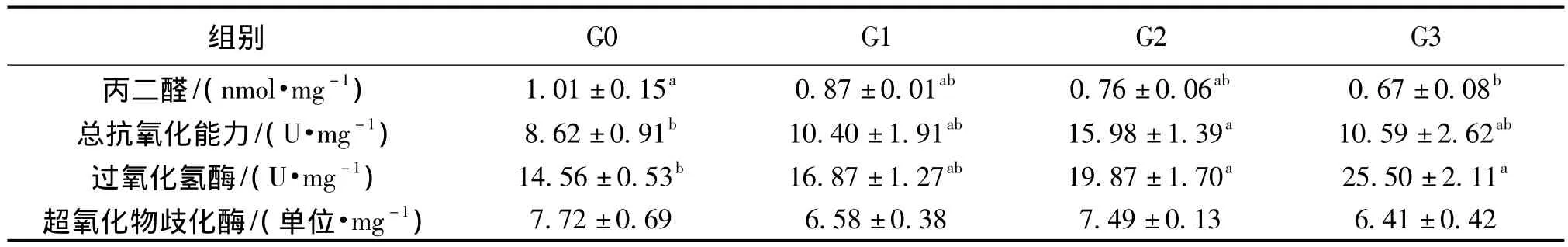
表7 饲料中添加重组GH对斜带石斑鱼体组织抗氧化指标的影响1)Table 7 Effects of r-gGH on antioxidant indexes of Epinephelus coioides tissue
2.6 饲料中添加重组GH对斜带石斑鱼组织磷酸酶活性的影响
试验结束后,检测肝脏和血液的磷酸酶活性。如表8所示,G2组鱼肝脏碱性磷酸酶 (AKP)和酸性磷酸酶 (ACP)的活性最高而且显著高于对照组 (p<0.05);血液中G2组鱼的磷酸酶活性也是最高的,但各组之间无显著性差异。

表8 饲料中添加重组GH对斜带石斑鱼组织磷酸酶活性的影响1)Table 8 Effects of r-gGH on phosphates activities of Epinephelus coioides tissue
3 讨论
鱼类重组GH的基本功能是促生长,研究报道较为全面。在转基因鱼类中研究发现,转生长激素基因的银大马哈鱼 (Oncorhynchus kisutch)生长速度显著提高,其血浆中GH的水平明显高于非转基因鱼[16]。然而,随着生物安全性越来越被重视,对转基因食品的质疑声也越来越多,其安全问题有待验证。研究表明[17],外源生长激素的半衰期一般在6 h以内,在12~24 h之后,基本检测不到。美国食品和药物管理局 (FDA)公布了30年来对牛生长激素的研究结果,从多方面证实了使用牛生长激素的安全性[18]。目前,北美和欧洲许多国家已批准牛生长激素在乳牛养殖业中的应用[19]。从理论上讲,鱼类生长激素是一种蛋白激素,对热不稳定,蒸煮时会分解为氨基酸而失去激素的生理功能活性,食用后对人畜无害。人的生长激素能促进鱼的生长,但对鱼生长激素受体的结合活性要比鱼类自身生长激素低150倍,而鱼类生长激素对哺乳动物的生长激素受体无任何结合活性[18-19]。因此,从不同的角度分析和实验证实,作为饵料添加剂的鱼类生长激素是安全的。
3.1 饲料中添加重组GH对斜带石斑鱼生长性能的影响
本试验结果表明,在饲料中添加4 mg/kg的重组生长激素蛋白能显著提高斜带石斑鱼的生长性能。前人通过不同的方法证明重组GH能够促进鱼类的生长,例如用重组GH通过腹腔注射,口服,浸泡等方式处理鱼类,都能显著提高鱼类的生长速度[6-7,19],与本试验研究结果相同。本研究以 4 mg/kg的剂量重组生长激素上清为饵料添加剂时,斜带石斑鱼的增质量率与体长增长率与对照组相比较有显著性差异。而较高 (8 mg/kg)或者较低质量分数 (2 mg/kg)也能促进鱼类的生长,但不如4 mg/kg组明显,这可能是因为重组GH的质量分数太低,不足以引起鱼类较大的生理反应,太高可能引起GH下游相关因子的负反馈调节所致。现有的研究表明,鱼类内分泌调控GH—IGF-Ⅰ轴是鱼类生长发育的重要调控轴,外源化学物质可能直接作用于该轴,影响下游IGF-Ⅰ等因子的表达,从而影响鱼类的生长发育[17]。
Acosta等[21]首先研究了重组 GH在金鱼中的促摄食作用,向饱食的金鱼腹腔注射重组GH(0.2 μg)2 h后食量显著增加。同时向金鱼腹腔注射重组GH及其受体拮抗物后发现重组GH的促摄食作用受到抑制。随后Zhang等[22]的研究也表明重组GH具有促进金鱼摄食的作用。本试验结果也表明,重组GH对斜带石斑鱼的摄食量有提高作用,且以4 mg/kg效果最佳。
本试验表明,添加4 mg/kg重组斜带石斑鱼GH的饲料,斜带石斑鱼幼鱼的饵料转化效率有所提高,饵料系数从对照组的1.21降低到1.14。由此推断,重组GH的促生长效应一部分是通过提高饵料转化效率来实现的。此结果在其它鱼上也得到证实。Liu等[23]发现,用牙鲆GH的转基因集胞藻(Synechocystis)投喂牙鲆,其生长速度显著提高,且饵料系数从2.0降低到1.2;Liu等[23]的研究结果也表明,用牙鲆GH的转基因小球藻投喂牙鲆,除了生长速度显著提高外,其饵料转化效率也从对照组的0.53升高到高剂量组的0.72。在水产养殖业中,饵料系数的降低意味着养殖成本的降低,对养殖业会带来较高的经济价值,使养殖户在市场中更有竞争力。此外,饵料转化效率的提高意味着合成代谢的增加和分解代谢的减少,对养殖环境的改善也有很大帮助,尤其是在高密度养殖环境下可以减少水产病害的发生。
3.2 饲料中添加重组GH对斜带石斑鱼形态学和体成分的影响
本试验结果发现,当饲料中添加生长激素质量分数为4 mg/kg时,全鱼粗蛋白含量显著提高,且肌肉脂肪含量显著降低。此结果和Li等[24]的结果不尽相同。王常安等[25]发现,用含有鲑鱼 (Oncorhynchus keta)GH的酵母投喂牙鲆,其肌肉中的总蛋白和总脂肪都有明显的上升。尽管影响鱼体组成的因素有很多种,但是我们推测,上述研究结果不一致的原因很有可能是研究中基础饵料的不一致以及鱼自身代谢具有种属特异性。
3.3 饲料中添加重组GH对斜带石斑鱼生化指标的影响
鱼类血液与机体的代谢、营养状况及疾病有着密切的关系,当鱼体受到外界因子的影响而发生生理或病理变化时,必定会在血液指标中反映出来。因此,血液成分的变化被广泛地用来评价鱼类的健康状况、营养状况以及对环境的适应状况,也是重要的生理、病理和毒理学指标[20]。鱼的血脂含量受营养状况、季节、运动状况和咸淡水等多种因素影响,一般在咸水中饲养的鱼类比在淡水中饲养的鱼类血脂含量低[28]。另外,摄食情况、生长和身体状况也是影响蛋白含量的重要因素。本试验结果发现试验组的胆固醇、低密度脂蛋白和甘油三酯均低于对照组,且2 mg/kg和4 mg/kg试验组的低密度脂蛋白显著低于对照组 (p<0.05),说明饲料中添加生长激素基因重组蛋白能显著降低斜带石斑鱼的血脂水平,这与王常安等[25]研究结果一致,说明外源生长激素可以调控斜带石斑鱼的生理代谢;试验组的高密度脂蛋白均高于对照组,且4 mg/kg试验组最高,高出对照组80%。这可能是由于添加的重组蛋白影响了下游相关酶的代谢,从而促进了脂肪的利用和高密度脂蛋白的合成。总之,在饲料中添加斜带石斑鱼生长激素基因重组蛋白降低了其血脂水平,更加有利于市场推广。
3.4 饲料中添加重组GH对斜带石斑鱼消化酶活性的影响
消化酶主要指由消化腺和消化系统分泌的具有营养消化作用的酶类,鱼类的消化酶主要分为:蛋白酶、淀粉酶、脂肪酶。鱼类对营养物质的消化能力取决于消化酶的活力,消化酶活性是反映鱼类消化机能的重要指标,其高低直接关系到鱼类对营养物质的吸收和利用,影响斜带石斑鱼消化酶活性的因素较多,如营养、盐度、温度、生长、年龄等[27,29],在本试验中,主要考虑生长激素基因重组蛋白对斜带石斑鱼消化酶活性的影响。试验结果表明,肝脏的胰蛋白酶活性在所有消化酶活性中是最高的,可见胰蛋白酶是斜带石斑鱼主要的消化酶,同时也是蛋白质最重要的消化酶。试验组脂肪酶和淀粉酶的活力均高于对照组,说明重组GH能够促进斜带石斑鱼对饲料淀粉和脂肪的消化,这与林建斌等[29]的报道一致,虽然鱼类消化酶的研究取得了很多成果,但在其研究过程中还有很多问题和不足,鱼类消化酶的进一步研究,将越来越受到人们的重视。
3.5 饲料中添加重组GH对斜带石斑鱼组织抗氧化指标的影响
鱼类自身存在特定的抗氧化防御机制以应对氧化压力,它能消除体内自由基,增强吞噬细胞防御能力和机体免疫功能,维持细胞内的动态平衡。鱼类在进行生理活动的过程中会产生氧自由基,如分解氧以提供能量的电子传递链过程、吞噬细胞的吞噬过程以及外源物质的分解过程等[30]。抗氧化系统主要由抗氧化酶和非酶类复合物构成。其中,超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT)等是构成抗氧化酶系统的主要成分,在清除活性氧自由基中起着决定作用[31]。MDA是一种脂质过氧化过程中衍生的代谢产物,同时MDA也是不饱和脂肪酸过氧化终产物之一,被作为一种细胞膜氧化损伤的指示物[33]它的高低也间接反映了机体细胞受损的程度。正常情况下,氧自由基的产生和清除过程处于动态平衡状态,但当受到饥饿、拥挤、温度和盐度等外界因素的刺激时,鱼体内的自由基水平会超过机体清除能力,就会产生氧化压力,严重时会对鱼体造成氧化损伤[32]鱼类具有清除自身自基及氧化中间产物的抗氧化防御机制,其中抗氧化系统对氧化胁迫的清除起着决定性作用。
本试验中MDA的活性随着重组GH的添加质量浓度增加而降低,说明外源的生长激素重组蛋白对斜带石斑鱼的细胞有一定的保护作用。这与Zaccaron[33]的研究相一致。SOD是一种特异性消除超氧自由基的循环酶,主要负责过氧化和噬菌作用造成的组织损伤的防御保护作用。SOD含量越高,说明有待清除的超氧自由基越多[36]。本试验SOD的变化并不显著,说明基因重组蛋白造成的机体细胞损伤能及时的清除。过氧化氢酶 (CAT)催化H2O2分解为H2O,保护机体稳定的内环境及细胞的正常生活。本实验中过氧化氢酶的活性随着添加浓度的增加而升高,说明添加基因重组生长激素蛋白对于斜带石斑鱼的抗氧化性有一定的提高。这可能是由于本次体外表达的载体是毕赤酵母,有关研究表明[34],酵母表达产物有利于增加机体的抗氧化能力。本试验结果还显示,试验组斜带石斑鱼的总抗氧化能力均高于对照组,且4mg/kg试验组显著高于对照组,说明体外喷涂斜带石斑鱼生长激素基因重组蛋白可以增强其抗氧化能力,这可能是由于重组GH在促进生长的同时,又增强了机体的免疫力。
3.6 饲料中添加重组GH对斜带石斑鱼组织磷酸酶活性的影响
ACP和AKP是巨噬细胞溶酶体的标志酶,在体内直接参与磷酸集团的转移与代谢,是参与动物体内免疫活动重要的水解酶类[35]。本研究发现,在饲料中添加一定量的重组生长激素能明显的提高斜带石斑鱼肝脏磷酸酶的活性,且当添加量为4 mg/kg的重组生长激素时,斜带石斑鱼的肝脏和血液表现出的磷酸酶活性最高。GH作为一种促生长激素,国内外许多学者都已证实GH能够影响水生动物的免疫功能[1],适量的补充外源的GH能够提高水生生物的体液免疫因子。李晶等[6]研究发现,连续投喂含有重组GH的饲料能显著提高鲑鱼体内的ACP和AKP的活性,黄新春等[12]研究表明,适当的补充GH能显著提高异育银鲫血清中AKP的活性。
本试验研究结果表明,在饲料中添加4 mg/kg的生长激素基因重组蛋白对于斜带石斑鱼的生长具有明显的促进作用且能提高饲料利用率。重组GH产生这种促生长效果的同时增加了鱼体粗蛋白的含量,减少了粗脂肪的含量,对于其它形态学指标影响不大,且没有致死或者致畸的现象发生。另外重组GH的添加不仅降低了斜带石斑鱼的血脂水平,改善了其消化能力和抗氧化能力,提高了体液免疫因子的活性,对于当今大众对低脂肪,高蛋白食物的需求有重要的现实意义。因此我们认为含有斜带石斑鱼生长激素的酵母上清是一种绿色环保,且效果显著的饵料添加剂,值得大规模的推广和应用。
[1]韦家永,薛良义.鱼类生长激素的研究概况[J].浙江海洋学院学报:自然科学版,2004,23(1):56-58.
[2]张学成,刘顺梅,臧晓南.鱼类生长激素的异源表达、应用及安全性评价[J].中国海洋大学学报,2007,37(6):940-943.
[3]熊良伟,王帅兵,王权.我国水产生物技术的研究进展[J].生物技术通报,2010,26(8):89-92.
[4]叶星,田园园,高风英.转基因鱼的研究进展与商业化前景[J].遗传,2011,33(5):494-503.
[5]王大鹏,曹占旺,谢达祥,等.石斑鱼的研究进展[J].南方农业学报,2012,322(7):1058-1065.
[6]李晶,沙长青,杨成辉.重组鲑鱼生长激素基因酵母对鲤鱼苗促生长作用研究[J].中国饲料,2004,15(18):30-33.
[7]马进,白俊杰,简清,等.重组虹鳟生长激素酵母对罗非鱼的促生长作用研究[J].大连水产学院学报,2001,16(3):219 -222.
[8]孙颖,林浩然.基因重组草鱼生长激素(r-gGH)对草鱼鱼种生长的促进作用[J].水产学报,2006,30(6):741-745.
[9]邢福国,谭训刚,张培军,等.基因重组牙鲆生长激素(r-fGH)对牙鲆幼苗生长的促进作用[J].粮食与饲料工业,2009,32(7):37 -38.
[10]ACOSTA J,MORALES R,MORALES A,et al.Pichia pastoris expressing recombinant tilapia growth hormone accelerates the growth of tilapia[J].Biotechnology Letters,2007,29(11),1671-1676.
[11]王树启,许友卿,丁兆坤.生长激素对鱼类的影响及其在水产养殖中的应用[J].水产科学,2005,24(7):42-44.
[12]黄新春,周洪琪,邱小琮,等.基因重组生长激素对异育银鲫促生长的研究[J].上海水产大学学报,2003,12(1):83 -86.
[13]刘丽,赵会宏,张国良,等.肌肽对奥尼罗非鱼生长性能的影响[J].水生生物学报,2008,35(5):643-648.
[14]黄晓南.大黄鱼生长激素基因工程酵母的发酵及其对鱼苗的促生长作用[J].福建畜牧兽医,2011,33(2):17-19.
[15]陈荣忠,杨丰,徐洵.鱼生长激素重组酵母对海水鱼的促生长效应的研究[J].中国畜禽种业,2005,21(7):49-51.
[16]RAVEN P A,UH M,SAKHRANI D,et al.Endocrine effects of growth hormone over expression in transgenic coho salmon[J].General and Comparative Endocrinology,2008,159(2/3),26-37.
[17]郑艳,汝少国.外源化学物质对鱼类生长和GH/IGFI轴的影响[J].中国海洋大学学报:自然科学版,2012,42(S1):102 -106.
[18]DEVLIN R H,BIAGI C A,YESAKI T Y.Growth,viability and genetic characteristics of GH transgenic coho salmon strains[J].Aquaculture,2004,236(1/2/3/4):607-632.
[19]王锡琪.斜带石斑鱼生长激素的促生长作用及胰岛素样生长因子I在毕赤酵母中的表达[D].广州:中山大学生命科学学院,2006.
[20]王赛,陈刚,张健东,等.不同蛋白质源部分替代鱼粉对褐点石斑鱼幼鱼生长性能、体组成以及血清生化指标的影响[J].动物营养学报,2012,24(1):160-167.
[21]ACOSTA J,CARPIO Y.Recombinant truncated tilapia growth hormone enhances growth and innate immunity in tilapia fry(Oreochromis sp.)[J].General and Comparative Endocrinology,2008,157(1):49-57.
[22]ZANG Xiaonan,LIU Bin,LIU Shunmei,et al.Transformation and expression ofParalichthysolivaceus growth hormone cDNA in Synechocystis sp PCC6803[J].Aquaculture,2007,266(1/2/3/4):63-69.
[23]LIU Shunmei,ZHANG Xuecheng,ZANG Xiaonan,et al.Growth,feed efficiency,body muscle composition,and histology of flounder(Paralichthys olivaceus)fed GH transgenic Synechocystis[J].Aquaculture,2008,277(1/2):78-82.
[24]LI Yun,LIU Xiaochun,ZHANG Yong,et al.Molecular cloning,characterization and distribution of two types of growth hormone receptor in orange-spotted grouper(Epinephelus coioides)[J].General and Comparative Endocrinology,2007,152(1):111-122.
[25]王常安,徐奇友,许红,等.饲料中添加氧化三甲胺对哲罗鱼生长性能、肌肉成分、消化道脂肪酶活性和血清生化指标的影响[J].动物营养学报,2012,24(11):2279-2286.
[26]吴莉芳,秦贵信,孙泽威,等.饲料中去皮豆粕替代鱼粉对埃及胡子鲶消化酶活力和肠道组织的影响[J].中山大学学报:自然科学版,2010,49(4):9-104.
[27]白晓慧,熊传喜.不同饲料对鱼类消化酶活性的影响[J].中国饲料,2007,18(10):20 -23.
[28]马细兰,张勇,周立斌,等.LHRH-A对尼罗罗非鱼生长及生长轴相关基因表达的影响[J].水生生物学报,2013,40(1):42-47.
[29]林建斌,李金秋,王剑峰,等.不同能量蛋白比配合饲料对点带石斑鱼幼鱼体内消化酶活性的影响[J].中国饲料,2008,19(14):33-35.
[30]邢克智,郭永军,陈成勋,等.维生素C对点带石斑鱼生长及其组织抗氧化性能的影响[J].水产科学,2012,31(11):635 -639.
[31]QUINITIO G F,SA-AN A C,TOLEDO J D,et al.Localization of enzymes in the digestive system during early development of the grouper(Epinephelus coioides)[J].Advances in Grouper Aquaculture,2004,1:30 -34.
[32]FUJII A,KUROKAWA Y,KAWAI S,et al.Diurnal variation of tryptic activity in larval stage and development to proteolytic enzyme activities of malabar grouper(Epinephelus malabaricus)after hatching[J].Aquaculture,2007,270(1):68 -76.
[33]ZACCARON Da S A,ZANETTE J,FERNANDO J,et al.Effects of salinity on biomarker responses in Crassostrea rhizophorae(Mollusca,Bivalvia)exposed to diesel oil[J].Ecotoxicology and Environmental Safety,2005,62(3):376 -382.
[34]MARTINEZ-ALVAREZ R M,MORALES A E,SANZ A.Antioxidant defenses in fish:biotic and a biotic factors[J].Reviews in Fish Biology and Fisheries,2005,15(1):75-88.
[35]温为庚,林黑着,吴开畅,等.饲料中添加虾青素对斑节对虾生长和免疫的影响[J].中山大学学报:自然科学版,2011,50(3):144-146.
[36]王芳倩,张文兵,麦康森,等.饲料中添加还原型谷胱甘肽对牙鲆生长和抗氧化能力的影响[J].中国海洋大学学报:自然科学版,2011,41(4):51-56.

