HER2阳性乳腺癌细胞株上清液对树突状细胞表型及功能的影响
(青岛市中心医院,山东 青岛 266042)
乳腺癌是是女性中最常见的肿瘤,在欧美等发达国家占女性恶性肿瘤的第一位。在中国近几年来乳腺癌发病率迅速上升。统计表明,上海等大城市乳腺癌发病率已占女性恶性肿瘤的第一位。尽管乳腺癌诊断和治疗已有了很大的进步,但是乳腺癌的复发和转移率依然很高,特别是人类表皮生长因子受体2(human epidermalgrowth factor receptor-2,HER2)阳性(HER2+)的乳腺癌更容易复发和转移。树突状细胞(DC)是目前发现的功能最强的专职抗原递呈细胞(APC),在诱导和维持免疫应答中起重要作用。DC 提供共刺激分子和细胞因子给T 细胞使其充分的活化。另外研究表明[1-4],肿瘤浸润DC 与延长恶性肿瘤患者生存期、减少肿瘤复发相关。但是在恶性黑色素瘤患者体内肿瘤浸润DC 存在着表型和功能缺陷,这种缺陷和肿瘤的恶化正相关[5-6]。为了探讨HER2+乳腺癌细胞对患者免疫功能的影响,我们用HER2+MCF-7 培养上清模拟肿瘤微环境,体外观察肿瘤细胞对树突状细胞表面分子及功能的影响。我们的结果表明,肿瘤上清处理的DC 除了共刺激分子和相关细胞因子分泌增加外,还增强了刺激同源异体T 细胞增殖及分泌细胞因子的能力。
1 材料与方法
1.1 材料 HER2+MCF-7 细胞株由美国加州大学李健健教授友情赠送,常规传代培养。RPMI-1640(PAA)。rhGM-CSF(厦门特宝生物工程股份有限公司)和rhIL-4(Miltenyi Biotec),rhIL-2(山东泉港药业有限公司)。FITC 或PE 标记的单克隆流式抗体:CD80、CD86、CD40、CD83 和HLA-DR(BD Pharmingen,San Diego,CA)。IL-12、TNF-α、IL-6、IL-10、IFN-γELISA 检测试剂盒(上海森雄科技有限公司)。DC 分离试剂盒和CD3+T 细胞分离试剂盒(Miltenyi Biotech,BergischGladbach,Germany)。流式细胞仪(FACSCalibur;BDBioscience)。
1.2 方法
1.2.1 DC 的体外诱导 取健康志愿者外周血10 mL常规分离获得单个核细胞,悬浮(密度为2 ×109/L)后,加入24 孔板(每孔1 mL),37℃、5%CO2 培养2 h后吸弃培养上清和洗涤去除非贴壁细胞,即获得贴壁的细胞。每孔加入含IL-4(500 U/mL)、rhGM-CSF(1000 U/mL)的完全培养基1 mL 诱导培养。1 ×107MCF-7 细胞种植在10 mm 的培养皿中,终体积10 mL,24 小时后收集上清。DC 培养到第5 天,加入肿瘤上清,同体积的完全培养基做对照组。DC 培养的第6 天,一部分用TNF-α(20 ng/mL,R&D System)诱导成熟,一部分磁珠纯化,用作细胞因子检测。24小时后收集各组诱导成熟的DC,检测细胞表面标志。
1.2.2 DC 表型分子的检测 收集经诱导培养7 天的DC 细胞,洗涤细胞,并调整细胞密度为1 ×109/L,各取100μL 细胞悬液加入到离心管中,每管内分别加入PE 或FITC 标记的抗人CD80、CD83、CD86、CD40、HLA-DR 单克隆抗体各20μL,室温避光作用30 min后,用PBS 液洗细胞2 次。将细胞悬于PBS 液中,用流式细胞仪检测细胞表面标志的表达。重复上述步骤共3 次。
1.2.3 DC 来源的细胞因子检测 纯化的DC 调整细胞密度2 ×105/mL,种植到96 孔板,每孔0.2 mL,TNF-α诱导成熟。24 小时后收集上清100μL,ELISA 检测IL-12、TNF-α、IL-6 的分泌水平。
1.3 混合淋巴细胞培养 采用改良的MTT 比色法。收集实验组和对照组纯化的、30GX 线(Gammacell 40 Exactor;MDS Nordion International,Inc.,Ottawa,Ontario,CA)照射的DC,分别与分离纯化的同种异体的CD3+T 细胞以(DC/T)1:20、1:100、1:500 比例混合后置96 孔板培养共培养72 h。一部分于培养结束前4 h,每孔加入5 g/L 的MTT 20μL,培养终止时,再在每孔加入100μL SDS-DMF 溶解液,过夜。待细胞形成的MTT 结晶完全溶解后,用酶标仪在波长570 nm 和630 nm 检测各孔的A 值,结果以8 孔的A570-A630的平均值表示。一部分于培养结束时收集上清100 μL,ELISA 检测TNF-α、IL-6、IL-4、IFN-γ。实验严格按照试剂盒说明进行操作。
1.4 统计学处理 应用SPSS19.0 统计软件进行统计学分析,数据以“均数±标准差”表示,采用t检验。
2 结果
2.1 HER2+MCF-7 细胞诱导的DC 共刺激分子表达 培养至第5 天的DC 在肿瘤上清液诱导48 小时后,检测细胞表型分子表达情况,结果如表1。肝素组表达CD40、CD80、CD86 及CD83 分子水平高于无上清液组(P<0.05),HLA-DR 的表达两组间无差异。
2.2 HER2+MCF-7 细胞上清对DC 分泌IL-12、TNF-α、IL-6 和IL-10 的影响 除了共刺激分子,DC 分泌的细胞因子在激发T 细胞应答中也起重要作用。如表2所示,ELISA 检测结果显示,纯化的、上清诱导的DC 分泌IL-12、TNF-α、IL-6 的水平明显高于对照组。而IL-10 的分泌量显著低于对照组。
2.3 肿瘤上清诱导的DS 刺激同种异体T 细胞增殖的能力 为了证实肿瘤上清诱导的DS 对T 细胞的刺激作用,纯化的异体CD3+T 细胞与DS 按不同的比例混合培养,结果如图1显示:当DC/T 比是1:20、1:100时T 细胞的增殖能力明显增加,肿瘤细胞促进了DCs对T 细胞的刺激能力。

表1 肿瘤上清诱导的DCs 第7 天表面分子的表达情况(x-±s)
表2 肿瘤上清诱导的DCs 分泌TNF-α、IL-6、IL-12、IL-10 量(pg/ml,±s)

表2 肿瘤上清诱导的DCs 分泌TNF-α、IL-6、IL-12、IL-10 量(pg/ml,±s)
注:与对照组比较,▲P<0.01,*P<0.05。MCF-7 组:肿瘤细胞上清液处理组。
组别 n IL-12 TNF-α IL-6 IL-10 MCF-7 组 20 521.6 ±89.0▲ 3200.21 ±728.09* 213.00 ±61.21▲ 70.43 ±21.89*对照组 20 292.44 ±75.2 2712.45 ±699.78 89.11 ±50.23 92.23 ±30.22
2.4 肿瘤上清诱导的DCs 刺激同种异体T 细胞分泌细胞因子的能力 肿瘤上清诱导的、X 线照射的DCs和纯化的CD3+T 以1:20(T/DC)细胞共培养72 小时后,培养上清中TNF-α、IL-6、IFN-γ的含量明显高于对照组,但刺激IL-4 分泌的能力两组间无明显差异(图2)。

图1 实验组和对照组的DC 刺激同种异体T 细胞增殖的比较
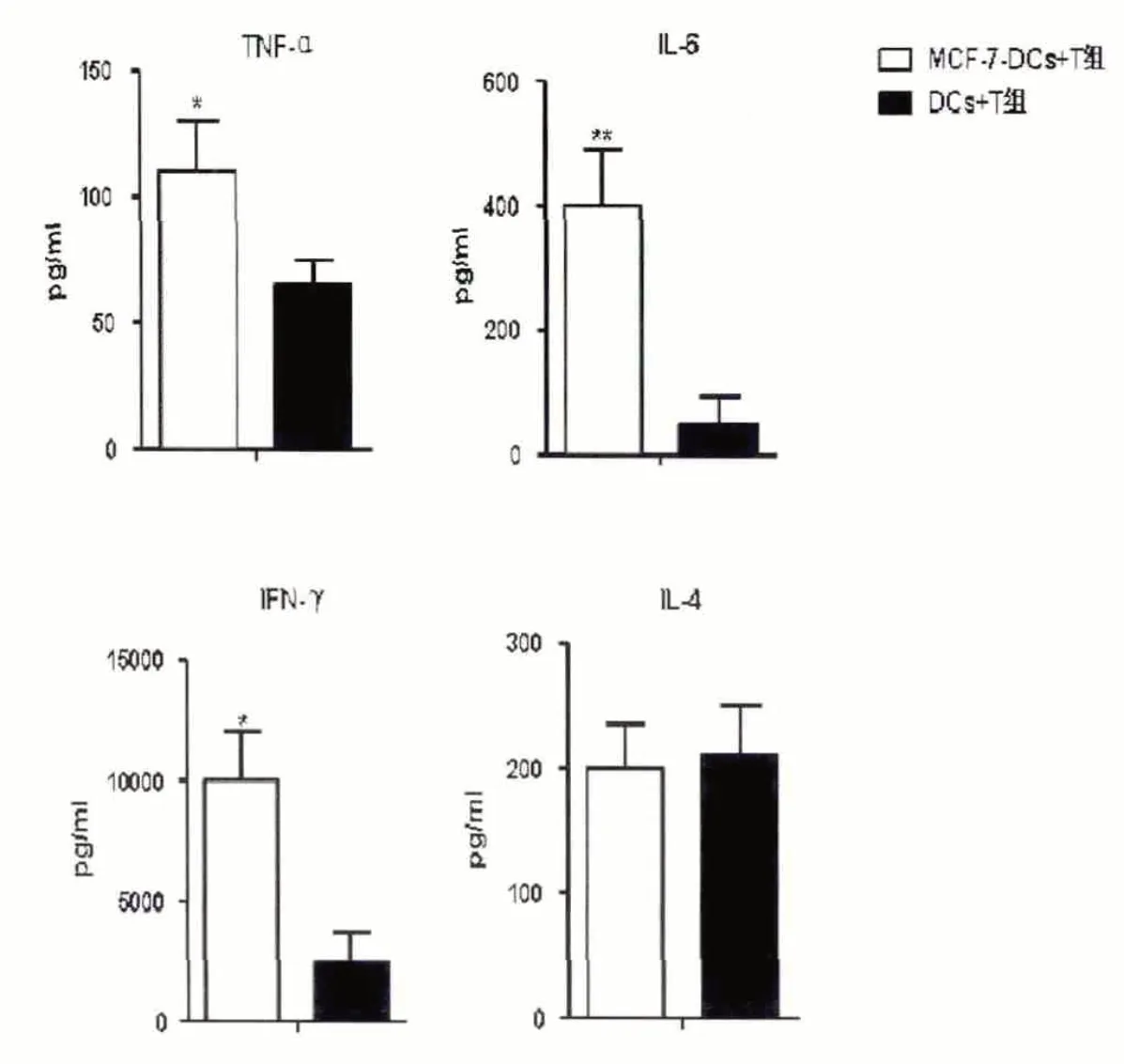
图2 肿瘤上清处理的DC 激发同源异体T 细胞细胞因子的分泌能力
3 讨论
DC 在激发特异性免疫应答中起重要作用。用肿瘤抗原或抗原多肽冲击致敏DC 和经DC 转染抑癌基因,均可诱导显著的抗肿瘤作用。组织活检发现,肿瘤组织中有DC 浸润时,常提示预后良好[2,3,7],然而肿瘤细胞释放的某些也会抑制DS 的免疫功能,使肿瘤产生免疫逃逸[8,9]。DC 上表面标志的表达与其功能关系密切,DC 对抗原多肽的提呈除需要MHC-II 类分子的参与外,对T 细胞的激活还需要其表面表达的共刺激分子及黏附分子的参与。
本研究中,我们将HER2+MCF-7 细胞的培养上清加入到单核细胞来源的DC 培养体系中,结果发现,肿瘤上清不仅没有抑制DC 的表面分子表达和细胞因子分泌,相反还促进了其表达和分泌,这些结果与某些研究着者不一致[10-12],这表明肿瘤对DC 表型和细胞因子表达的影响是肿瘤特异性的。
DC 表面共刺激分子CD80、CD86、CD40 与T 细胞上相应的配体结合,为T 细胞活化提供重要的第二信号。IL-12 是促进Th0 向Th1 分化的重要细胞因子,IL-10 是免疫抑制因子,能抑制MHC 和共刺激分子的表达,阻止Th1 型细胞因子的产生[13]。我们的研究显示,肿瘤上清增加了DC 表达CD80、CD86、CD40 的水平和分泌TNF-α、IL-6、IL-12 的量,同时降低了IL-10 的分泌量。这表明HER2+乳腺癌细胞可能通过DC 增强T 细胞的功能。我们通过混合淋巴细胞反应发现,肿瘤上清处理的DC 能刺激T 细胞更强的增殖,同时使其分泌更多的细胞因子包括TNF-α、IL-6、IFN-γ,而IL-4 的分泌却无明显增加。IFN-γ是Th1 细胞分泌的主要细胞因子,而IL-4 是Th2 型细胞分泌因子。这些结果表明,HER2+乳腺癌细胞能通过改善DC 的功能,而促进Th1 型细胞免疫应答。当然在体内真实的肿瘤微环境内,肿瘤细胞对DC 表型和功能的影响还需进一步研究。
尽管多数肿瘤是通过免疫抑制而进行免疫逃逸的,但我们的研究结果表明:HER2+MCF-7 细胞对DC可能产生免疫刺激效应,针对DC 的免疫治疗可能是治疗Her2+乳腺癌可选择的一种方法。
[1]Dieu-Nosjean MC,Antoine M,Danel C,Heudes D,Wislez M,Poulot V,Rabbe N,Laurans L,Tartour E,de Chaisemartin L,et al.Long-term survival for patients with non-small-cell lung cancer with intratumoral lymphoid structures[J].JClin Oncol,2008,26:4410-4417.
[2]Iwamoto M,Shinohara H,Miyamoto A,Okuzawa M,Mabuchi H,Nohara T,Gon G,Toyoda M,Tanigawa N.Prognostic value of tumor-infiltrating dendritic cells expressing CD83 in human breast carcinomas[J].Int JCancer,2003,104:92-97.
[3]Ladanyi A,Kiss J,Somlai B,Gilde K,Fejos Z,Mohos A,Gaudi I,Timar J.Density of DC-LAMP(+)mature dendritic cells in combination with activated T lymphocytes infiltrating primary cutaneous melanoma is a strong independent prognostic factor[J].Cancer Immunol Immunother,2007,56:1459-1469.
[4]Nakakubo Y,Miyamoto M,Cho Y,Hida Y,Oshikiri T,Suzuoki M,Hiraoka K,Itoh T,Kondo S,Katoh H.Clinical significance of immune cell infiltration within gallbladder cancer[J].Br J Cancer,2003,89:1736-1742.
[5]Ataera H,Hyde E,Price KM,Stoitzner P,Ronchese F.Murine melanoma-infiltrating dendritic cells are defective in antigen presenting function regardless of the presenceof CD4CD25 regulatory Tcells[J].PLoSOne,2011,6:e17515.
[6]Stoitzner P,Green LK,Jung JY,Price KM,Atarea H,Kivell B,Ronchese F.Inefficient presentation of tumor-derived antigen by tumorinfiltrating dendritic cells[J].Cancer Immunol Immunother,2008,57:1665-1673.
[7]Dieu-Nosjean MC,Antoine M,Danel C,Heudes D,Wislez M,Poulot V,Rabbe N,Laurans L,Tartour E,de Chaisemartin L et al.Long-term survival for patients with non-small-cell lung cancer with intratumoral lymphoid structures[J].JClin Oncol,2008,26:4410-4417.
[8]Preynat-Seauve O,Schuler P,Contassot E,Beermann F,Huard B,French LE.Tumor-infiltrating dendritic cells are potent antigen-presenting cells able to activate T cells and mediate tumor rejection[J].J Immunol,2006,176:61-67.
[9]Zou W.Immunosuppressive networks in the tumour environment and their therapeutic relevance[J].Nat Rev Cancer,2005,5:263-274.
[10]Bharadwaj U,Li M,Zhang R,Chen C,Yao Q.Elevated interleukin-6 and G-CSF in human pancreatic cancer cell conditioned medium suppress dendritic cell differentiation and activation[J].Cancer Res,2007,67:5479-5488.
[11]Ma J,Usui Y,Takeuchi M,Okunuki Y,Kezuka T,Zhang L,Mizota A,Goto H.(2010)Human uveal melanoma cells inhibit the immunos timulatory function of dendritic cells[J].Exp Eye Res,2010,91:491-499.
[12]Michielsen AJ,Hogan AE,Marry J,Tosetto M,Cox F,Hyland JM,Sheahan KD,O’Donoghue DP,Mulcahy HE,Ryan EJ et al.Tumour tissue microenvironment can inhibit dendritic cell maturation in colorectal cancer[J].PLoSOne,2011,6:e27944.
[13]Lippitz BE.Cytokine patterns in patients with cancer:a systematic review[J].Lancet Oncol,2013,14:e218-e228.

