姜黄素对骨髓瘤细胞迁移和侵袭能力的影响及其机制研究*
马泳泳, 黄 进, 周淑娟, 葛杭萍, 俞 康
多发性骨髓瘤(multiple myeloma,MM)是一种起源于B淋巴细胞系并能够产生单克隆免疫球蛋白(M蛋白)的恶性增生性疾病[1],中老年人易患,是血液系统第二大常见恶性肿瘤。MM的发病是一个极其复杂的病理生理过程,其中遗传学异常、骨髓微环境、细胞因子网络,在MM的发病机制中起着重要作用[2-3]。
姜黄素(curcumin)是从草本植物姜黄的根茎中提取出来的酚类色素。近年被证实其主要药理作用是通过调控特定的靶基因如生长因子、转录因子等发挥抗炎、抗肿瘤、抗动脉粥样硬化、抗脂质过氧化、抗病毒等作用[4-6]。已有报道姜黄素能抑制人体多种肿瘤细胞的生长,包括小细胞肺癌、卵巢癌、肾癌、前列腺癌等[7-10]。不同的肿瘤细胞系涉及不同的机制。姜黄素对骨髓瘤细胞的作用主要集中在其抑制肿瘤细胞的生长、增殖及促进凋亡,但对其迁移侵袭能力并无相关研究。含IQ模序的RasGTP酶活化蛋白1(IQ motif-containing GTPase-activating protein 1,IQGAP1)是一个细胞骨架结合蛋白,通过接收和发射各种信号调节细胞迁移和细胞间黏附,促进细胞的迁移[11-12]。我们的前期工作已证实IQGAP1在骨髓瘤细胞中表达增高[13]。IQGAP1是否在骨髓瘤细胞的迁移和侵袭中起到重要作用?姜黄素是否能对IQGAP1在骨髓瘤细胞的迁移和侵袭中发挥的作用有抑制或阻断?本研究期望为MM的临床治疗提供新思路及实验依据。
材料和方法
1 主要药品和试剂
姜黄素(Sigma)用二甲基亚砜配成8 mmol/L储存液,使用前用无菌PBS稀释至工作浓度。RPMI-1640培养液为 Gibco产品,胎牛血清(fetal calf serum,FCS)购自杭州四季青生物公司,其它生化试剂均为进口分装或国产分析纯。Matrigel胶购自Becton Dickinson。Costar 3422 Transwell小室购自Corning。
2 主要方法
2.1 细胞株的培养 人多发性骨髓瘤细胞株RPMI8226由温州医学院内科实验室长期保存,实验前从-196℃液氮罐中取出,快速复苏后用用含10%FCS的RPMI-1640培养液重悬后,置于37℃、5%CO2、饱和湿度培养箱中培养,每2~3 d换液1次。选择对数生长期细胞进行实验。
2.2 IQGAP1沉默及转染RPMI8226细胞 参照文献[13]选择 RPMI8226-shIQGAP1(clone 1)沉默 IQGAP1。
2.3 IQGAP1蛋白的检测
2.3.1 质粒转染 RPMI8226细胞后,收集 RPMI8226-shIQGAP1组、RPMI8226-shRNA阴性对照组和RPMI8226组细胞,行2.3.3步骤实验。
2.3.2 取对数生长期细胞,按1×109/L密度接种于6孔板内。姜黄素 0、20、30及 40 μmol/L作用RPMI8226-shIQGAP1组、RPMI8226-shRNA阴性对照组和未转染RPMI8226组细胞24 h,行2.3.3步骤实验。
2.3.3 抽提蛋白,电泳,转膜,经5%脱脂奶粉封闭后,与1∶500稀释度的抗IQGAP1抗体和适宜稀释度的Ⅱ抗(羊抗鼠Ig-HRP)孵育,经Odyssey显色系统显色,收集蛋白印迹图。
2.4 迁移能力的测定
2.4.1 取对数生长期细胞,按1×109/L密度接种于6孔板内。细胞分为姜黄素 0 μmol/L组、20 μmol/L 组、30 μmol/L 组和 40 μmol/L 组,亚组分 3组:RPMI8226-shIQGAP1组、RPMI8226-shRNA阴性对照组和未转染RPMI8226组,每组设3个复孔。培养箱中培养24 h后行2.4.2步骤迁移实验。
2.4.2 将 0.8 μm 孔径的 Transwell小室套入 24 孔板中,上腔中加入200 μL RPMI-1640培养液,37℃放置1 h。收集各组细胞,用无血清培养液洗涤和重悬各组细胞,并将细胞浓度调整至1×109/L。小心弃除Transwell小室中的培养液,均匀加入200 μL各组细胞悬液至小室上腔。通过间隙加入600 μL含10%FBS的RPMI-1640培养液至下腔,避免产生汽泡,培养箱培养48 h后将Transwell小室取出。分别收集各组穿过滤膜进入小室下腔的细胞,制成20 μL细胞悬液。吸取少量悬液充满计数板池,在显微镜下计数细胞。
2.5 Matrigel侵袭实验
2.5.1 取对数生长期细胞,按1×109/L密度接种于6孔板内。细胞分为姜黄素 0 μmol/L组、20 μmol/L 组、30 μmol/L 组和 40 μmol/L 组,亚组分 3组:RPMI8226-shIQGAP1组、RPMI8226-shRNA阴性对照组和未转染RPMI8226组,每组设3个复孔。培养箱中培养24 h后行2.5.2步骤Matrigel侵袭实验。
2.5.2 将-20℃保存的Matrigel,在冰上4℃过夜融化,在冰上用预冷的枪头吸取100 μL Matrigel加入冰预冷的300 μL无血清培养液中,充分混匀。取上述稀释的Matrigel 50 μL加入Transwell板上室,覆盖整个聚碳酯膜,37℃放置30 min,使Matrigel聚合成胶。细胞接种密度为2×108/L。接种方法、观测时间及细胞收集、计数方法同迁移实验。
2.6 RT-PCR法检测姜黄素作用后IQGAP1 mRNA的表达 取对数生长期细胞,按1×109/L密度接种于6孔板内。姜黄素0或40 μmol/L作用于 RPMI8226-shIQGAP1组、RPMI8226-shRNA阴性对照组和未转染RPMI8226组细胞24 h,采用RNeasy Mini试剂盒分离纯化各组细胞的总RNA,分光光度法测定计算提取的总RNA含量及浓度。参照OneStep RT-PCR试剂盒实验操作说明进行RT-PCR[14]。
3 统计学处理
用SPSS 16.0统计软件分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法)。以P<0.05为差异有统计学意义。
结 果
1 不同浓度姜黄素对RPMI8226-shIQGAP1组、RPMI8226-shRNA阴性对照组和未转染RPMI8226组细胞迁移及侵袭力的影响
Transwell迁移实验结果显示,0 μmol/L姜黄素作用于RPMI8226-shIQGAP1组24 h后,穿过滤膜进入下腔的细胞数明显少于RPMI8226-shRNA阴性对照组和未转染RPMI8226组,差异显著(P<0.05);在RPMI8226-shRNA 阴性对照组,经姜黄素20 μmol/L、30 μmol/L 和 40 μmol/L 作用后的组穿过滤膜进入下腔的细胞数较0 μmol/L姜黄素组明显减少,差异显著(P<0.05);未转染RPMI8226细胞经姜黄素 20 μmol/L、30 μmol/L 和 40 μmol/L 作用后,穿过滤膜进入下腔的细胞数较0 μmol/L姜黄素组明显减少,差异显著(P<0.05);经姜黄素20 μmol/L、30 μmol/L 和 40 μmol/L 作用后的同一浓度组内RPMI8226-shIQGAP1组、RPMI8226-shRNA阴性对照组和未转染RPMI8226组穿过滤膜进入下腔的细胞数无显著差异,见表1。
Transwell侵袭实验也显示,经0 μmol/L姜黄素作用后RPMI8226-shIQGAP1组进入下腔的细胞数明显少于RPMI8226-shRNA阴性对照组和未转染RPMI8226组,差异显著(P<0.05);在RPMI8226-shRNA 阴性对照组,经姜黄素 20 μmol/L、30 μmol/L 和40 μmol/L作用后进入下腔的细胞数较0 μmol/L姜黄素组明显减少,差异显著(P<0.05);未转染RPMI8226 细胞经姜黄素 20 μmol/L、30 μmol/L 和 40 μmol/L作用后,进入下腔的细胞数较0 μmol/L姜黄素组明显减少,差异显著(P<0.05)。经姜黄素20 μmol/L、30 μmol/L 和 40 μmol/L 作用后的同一浓度组内 RPMI8226-shIQGAP1组、RPMI8226-shRNA阴性对照组和未转染RPMI8226组进入下腔的细胞数无显著差异,见表2。
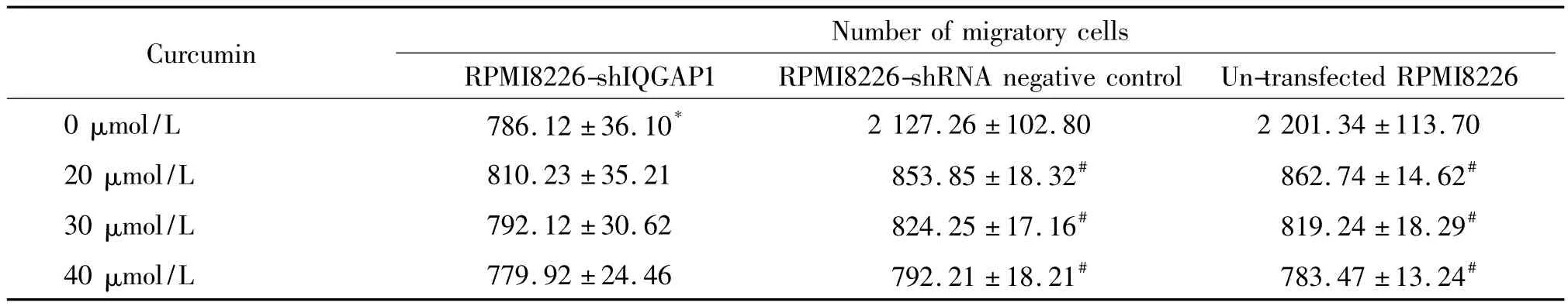
表1 姜黄素对不同RPMI8226细胞迁移力的影响Table 1.Migration of RPMI8226 cells treated with curcumin(Mean±SD.n=3)
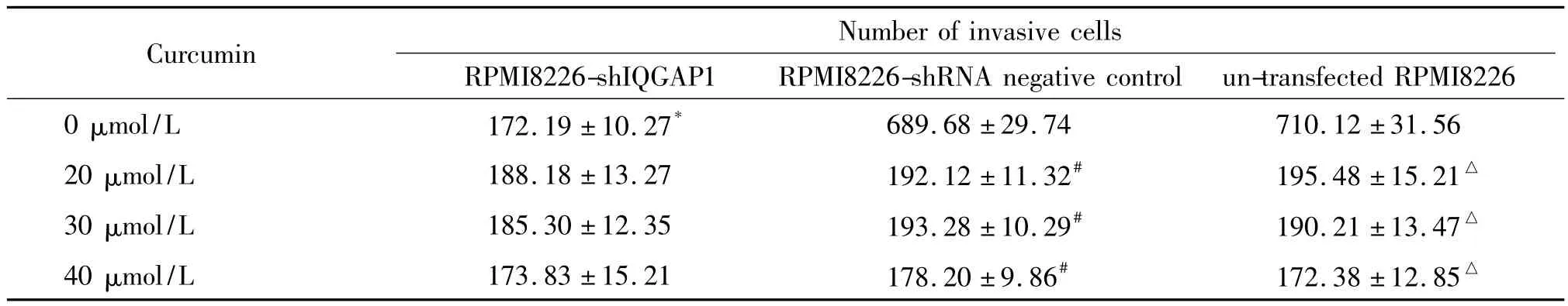
表2 姜黄素对不同RPMI8226细胞侵袭力的影响Table 2.Invasion of RPMI8226 cells treated with curcumin(Mean±SD.n=3)
2 RT-PCR检测姜黄素对不同RPMI8226细胞IQGAP1 mRNA表达的影响
姜黄素0或40 μmol/L作用于RPMI8226-shIQGAP1组、RPMI8226-shRNA阴性对照组和未转染RPMI8226组细胞24 h,RT-PCR结果提示姜黄素0 μmol/L作用后,RPMI8226-shRNA阴性对照组和未转染RPMI8226组细胞表达IQGAP1 mRNA,而RPMI8226-shIQGAP1组无IQGAP1 mRNA表达;姜黄素40 μmol/L作用后,3组均未见IQGAP1 mRNA表达,见图1。

Figure 1.RT-PCR showed the mRNA expression of IQGAP1 in RPMI8226 cells treated with curcumin.图1 RT-PCR检测姜黄素对不同RPMI8226细胞IQGAP1 mRNA表达的影响
3 Western blotting检测姜黄素对不同RPMI8226细胞IQGAP1蛋白表达的影响
姜黄素 0、40 μmol/L 作用于 RPMI8226-shIQGAP1组、RPMI8226-shRNA阴性对照组和未转染RPMI8226组细胞24 h,Western blotting结果提示姜黄素0 μmol/L作用后,RPMI8226-shRNA阴性对照组和未转染RPMI8226组细胞表达IQGAP1蛋白,而RPMI8226-shIQGAP1组无IQGAP1蛋白表达;姜黄素40 μmol/L作用后,3组均未见 IQGAP1蛋白表达,见图2。
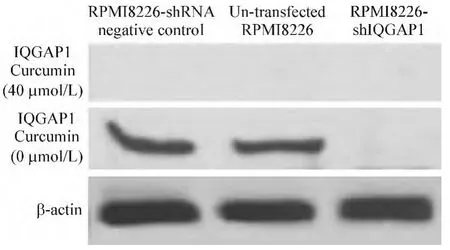
Figure 2.Western blotting showed the protein expression of IQGAP1 in RPMI8226 cells treated with curcumin.图2 Western blotting检测姜黄素对不同RPMI8226细胞IQGAP1蛋白表达的影响
讨 论
姜黄素是一种植物多酚,具有多方面的药理作用如抗肿瘤、抗炎、抗氧化等,其抗肿瘤作用正日益受到国内外学者的关注。大量实验研究表明,姜黄素对不同组织来源的恶性肿瘤细胞,如胃癌、结肠癌、前列腺癌、肾癌、淋巴瘤、白血病等细胞系都显示了良好的抗肿瘤活性,可以抑制肿瘤细胞增殖、侵袭、转移和耐药,具体机制十分复杂。但姜黄素对骨髓瘤细胞迁移和侵袭能力的影响并无相关研究。
IQGAPs是近年新发现的一个蛋白家族,IQGAP1是Rho家族GTP酶成员Rac1和Cdc42的一个重要的效应因子,能与细胞骨架和黏附成分广泛作用[15-18],通过调节分裂原激活蛋白激酶途径,可以影响细胞增殖和分化,在细胞黏附和迁移的信号网络中发挥关键作用[19-21]。IQGAP1位于染色体15q26上,是基因扩增热点。
在本研究的Transwell迁移实验中,未转染RPMI8226 细胞经姜黄素 20 μmol/L、30 μmol/L 和 40 μmol/L作用后穿过滤膜进入下腔的细胞数较0 μmol/L姜黄素组明显减少,差异显著(P<0.05);同样,在Transwell侵袭实验也显示未转染RPMI8226细胞经姜黄素 20 μmol/L、30 μmol/L 和 40 μmol/L作用后进入下腔的细胞数较0 μmol/L姜黄素组明显减少,差异显著(P<0.05)。以上实验结果提示:姜黄素对骨髓瘤细胞的迁移和侵袭有抑制作用。
shRNA表达质粒沉默IQGAP1后转染RPMI8226细胞,Western blotting检测 RPMI8226-shIQGAP1组的IQGAP1蛋白较另2组表达减少,差异显著。之后在Transwell迁移实验中,姜黄素0 μmol/L处理RPMI8226-shIQGAP1组24 h后,穿过滤膜进入下腔的细胞数明显少于RPMI8226-shRNA阴性对照组和未转染RPMI8226组,差异显著(P<0.05);同样,在Transwell侵袭实验,经0 μmol/L姜黄素作用后RPMI8226-shIQGAP1组进入下腔的细胞数明显少于RPMI8226-shRNA阴性对照组和未转染RPMI8226组,差异显著(P<0.05)。上述实验结果提示,IQGAP1在骨髓瘤细胞的迁移和侵袭中起到重要作用。
姜黄素对IQGAP1蛋白及mRNA的表达同样有抑制作用。在姜黄素40 μmol/L作用于RPMI8226-shIQGAP1组、RPMI8226-shRNA阴性对照组和未转染RPMI8226组细胞24 h,3组均未见IQGAP1蛋白及mRNA表达,而姜黄素0 μmol/L(对照组)作用24 h后,RPMI8226-shRNA阴性对照组和未转染 RPMI8226组细胞可检到IQGAP1 mRNA及蛋白表达。
姜黄素是否能对IQGAP1在骨髓瘤细胞的迁移侵袭发挥的作用有抑制或阻断呢?shRNA表达质粒沉默IQGAP1后转染RPMI8226细胞,在RPMI8226-shIQGAP1 组,姜黄素0 μmol/L、20 μmol/L、30 μmol/L和40 μmol/L处理组的Transwell迁移实验中穿过滤膜进入下腔的细胞数无显著差异,证实除IQGAP1的影响因素外可能不存在其它影响RPMI8226细胞迁移的因素;在Transwell侵袭实验,结果相似。而在RPMI8226-shRNA阴性对照组和未转染RPMI8226组,经姜黄素 20 μmol/L、30 μmol/L 和40 μmol/L 作用后的同一浓度组内穿过滤膜进入下腔的细胞数无显著差异,亦提示在姜黄素对RPMI8226细胞迁移的抑制作用中,影响因素单一;在Transwell侵袭实验,结果相似。因此,本研究证实姜黄素通过抑制IQGAP1的表达降低骨髓瘤细胞的迁移力和侵袭力。本研究有望为MM的临床治疗提供新思路及实验依据。
[1] 汤丽苑,徐 钰,陈 瑾,等.人多发性骨髓瘤RPMI 8226细胞条件培养液诱导破骨前体细胞的分化成熟[J].中国病理生理杂志,2012,28(4):649-654.
[2] 李 滢,李 娟,黄蓓晖,等.硼替佐米对多发性骨髓瘤患者Treg细胞的影响及与肿瘤负荷、化疗疗效的关系[J].中国病理生理杂志,2012,28(6):985-990.
[3] 马泳泳,周淑娟,葛杭萍,等.丙戊酸钠对RPMI8226和U266细胞增殖及IL-6/JAK/STAT信号通路的影响[J].中国病理生理杂志,2013,29(5):833-838.
[4] Gulcubuk A,Haktanir D,Cakiris A,et al.Effects of curcumin on proinflammatory cytokines and tissue injury in the early and late phases of experimental acute pancreatitis[J].Pancreatology,2013,13(4):347-354.
[5] Di Pierro F,Settembre R.Safety and efficacy of an add-on therapy with curcumin phytosome and piperine and/or lipoic acid in subjects with a diagnosis of peripheral neuropathy treated with dexibuprofen[J].J Pain Res,2013,6:497-503.
[6] Liu L,Liu YL,Liu GX,et al.Curcumin ameliorates dextran sulfate sodium-induced experimental colitis by blocking STAT3 signaling pathway[J].Int Immunopharmacol,2013,17(2):314-320.
[7] Yan L,Yee JA,Cao J.Curcumin reduces trabecular and cortical bone in naive and Lewis lung carcinoma-bearing mice[J].Anticancer Res,2013,33(8):3153-3161.
[8] Guo H,Xu YM,Ye ZQ,et al.Curcumin induces cell cycle arrest and apoptosis of prostate cancer cells by regulating the expression of IκBα,c-Jun and androgen receptor[J].Pharmazie,2013,68(6):431-434.
[9] Gupta SC,Patchva S,Aggarwal BB.Therapeutic roles of curcumin:lessons learned from clinical trials[J].AAPS J,2013,15(1):195-218.
[10]Shehzad A,Khan S,Sup Lee Y.Curcumin molecular targets in obesity and obesity-related cancers[J].Future Oncol,2012,8(2):179-190.
[11] White CD,Erdemir HH,Sacks DB,et al.IQGAP1 and its binding proteins control diverse biological functions[J].Cell Signal,2012,24(4):826-834.
[12] Jameson KL,Mazur PK,Zehnder AM,et al.IQGAP1 scaffold-kinase interaction blockade selectively targets RAS-MAP kinase-driven tumors[J].Nat Med,2013,19(5):626-630.
[13]马泳泳,黄 进,周淑娟,等.IQGAP1在人骨髓瘤细胞中过表达且与ERK相互作用[J].中国病理生理杂志,2013,29(12):2179-2185.
[14]何 易,李旭东,王东宁,等.FISH联合multiplex RTPCR检测MLL基因重排的价值探讨[J].中国病理生理杂志,2012,28(8):1388-1391.
[15] White CD,Brown MD,Sacks DB,et al.IQGAPs in cancer:a family of scaffold proteins underlying tumorigenesis[J].FEBS Lett,2009,583(12):1817-1824.
[16] Johnson M,Sharma M,Henderson BR,et al.IQGAP1 regulation and roles in cancer[J].Cell Signal,2009,21(10):1471-1478.
[17] Jadeski L,Mataraza JM,Jeong HW,et al.IQGAP1 stimulates proliferation and enhances tumorigenesis of human breast epithelial cells[J].J Biol Chem,2008,283(2):1008-1017.
[18] Liu Z,Liu D,Bojdani E,et al.IQGAP1 plays an important role in the invasiveness of thyroid cancer[J].Clin Cancer Res,2010,16(2):6009-6018.
[19] Sato A,Naito T,Hiramoto A,et al.Association of RNase L with a RAS GTPase-activating-like protein IQGAP1 in mediating the apoptosis of a human cancer cell-line[J].FEBS J,2010,277(4):4464-4473.
[20] Dong P,Nabeshima K,Nishimura N,et al.Overexpression and diffuse expression pattern of IQGAP1 at invasion fronts are independent prognostic parameters in ovarian carcinomas[J].Cancer Lett,2006,243(1):120-127.
[21] Balenci L,Clarke ID,Dirks PB,et al.IQGAP1 protein specifies amplifying cancer cells in glioblastoma multiforme[J].Cancer Res,2006,66(12):9074-9082.

