转录因子IRF8抑制Th17细胞分化并减轻T细胞免疫介导的小鼠结肠炎*
李庆山, 杜庆华, 谢健晋, 邓家德, 余碧珍, 江雪杰, 孟凡义△
炎症性肠病(inflammatory bowel disease,IBD)包括克罗恩病(Crohn disease,CD)和溃疡性结肠炎(ulcerative colitis,UC)是除了肠道恶性肿瘤以外比较严重的慢性肠道疾病,近年来的研究发现该疾病与肠道黏膜免疫反应失衡有关。虽然目前该病的病因和发病机制尚不完全明确,但是许多研究认为它是与Th1细胞有关的自身免疫性疾病。目前的研究表明,实验变态反应性脑脊髓炎(experimental allergic encephalomyelitis,EAE)、胶原诱导的关节炎(collagen-induced arthritis,CIA)以及一些肠炎,是由白细胞介素23(interleukin 23,IL-23)依赖的Th17细胞或其它分泌IL-17的淋巴细胞引起的。新型的药物ustekinumab可以通过阻断IL-12和IL-23/Th17轴,从而减轻炎症性肠病[1],提示Th17细胞及其相关细胞因子在炎症性肠病的发病机制中起到至关重要的作用,因而中和IL-17A和IL-17F可以作为炎症性肠病的靶向治疗[2-3]。此外临床常见的自身免疫性疾病特发性血小板减少性紫癜与大鼠的自身免疫性心肌炎的发病均与Th17细胞及其相关的细胞因子有关[4-5]。
干扰素调节因子(interferon regulatory factor,IRF)家族成员与Th17细胞发育密切相关。它存在于多种类型细胞中,被干扰素 γ(interferon γ,IFN-γ)所诱导。通常IRF8被树突状细胞和巨噬细胞中IFN-γ所诱导,但其作为转录的激活或者抑制剂,依靠于IRF8异源二聚体DNA结合点与其它上皮细胞特异性转录(epithelium-specific transcription,EST)因子家族和IRF家族转录因子结合形成不同的复合物有关[6]。IRF家族重要成员之一的IRF4不仅对Th2的发育至关重要,而且在小鼠EAE模型中,不能发生EAE与来源于IRF4基因敲除小鼠的Th细胞不能向Th17分化有关,提示有利于向调节性T细胞分化[7]。已经有研究明确IRF8在髓系细胞分化、促进单核细胞向粒细胞分化中起到关键性的作用[8],在DC细胞发育、分化和功能各个方面也是至关重要的调节因子[9],因此对先天性免疫反应的建立是必不可少的。尽管IRF8对免疫细胞的生长、分化和生存的调节至关重要[10],但是IRF8对T细胞激活、分化的直接效应仍未被完全揭示。重组激活基因(recombination activating gene,RAG)编码 Ig分子和 TCR基因重排的重组酶,小鼠RAG1或者RAG2基因被敲除后,Ig和TCR既不能重排也不能表达,表现为T、B淋巴细胞重症联合缺陷。本研究通过转染IRF8全基因敲除和野生型小鼠初始T细胞(CD4+CD45RBhiT细胞)给RAG1-/-小鼠的实验性肠炎模型研究,探讨转录因子IRF8是否通过对Th17细胞分化的影响而调控小鼠结肠炎的发生、发展。
材料和方法
1 动物
野生型(WT)C57BL/6(B6)小鼠和IRF8全基因敲除(IRF8-/-)C57BL/6(B6)小鼠购自 Jackson′s Lab,均为雄性,均为 9~10周龄,在特殊无菌(specific pathogen free,SPF)级饲养笼饲养,温度18~22℃,湿度50% ~60%。动物实验方案得到伦理委员会的同意。
2 脾脏和淋巴结淋巴细胞的分离、纯化与处理
2.1 小鼠淋巴细胞的收集 颈椎脱臼法处死各组供体(WT或者IRF8-/-)小鼠,无菌取脾、淋巴结,用200目筛网碾磨脾脏或者淋巴结,过滤后收集细胞悬液,红细胞裂解液裂解红细胞,300×g离心5 min,并用PBS清洗3次,进行细胞计数。
2.2 Naive CD4+T细胞的的分选 Naive CD4+T细胞(CD4+CD62L+CD44low)的分选采用荧光激活细胞流式细胞术分选,CD4+T细胞采用抗CD4磁珠(Miltenyi Biotec)和MACS分离柱进行纯化(纯度可大于95%),为了获得naive CD4+T细胞,上述获得的单个细胞悬液加入抗 B220-PE、抗 CD8α-PE、抗CD11b-PE、抗 CD11c-PE和抗 CD49b-PE,所有的单抗均为1∶100稀释,抗Ter119-PE采用1∶66稀释,冰上放置20 min,然后与抗PE磁珠(1∶20稀释)在冰上孵育 20 min,除去的部分加抗 CD4-PECy7、抗CD62L-FITC和抗CD44-APC,细胞分选在流式细胞仪(FACSVantage)上进行,获得的 CD4+CD62L+CD44lowT细胞,纯度>99%。
2.3 磁珠法分选WT和IRF8-/-小鼠CD4+CD25+Treg细胞 免疫磁珠分选仪(autoMACS Pro Separator)购自Miltenyi Biotec;具体按CD4+CD25+Treg细胞的分选试剂盒说明书进行操作。0.4%台盼蓝染色后检测细胞活性,流式细胞术检测细胞纯度>99%。
2.4 Naive CD4+T细胞的体外分化 将上述获得的naive CD4+T细胞进行体外分化培养,细胞加入96孔培养板中,加入抗CD3抗体(1 mg/L;BD Biosciences)和可溶性抗CD28(2 mg/L;BD Biosciences)激活48 h后,加入佛波酯(phorbol 12-myristate 13-acetate,PMA)和离子霉素重新刺激5 h,采用流式细胞术检测细胞内因子。细胞在中性条件(不加细胞因子刺激)下培养为Th0细胞;加入IL-12和抗IL-4(10 mg/L;BD Biosciences)向Th1极化;或者加入IL-4和抗 IFN-γ(10 mg/L;BD Biosciences)向 Th2极化;或者向Th17细胞极化:转化生长因子β1(transforming growth factor β1,TGF-β1;5 μg/L)、IL-6(20 μg/L)、IL-23(10 μg/L)(均购自 R&D systems)、抗IL-4(10 mg/L)和抗 IFN-γ (10 mg/L)。
3 流式细胞术检测
上述极化后的细胞,采用IC Fixation缓冲液(BD Biosciences)固定后,采用透膜缓冲液透膜,使用小鼠的抗体,PE-anti-IL-17、APC-anti-IL-4、APC-anti-IFN-γ和PE-Cy5.5-anti-CD4抗体进行细胞内染色,在FACSCalibur和 LSRFortessa(BD Biosciences)进行流式细胞术检测。
4 实验性肠炎模型的建立
按照文献[11-12]的方法进行T细胞转染的结肠炎模型的建立,简而言之,按照分选纯化 WT和IRF8-/-小鼠的naive CD4+CD45RBhiT细胞和IRF8-/-CD4+CD25+Treg细胞,使用1×PBS 200 μL、经过腹腔注射给RAG1-/-受体鼠(每组6只),注射的细胞数每只均为5×105。每周监测受体鼠的体重及临床表现,第5周后处死受体鼠,结肠组织在10%的甲醛缓冲液中固定、石蜡包埋,切成5 μm后苏木精伊红(HE)染色,按照评分标准[11]进行结肠病理评分,实验分组如下:(1)IRF8-/-对实验性肠炎的影响:根据供体鼠实验分为:WT组和IRF8-/-组;(2)IRF8-/-CD4+CD25+Treg细胞对实验性肠炎的抑制作用:按照注射细胞的来源分为WT-CD4+CD45RBhiT组;②WT-CD4+CD45RBhiT+WT Treg组;③WT-CD4+CD45RBhiT+IRF8-/-Treg组。
5 统计学处理
计量资料用均数±标准差(mean±SD),组间比较采用t检验、Mann-Whitney U检验或ANOVA。以P<0.05为差异有统计学意义。
结 果
1 IRF8对小鼠Th1、Th2和Th17分化的影响
小鼠naive CD4+T细胞在Th17极化条件下,IL-17+CD4+细胞比例在IRF8-/-小鼠显著高于WT小鼠(P<0.01),而在Th1和Th2极化条件下,Th1和Th2细胞比例在IRF8-/-和WT小鼠中无显著差异(P >0.05),见图1。
2 CD4+CD45RBhiT细胞转染实验性结肠炎模型
分别采用 WT或者 IRF8-/-小鼠的 CD4+CD45RBhiT细胞,经 RAG1-/-小鼠(n=6)腹腔注射,每周观察小鼠体重的变化,结果显示注射IRF8-/-小鼠CD4+CD45RBhiT细胞的RAG1-/-小鼠体重显著低于注射WT小鼠CD4+CD45RBhiT细胞的RAG1-/-小鼠(P<0.05),见图2;连续观察5周后,处死小鼠,注射IRF8-/-小鼠CD4+CD45RBhiT细胞的小鼠结肠病理评分显著高于WT组(P<0.05),见图3;肠系膜淋巴结中,IL-17+CD4+T细胞比例IRF8-/-组显著高于WT组(P<0.01),而Th1(IFN-γ+CD4+)和 Treg(Foxp3+CD4+)细胞比例无显著差异(P>0.05),见图4。
3 IRF8-/-CD4+CD25+Treg细胞对实验性肠炎的抑制作用
单独注射WT小鼠CD4+CD45RBhiT细胞后,与注射Treg细胞2组比较,体重明显下降(P<0.05),而无论同时注射IRF8-/-或者WT小鼠的Treg细胞,受体鼠体重均未明显下降,且两者之间无显著差异(P >0.05),见图5。

Figure 1.Naive CD4+T cells from IRF8-/-or WT mouse spleens were cultured under polarized conditions in vitro.Mean±SD.n=6.**P <0.01 vs WT.图1 小鼠脾脏naive CD4+T细胞体外极化培养

Figure 2.Changes of body weight of RAG1-/-mice after injected with WT or IRF8-/-CD4+CD45RBhiT cells.Mean±SD.n=6.*P<0.05 vs WT CD45RBhi.图2 RAG1-/-小鼠注射CD4+CD45RBhiT细胞后体重的变化
讨 论
近年来研究发现初始CD4+T细胞在不同细胞因子和转录因子的调控下,除分化出 Th1、Th2和Treg细胞之外,还分化出新型的辅助性T细胞,产生IL-17,即Th17细胞,其除在黏膜防护和病原菌清除中的作用外,在自身免疫性疾病中的作用也得到了较深入的认识[10]。其中Th17及IL-17和炎症性肠病[2-3]和异基因造血干细胞移植后并发的移植物抗宿主病[13-14]密切相关。RORγt是 Th17细胞分化的决定性转录因子,但是Th17细胞分化也受到一些正反馈和负反馈调节,如最近报道的IL-21、IL-23R、IL-10和IL-27调节反馈圈的调节[15-18],提示可能存在固有的基因程序激发和沉默Th17细胞的发育,多种转录因子包括RORγt、RORα、STAT3和IRF4与Th17细胞的分化密切相关[10,15],但是沉默 Th17发育的机制目前仍然未完全阐明。
在本研究中,我们阐明了IRF8作为内部沉默因子,阻止了初始CD4+T细胞向Th17细胞分化。我们采用了IRF8全基因敲除小鼠研究发现,IRF8基因缺失促进初始CD4+T细胞向Th17细胞分化,而对Th1和Th2细胞的分化无影响。我们进一步通过免疫介导小鼠炎症性肠病的模型研究IRF8对炎症性肠病的影响,发现转染IRF8-/-的 CD4+CD45RBhiT细胞给RAG1-/-小鼠较WT诱导出更为严重的结肠炎,在肠系膜淋巴结的T细胞重建中IRF8-/-的供体鼠较WT供体鼠显示出更高的Th17细胞比例,表明IRF8抑制Th17的免疫反应与减轻实验小鼠结肠炎的发生有关。
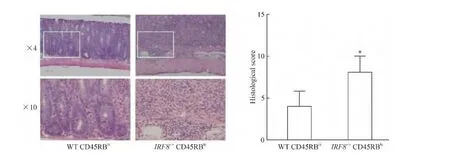
Figure 3.Colonic pathological changes in RAG1-/-mice after injected with WT or IRF8-/-CD4+CD45RBhiT cells.Mean±SD.n=6.*P<0.05 vs WT CD45RBhi.图3 RAG1-/-小鼠注射CD4+CD45RBhiT细胞后结肠病理变化
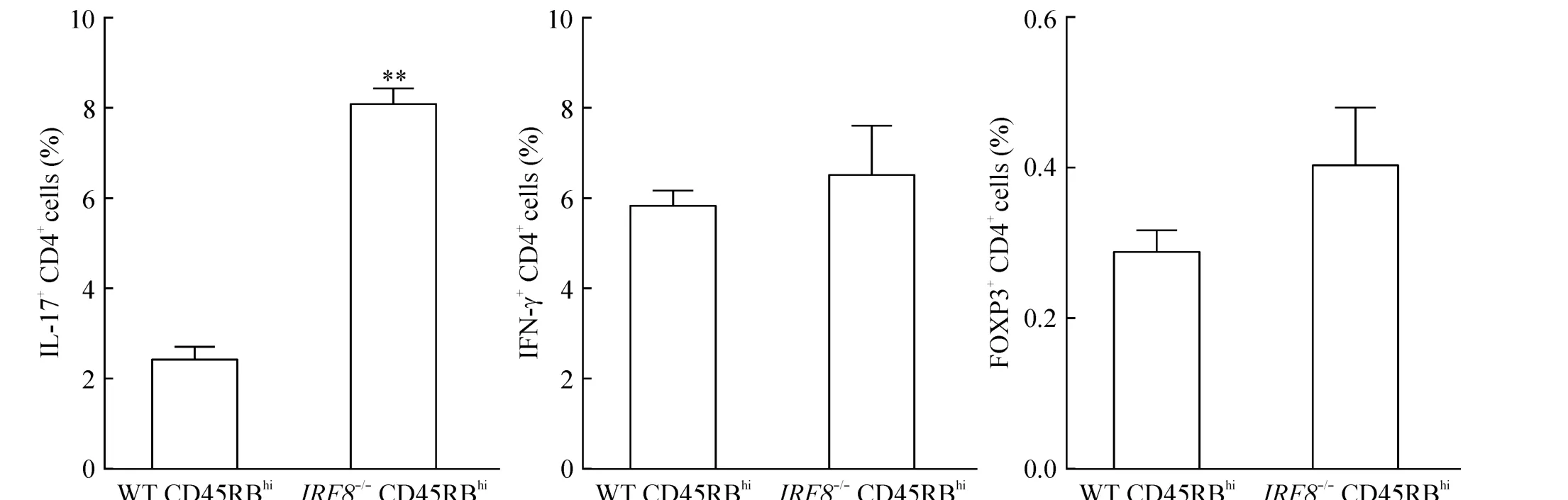
Figure 4.Percentages of T cell subtypes in RAG1-/-mouse mesenteric lymph nodes after injected with WT or IRF8-/-CD4+CD45RBhiT cells.Mean±SD.n=6.**P <0.01 vs WT CD45RBhi.图4 注射CD4+CD45RBhiT细胞后RAG1-/-小鼠肠系膜淋巴结中T细胞亚群比例

Figure 5.Immunosuppressive effect of IRF8-/-CD4+CD25+Treg cells on experimental colitis in mice.Mean±SD.n=6.*P<0.05 vs other groups.图5 IRF8-/-CD4+CD25+Treg对小鼠实验性肠炎的免疫抑制作用
最近在人IBD结肠标本的研究发现,IRF家族中IRF1、IRF5和IRF8表达无显著增加,而IRF4显著增加;在鼠的动物模型中,进一步证实IRF4与IL-17启动子结合,诱导IL-17产生,IL-17诱导表达IL-17R的细胞产生IL-6,促进T细胞RORγt表达,从而诱导炎症性肠病发生[19]。IRF8作为转录激活剂或者抑制剂依靠靶向DNA序列、并与PU.1或E47不同的伙伴蛋白以及IRF其它家族成员相互作用[6]。最近基因组扫描Meta分析显示IRF8为多发性硬化患者的易感基因,更加证明了IRF8在免疫调控的炎症性疾病中的作用[20]。
Tregs在维持机体免疫平衡中作用不可或缺,其不仅可避免IBD的发生,而且可以逆转已发生的肠炎[21]。如果体内 Tregs与 Th17之间失平衡或者Tregs缺乏,抗原的免疫刺激可导致结肠黏膜的炎性反应。动物实验表明,给T细胞缺陷的小鼠注入不含有Tregs的幼稚T细胞,可诱发其对肠道共生菌群的高反应性,导致严重的自身免疫性结肠炎;同时输入Tregs则可抑制这类炎症反应[22]。另有研究表明,剔除小鼠的Treg细胞会使其 T细胞介导的炎症性疾病(如肠炎)恶化[23]。本研究将WT小鼠CD4+CD45RBhiT细胞转染给RAG1-/-小鼠时分别同时转染WT或者IRF8-/-Treg,探讨IRF8-/-Treg对炎症性肠病的抑制作用,发现IRF8-/-Tregs发挥了正常的抑T细胞活性。
(致谢:本研究在美国纽约大学西奈山医学院熊华保副教授悉心指导和大力支持下完成,深表感谢!)
[1] Rietdijk ST,D′Haens GR.Recent developments in the treatment of inflammatory bowel disease[J].J Dig Dis,2013,14(6):282-287.
[2] Wedebye Schmidt EG,Larsen HL,Kristensen NN,et al.TH17 cell induction and effects of IL-17A and IL-17F blockade in experimental colitis[J].Inflamm Bowel Dis,2013,18(8):1567-1576.
[3] Hundorfean G,Neurath MF,Mudter J.Functional relevance of T helper 17(Th17)cells and the IL-17 cytokine family in inflammatory bowel disease[J].Inflamm Bowel Dis,2012,18(1):180-186.
[4] 周宏斌,陈志华,李 雯.Th17细胞及白细胞介素17A在慢性气道炎症性疾病中的作用[J].中国病理生理杂志,2012,28(3):560-564.
[5] 韩丽娜,张亚晶,杨庭树,等.自身免疫性心肌炎大鼠Th1、Th2、Th17亚群免疫反应状态[J].中国病理生理杂志,2010,26(10):2033.
[6] Tamura T,Yanai H,Savitsky D,et al.The IRF family of transcription factors in immunity and oncogenesis[J].Annu Rev Immunol,2008,26:535-584.
[7] Brüstle A,Heink S,Huber M,et al.The development of inflammatory TH-17 cells requires interferon-regulatory factor 4[J].Nat Immunol,2007,8(9):958-966.
[8] Weaver CT,Hatton RD,Mangan PR,et al.IL-17 family cytokines and the expanding diversity of effector T cell lineages[J].Annu Rev Immunol,2007,25:821-852.
[9] Park H,Li Z,Yang XO,et al.A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17[J].Nat Immunol,2005,6(11):1133-1141.
[10]Korn T,Bettelli E,Oukka M,et al.IL-17 and Th17 cells[J].Annu Rev Immunol,2009,27:485-517.
[11]Totsuka T,Kanai T,Nemoto Y,et al.IL-7 is essential for the development and the persistence of chronic colitis[J].J Immunol,2007,178(8):4737-4748.
[12]Powrie F,Leach MW,Mauze S,et al.Phenotypically distinct subsets of CD4+T cells induce or protect from chronic intestinal inflammation in C.B-17 scid mice[J].Int Immunol,1993,5(11):1461-1471.
[13] Teshima T,Maeda Y,Ozaki K.Regulatory T cells and IL-17-producing cells in graft-versus-host disease[J].Immunotherapy,2011,3(7):833-852.
[14]Yi T,Chen Y,Wang L,et al.Reciprocal differentiation and tissue-specific pathogenesis of Th1,Th2,and Th17 cells in graft-versus-host disease[J].Blood,2009,114(14):1301-1312.
[15] Ivano II,Mckenzie BS,Zhou L,et al.The orphan nuclear receptor RORγt directs the differentiation program of proinflammatory IL-17+helper cells[J].Cell,2006,126(6):1121-1133.
[16] Yang L,Anderson DE,Baecher-Allan C,et al.IL-21 and TGF-beta are required for differentiation of human Th17 cells[J].Nature,2008,454(7202):350-352.
[17]McGeachy MJ,Chen Y,Tato CM,et al.The interleukin-23 receptor is essential for the terminal differentiation of interleukin 17-producing effector T helper cells in vivo[J].Nat Immunol,2009,10(3):314-324.
[18] Stumhofer JS,Laurence A,Wilson EH,et al.Interleukin-27 negative regulates the development of interleukin 17-producing T helper cells during chronic inflammation of the central nervous system[J].Nat Immunol,2006,7(9):937-945.
[19] Mudter J,Yu J,Zufferey C,et al.IRF4 regulates IL-17A promoter activity and controls RORγt-dependent Th17 colitis in vivo[J].Inflamm Bowel Dis,2011,17(6):1343-1358.
[20] De Jager PL,Jia X,Wang J,et al.Meta-analysis of genome scans and replication identify CD6,IRF8 and TNFRSF1A as new multiple sclerosis susceptibility loci[J].Nat Genet,2009,41(7):776-782.
[21] Fahlen L,Read S,Gorelik L,et al.T cells that cannot respond to TGF-beta escape control by CD4+CD25+regulatory T cells[J].J Exp Med,2005,201(5):737-746.
[22] O′Garra A,Vieira P.Regulatory T cells and mechanisms of immune system control[J].Nat Med,2004,10(8):801-805.
[23] Veltkamp C,Ruhwald R,Giesem T,et al.CD4+CD25+cell depletion from the normal CD4+T cell pool prevents tolerance toward the intestinal flora and leads to chronic colitis in immuno-deficient mice[J].Inflamm Bowel Dis,2006,12(6):437-446.

