DENV2感染外周血单个核细胞增加TNF-α基因启动子区域CpG位点的甲基化水平*
张英可, 张 林, 齐一鸣, 黄俊琪
(中山大学中山医学院免疫学研究所,教育部热带病防治研究重点实验室,广东广州510080)
登革病毒(dengue virus,DENV)是一种重要的蚊媒病毒,能够引起登革热(dengue fever,DF)和重症登革热即登革出血热(dengue hemorrhagic fever,DHF)和登革休克综合征(dengue shock syndrome,DSS),重症登革热死亡率极高。最新文献报道每年登革病毒感染人数约有39 000万人[1]。Jaiyen等[2]指出DENV引起外周血单个核细胞(peripheral blood mononuclear cells,PBMC)凋亡,原因不仅在于病毒本身的毒性作用,也与产生的促炎因子肿瘤坏死因子 α(tumour necrosis factor-alpha,TNF-α)和白细胞介素1β(interleukin-1beta,IL-1β)有关。本课题组之前对细胞因子的研究发现,2型登革病毒(dengue virus type 2,DENV2)感染 PBMC 0 h、6 h 和 12 h,随时间增加TNF-α 的产生减少[3]。
DNA甲基化作为表观遗传学的重要组成部分之一,能够通过影响转录因子的结合和染色体的结构引起基因表达抑制[4]。在脊椎动物中,DNA甲基化多发生在含高密度CpG双核苷酸结构的CpG岛区,但是TNF-α启动子区不存在典型CpG岛结构,仅有散在的CpG双核苷酸[5]。TNF-α的表达调控受多种因素的影响,DNA甲基化修饰在这个过程中起重要作用。本研究通过在PBMC感染病毒后不同时间检测TNF-α基因启动子区域的甲基化水平,探讨甲基化水平对该基因表达调控的影响。
材料和方法
1 材料
登革病毒2型 New Guinea C株(DENV2,NGC株)来自中山大学中山医学院微生物学教研室,由本实验室进行扩增和保存。健康人外周血由广州市血液中心提供。RPMI-1640培养基和胎牛血清均购自Gibco。EpiTect Plus DNA Bisulfite Kit购自 Qiagen。凝胶纯化试剂盒购自Thermo。
2 方法
2.1 细胞分离培养 Ficoll Hypaque密度梯度离心法分离PBMC,10%胎牛血清及1%青、链霉素双抗的RPMI-1640培养基,37℃、5%CO2条件下培养。
2.2 登革病毒感染 DENV2进行扩增定量,病毒滴度为1×107pfu/L,以感染复数(multiplicity of infection,MOI)为1处理细胞,病毒吸附2 h后弃上清,加入含4%胎牛血清的培养基,于37℃、5%CO2条件下孵育6 h或12 h。
2.3 DNA甲基化转化处理 取登革病毒感染0 h、6 h和12 h的细胞,分别提取DNA,使用EpiTect Plus DNA Bisulfite Kit对各组DNA进行甲基化转化。
2.4 PCR扩增 对各组甲基化转化后的DNA进行扩增,设计亚硫酸氢盐测序PCR甲基化检测引物,正义链 5′-AGGGTTTTATATATAAATTAGTTAGTGGTTTAGAAGA-3′,反义链:5′-TATAATTACTTCTCTCCCTCTTAACTAATCCTC-3′,扩增产物大小为 353 bp(-294 bp~+58 bp)。PCR反应后取3 μL PCR产物进行2%琼脂糖凝胶电泳分析。对凝胶电泳后的各组DNA片段进行纯化回收。
2.5 连接 目的片段 DNA 2 μL(约 150 ng),PMD19-T 载体(TaKaRa)1 μL(约50 ng),T4 快速连接酶 1 μL,10× Buffer用灭菌去离子水补足10 μL,22℃连接10 min。
2.6 转化 取连接产物加到50 μL T1感受态细胞中,混匀,冰浴30 min;将上述转化液置于42℃水浴30 s,取出后立即置于冰浴中放置2~3 min;向其中加入900 μL 37℃预热的LB培养基(不含抗生素),150 r/min、37℃振荡培养45 min;2 500 r/min离心5 min,将上清液吸走,留 100 μL混匀菌液,加到含AMP抗生素LB固体琼脂培养基上(抗生素终浓度50 mg/L),用无菌的弯头玻棒轻轻将细胞均匀涂开;待平板表面干燥后,倒置平板,37℃培养12~16 h。
2.7 基因测序 挑取上述平板上的单菌落,每组挑选5个克隆送中美泰和生物技术(北京)有限公司测序。
3 统计学处理
甲基化率以每组扩增序列发生甲基化的位点数占总甲基化位点数的百分率表示。各组间甲基化率差异的比较采用 χ2检验。以P<0.05为差异有统计学意义。
结 果
1 扩增序列
通过在线工具(http://www.urogene.org/methprimer/index1.html)预测甲基化位点,人工设计检测引物。如图1所示,箭头所指为转录起始位点(transcriptional start site,TSS),扩增序列为(-294 bp~+58 bp),覆盖11个甲基化位点。
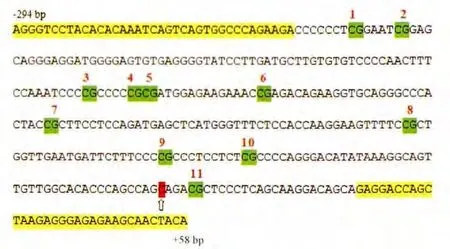
Figure 1.The sequence of PCR product.The sequence was from-294 bp to+58 bp,including eleven CpG sites.The arrow indicated the transcriptional start site(TSS).图1 扩增序列
2 琼脂糖凝胶电泳鉴定各样本扩增产物
PCR反应结束后取各样本3 μL PCR产物进行2%琼脂糖凝胶电泳分析,结果显示扩增产物的大小与理论相符合,见图2。
3 硫化修饰后的TNF-α基因启动子区域部分互补序列的测序结果
挑取上述平板上的单菌落,每组挑选5个克隆送测序公司测序。序列中未甲基化的C脱氨基变成U,而甲基化的C保持不变,见图3。
4 TNF-α基因启动子区域甲基化水平变化
基因测序结果显示,TNF-α基因启动子区域-294 bp到+58 bp区域内,11个甲基化位点中,DENV2感染PBMC 0 h和6 h有2个位点发生甲基化,感染12 h有6个甲基化位点发生甲基化,甲基化水平呈增高趋势,见图4。
感染0 h、6 h和12 h平均甲基化率分别为10.3%、12.1%和25.5%。0 h与12 h及6 h与12 h之间的甲基化率差异有统计学意义(P<0.05)。

Figure 2.Identification of PCR product of each sample by agarose gel electrophoresis analysis.The size of PCR product was 353 bp,from-294 bp to+58 bp.The PCR products were consistent with the theoretical size.M:DL2000 DNA marker;1~9:PCR products of the samples.图2 琼脂糖凝胶电泳鉴定各样本扩增产物

Figure 3.Partial result of complementary sequence of bisulfite-converted TNF-α promoter region.Me-thylated loci were G and unmethylated loci were A in the complementary sequence because methylated C remained unchanged and unmethylated C turned into U,which was combined with A.图3 硫化修饰的TNF-α启动子区域部分互补序列测序结果

Figure 4.The changes of DNA methy-lation at CpG sites in the promoter region of TNF-α gene.The first and second sites were methylated at 0 h and 6 h,and the first,second,third,seventh,ninth and eleventh sites were methylated at 12 h.●:≥80%methylation at a given site in the sequencing of five individual clones;■○:between 20%and 80%methylation at a given site;○:≤20%methylation at a given site.图4 TNF-α基因启动子区域甲基化水平
讨 论
目前登革热的发病机制尚未完全明确,细胞因子风暴为重症登革热发病机制的相关假说之一[6],登革病毒感染后多种细胞因子的水平会受到影响。Bozza等[7]的研究证实在重症登革热患者中IL-1、IL-4、IL-6、IL-13、IL-7 和 IFN-γ 等明显增高,IL-1β、IL-8和TNF-α与血小板的减少有明显的相关性。Wati等[8]发现TNF-α能够通过多种机制诱导登革病毒感染的细胞发生凋亡。Jaiyen等[2]提出 DENV引起PBMC凋亡,除了病毒本身的毒性作用,也与产生的促炎因子TNF-α和IL-1β有关;他们还发现DHF患者TNF-α显著高于DF患者,提示TNF-α在重症登革病毒感染中起重要作用。TNF-α基因属于早反应基因范畴,TNF-α蛋白呈现快速产生、早期分泌、快速下降的规律。有研究证实LPS刺激THP-1细胞TNF-α分泌在4 h达峰之后下降[9]。本课题组之前的研究发现正常人PBMC被DENV2感染0 h、6 h和12 h,随时间增加 TNF-α 的产生减少[3]。这似乎提示了病毒初次感染与重症感染的不同,可能是机体在初次病毒感染早期对自身的一种保护机制,避免重症登革热的发生。
TNF-α的表达调控受多种因素的影响,DNA甲基化修饰在这个过程中起重要作用。本研究采用亚硫酸氢盐测序PCR法检测TNF-α基因启动子区的甲基化状态,我们的结果表明病毒感染12 h TNF-α启动子区域11个位点发生甲基化的水平明显增加,感染6 h与0 h相比甲基化水平相当。我们之前的报道[3],DENV2 感染 PBMC 0 h、6 h 和 12 h,随时间增加TNF-α的产生减少。这种不同可能是由多因素共同调控 TNF-α的表达引起的。郭尧等[5]发现THP-1细胞在LPS刺激之前TNF-α启动子区域的CpG双核苷酸均处于甲基化状态,而本实验中PBMC在病毒感染0 h时就出现多个位点的去甲基化,这可能是细胞种类差异导致的不同。
本研究证明了PBMC在DENV2感染早期存在TNF-α基因甲基化水平的改变。甲基化能够调控蛋白的表达,且TNF-α蛋白水平与登革热病情的严重程度相关,这可能为治疗或缓解登革病毒感染提供新的思路。
[1] Bhatt S,Gething PW,Brady OJ,et al.The global distribution and burden of dengue[J].Nature,2013,496(7446):504-507.
[2] Jaiyen Y,Masrinoul P,Kalayanarooj S,et al.Characteristics of dengue virus-infected peripheral blood mononuclear cell death that correlates with the severity of illness[J].Microbiol Immunol,2009,53(8):442-450.
[3] Qi Y,Li Y,Zhang L,et al.MicroRNA expression profiling and bioinformatic analysis of dengue virus-infected peripheral blood mononuclear cells[J].Mol Med Rep,2013,7(3):791-798.
[4] Bergman Y,Cedar H.DNA methylation dynamics in health and disease[J].Nat Struct Mol Biol,2013,20(3):274-281.
[5] 郭 尧,杨智勇,王春友.启动子区域甲基化状态对THP-1细胞肿瘤坏死因子α分泌的影响[J].中国病理生理杂志,2011,27(6):1206-1209.
[6] 黄俊琪.登革热发病机制的研究进展[J].实用医学杂志,2011,27(19):3464-3465.
[7] Bozza FA,Cruz OG,Zagne SM,et al.Multiplex cytokine profile from dengue patients:MIP-1β and IFN-γ as predictive factors for severity[J].BMC Infect Dis,2008,8:86.
[8] Wati S,Rawlinson SM,Ivanov RA,et al.Tumour necrosis factor alpha(TNF-α)stimulation of cells with established dengue virus type 2 infection induces cell death that is accompanied by a reduced ability of TNF-α to activate nuclear factor κB and reduced sphingosine kinase-1 activity[J].J Gen Virol,2011,92(Pt 4):807-818.
[9] 郭 尧.启动子区域甲基化状态与炎症细胞TNF-α分泌关系及调控因素的研究[D].武汉:华中科技大学,2011.

