促红细胞生成素通过调节未折叠蛋白反应减轻顺铂所致的肾小管上皮细胞凋亡*
孔德阳, 黄智勇, 唐 杰, 郝建兵
抗肿瘤药物顺铂(cisplatin,CP)是导致药物性急性肾损伤(acute kidney injury,AKI)的主要原因之一,其病理生理机制中以CP诱导的肾小管上皮细胞凋亡作用较为明显。CP诱导肾小管上皮细胞凋亡作用的靶点独立于DNA损伤诱导的凋亡信号,通过内质网应激(endoplasmic reticulum stress,ERS)时激活的凋亡信号途径发挥作用[1-2]。ERS激活多种信号途径,以维持细胞内环境稳定和生存,称为未折叠蛋白反应 (unfolded protein response,UPR)[3]。在ERS情况下,未折叠蛋白反应处于活化状态,ERS分子葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)作为未折叠蛋白反应网络的中心调解蛋白在其中可能起关键作用。
重组人促红细胞生成素(recombinant human erythropoietin,rHuEPO)自1986年应用临床后,在缺血-再灌注损伤或顺铂诱导的AKI模型中,已被证实可以促进肾小管上皮细胞再生,加速肾脏功能恢复[4-5]。研究证实,肾小管上皮细胞表面、毛细血管内皮细胞的管腔表面有EPO受体(erythropoietin receptor,EPOR)表达,EPO与EPOR结合后影响细胞内的信号转导途径;其中,EPO对肾小管上皮细胞、肾小球毛细血管内皮细胞的保护效应主要通过EPO抗凋亡机制介导[6]。目前,尚无研究表明rHuEPO对顺铂肾脏毒性的保护作用与调节ERS时未折叠蛋白反应的网络中心蛋白GRP78、减轻肾小管上皮细胞凋亡相关。为了探讨rHuEPO发挥CP肾毒性保护作用的分子机制,鉴别保护AKI潜在的治疗靶点,本研究利用CP诱导的AKI模型进行了如下研究。
材料和方法
1 动物
SPF级Sprague-Dawley(SD)大鼠,雄性,6~8周龄,200~250 g,由哈尔滨医科大学实验动物中心提供。
2 主要试剂
rHuEPO由华北制药金坦生物技术股份有限公司提供,规格3 000 U/支,河北石家庄;顺铂,规格10 mg/支,山东齐鲁制药;TUNEL染色试剂盒 (Dead-EndTMColorimetric TUNEL System;Promega);兔抗EPOR及GRP-78多克隆抗体(Novus Biologicals);小鼠β-actin单克隆抗体(Sigma);辣根过氧化物酶标记的山羊抗兔IgG及山羊抗小鼠IgG(碧云天公司)。
3 主要方法
3.1 SD大鼠分组 36只SPF级健康SD雄性大鼠,随机分为3组:正常对照组(control组)12只:单纯腹腔注射 0.9% 生理盐水(0.9%saline,5 mL·kg-1);顺铂模型组(CP组)12只:单纯腹腔注射顺铂(10 mg·kg-1,0.9% 生理盐水溶解顺铂 2 g·L-1);顺铂 +rHuEPO组(CP+rHuEPO组)12只:rHuEPO(5 000 U·kg-1)于顺铂注射前48 h,顺铂注射前15 min及顺铂注射后48 h尾静脉注射给药。
3.2 肾脏组织标本的处理 将3组SD大鼠均CP或0.9%生理盐水注射后96 h,用2%戊巴比妥钠(40 mg·kg-1)腹腔注射麻醉大鼠,仰卧位固定于鼠台上,腹正中切口3 cm,暴露腹腔,直视下找到双肾,分别分离肾周围脂肪囊和肾筋膜后,用动脉夹夹闭肾脏动静脉,切除整个肾,放入预先准备好的0.9%的冷生理盐水冲洗后,将一部分肾组织离体后分成小块迅速放入液氮,一部分应用OCT包埋剂包埋后置于液氮中,并置于-80℃冰箱中保存,用Western blotting检测蛋白质表达及激光共聚焦检测;一部分肾组织置于10%甲醛溶液中固定48 h,用于病理检查。
3.3 血清标本的留取 SD大鼠处死时采用腹主动脉穿刺取血,每只约5 mL,取血后1 mL装入血常规采血管(EDTA抗凝管),立即送检;4 mL装入促凝管,室温下静置4 h后,4℃ 3 000 r·min-1离心15 min后分离血清,-20℃冰箱保存备用。
3.4 生化分析 检测血尿素氮(blood urea nitrogen,BUN)和血清肌酐(serum creatinine,SCr)水平,采用日立7150型全自动生化分析仪测定。
3.5 肾脏组织病理学观察 PAS染色观察肾脏组织病理改变:将肾组织标本用10%福尔马林溶液固定48 h,常规脱水、石蜡包埋;2 μm切片,常规脱蜡,1%过碘酸氧化,入Schiff氏液,苏木素染细胞核后1%盐酸乙醇分化,氨水返蓝;镜下观察细胞核成蓝色,基底膜染成粉红色;梯度乙醇脱水、二甲苯透明、树胶封片;光镜下观察肾脏病理改变。
3.6 TUNEL法检测细胞凋亡 肾组织用10%福尔马林固定过夜,脱水、透明、石蜡包埋,切片厚2 μm,置于包被有多聚赖氨酸的载玻片上。TUNEL染色按试剂盒说明书操作。计数每个视野中TUNEL阳性细胞数及细胞总数。每张切片随机取6~8个不重叠视野,每个肾脏观察2~3张切片。每个肾脏的细胞凋亡程度以TUNEL阳性细胞数占细胞总数的百分比表示。
3.7 免疫印迹法(Western blotting法) RIPA细胞裂解液预冷后30~200 μL加入装有组织的1.5 mL EP管中,超声破碎仪破碎4~6 s,至组织溶解,冰浴30 min,4 ℃、12 000 r·min-1离心 30 min,取上清(即蛋白),-80℃保存。(1)BCA法蛋白浓度测定(参照说明书,Pierce);(2)蛋白变性:用2×SDS加样缓冲液与蛋白样品等体积混合,蛋白变性,100℃,5 min→冰浴10 min,-20℃保存(获得均一浓度的蛋白质),以备电泳用;(3)SDS-PAGE(聚丙烯酰胺)凝胶电泳分离蛋白,转膜,丽春红染色,将膜去离子水冲洗后,放入封闭袋中加入封闭液,封闭约4 h;(4)加入EPOR和GRP78(1∶500)Ⅰ抗,4℃过夜;(5)显色;以 β-actin作为内参照,用Image J凝胶图像分析软件进行半定量分析。
3.8 免疫荧光分析 采用OCT包埋剂包埋组织块用于免疫荧光染色。4 μm切片置于多聚赖氨酸防脱片的载玻片;PBS清洗5 min×3次;1%牛血清白蛋白室温封闭30 min;肾脏组织切片Ⅰ抗(GRP78多克隆抗体,1∶25)4℃孵育过夜;PBS清洗10 min×3;组织切片FITC偶联Ⅱ抗(1∶100)室温避光孵育1 h;PBS清洗10 min×3次;含DAPI防淬灭剂封片;激光共聚焦显微镜观察,放大倍数×400。
3.9 免疫组化分析 石蜡包埋肾脏组织2 μm切片,行免疫组化染色,方法如下:二甲苯脱蜡;保湿盒内3%H2O2浸30 min,PBS洗涤5 min×2次;将切片浸于枸橼酸钾溶液中,微波至微沸腾;室温放置30 min冷却后用血清封闭抗原30 min;滴加1∶500稀释的EPOR抗体,4℃条件下过夜;第2天取出保湿盒,室温放置30 min,PBS洗涤5min×3次;滴加生物素标记的Ⅱ抗,室温放置50 min,PBS洗涤5 min×3次;滴加 Vectastain® R.T.U.ABC Reagent,室温放置30 min,PBS洗涤5 min×3次;光镜下DAB显色1~10 min;自来水冲洗,PBS浸5 min;苏木素染液复染,PBS冲洗返蓝;乙醇梯度脱水;树胶封片;高倍镜下观察(×400)。
4 统计学处理
用SPSS 13.0统计软件分析。数据用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(ANOVA),以P<0.05为差异有统计学意义。
结 果
1 rHuEPO治疗可以降低顺铂诱导AKI SD大鼠的BUN和SCr水平并减轻肾小管损伤
1.1 血清肾功能分析结果 与control组比较,顺铂注射96 h,CP组SCr和 BUN水平明显升高(P<0.05),注射rHuEPO可以显著减低SD大鼠的SCr水平(P <0.05),见图1A。
1.2 肾脏病理结果 顺铂注射96 h,近端肾小管刷状缘脱落,管型堵塞肾小管,肾小管基底膜裸露。提前注射rHuEPO可减少顺铂注射后96 h肾脏中坏死肾小管数量,促进肾小管修复,见图1B。
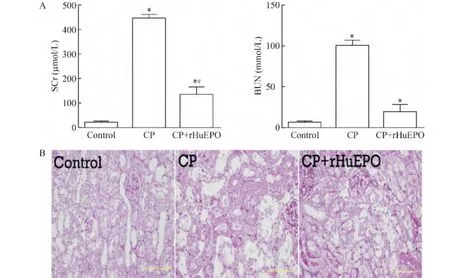
Figure 1.The levels of SCr and BUN(A)and morphological changes of rat renal tissue(B)in each group(PAS staining,×400).Mean ±SD.n=12.*P <0.05 vs control group;#P <0.05 vs CP group.图1 各组SCr水平、BUN水平及肾脏病理改变
2r HuEPO治疗恢复了EPOR水平
2.1 免疫组化结果 在顺铂或生理盐水经腹腔注射入大鼠体内后96 h,与control组相比,CP组及CP+rHuEPO组EPOR蛋白表达明显增加;与CP组相比,CP+rHuEPO组EPOR蛋白表达明显减少,见图2A。
2.2 Western blotting结果 与control组比较,CP组及CP+rHuEPO组EPOR蛋白质表达明显上调,差异显著(P<0.05)。与CP组比较,CP+rHuEPO组EPOR蛋白质表达明显下调,差异显著(P<0.05),见图2B。
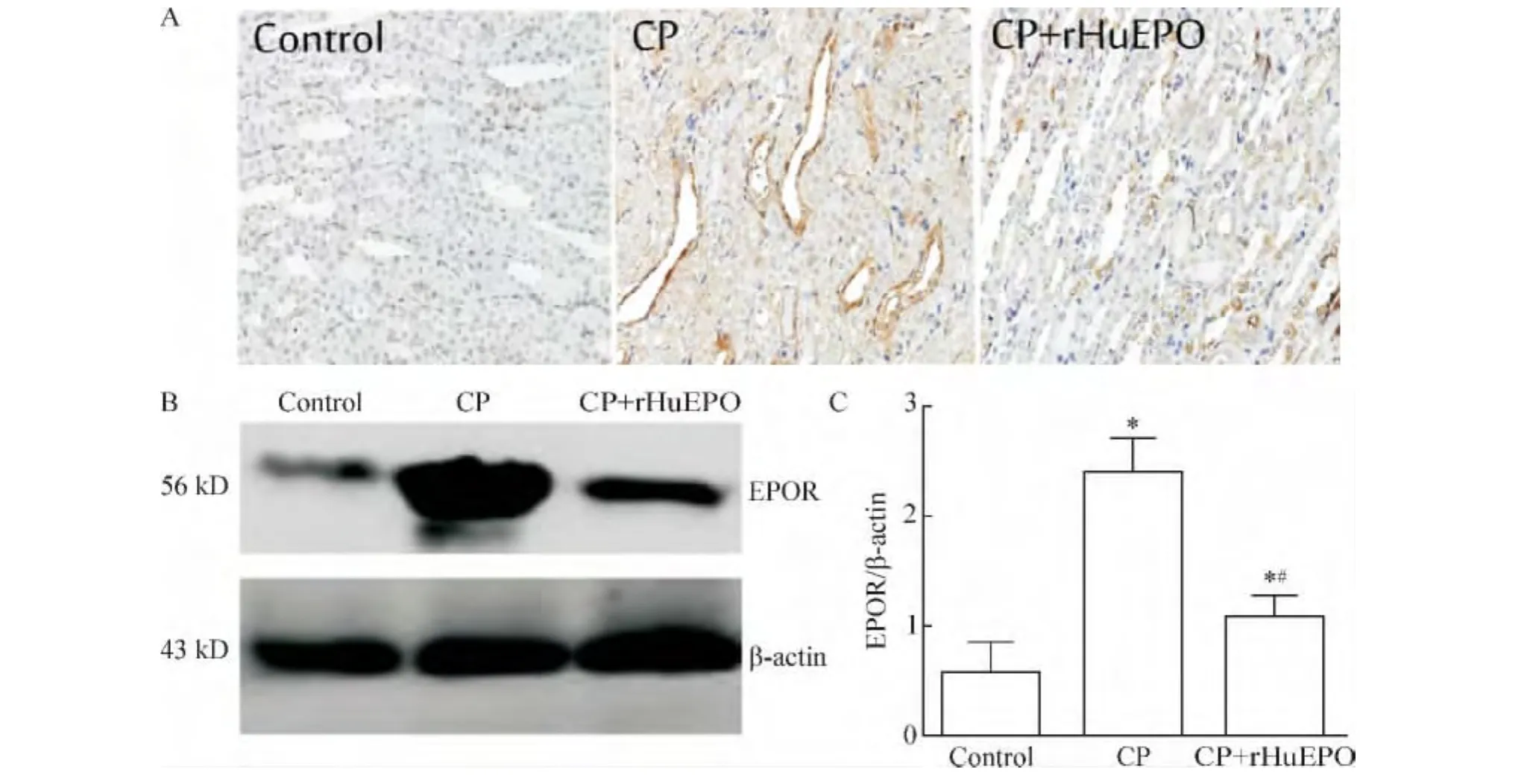
Figure 2.The expression of EPOR in each group detected by immunohistochemistry(A,×400)and Western blotting(B).Mean±SD.n=12.*P <0.05 vs control group;#P <0.05 vs CP group.图2 免疫组化法及Western blotting法检测各组EPOR蛋白表达
3 rHuEPO治疗可以减轻顺铂诱导的AKI SD大鼠肾小管上皮细胞的凋亡
应用TUNLE染色检测细胞凋亡,细胞核被染成棕褐色为TUNEL阳性细胞,即凋亡细胞。CP组见TUNEL阳性细胞大部分位于肾脏皮髓交界处的肾小管管壁和管腔内;control组几乎未见TUNEL阳性细胞;CP+rHuEPO组可见少量TUNEL阳性细胞。经肾小管凋亡评分,可见CP组和CP+rHuEPO组凋亡程度显著高于control组,差异显著(P<0.05);CP+rHuEPO组与CP组比较凋亡指数低于CP组,差异有统计学意义(P<0.05),见图3。

Figure 3.TUNEL-staining of renal tubular epithelium cell apoptosis in each group(×400).Mean±SD.n=12.*P <0.05 vs Control group;#P <0.05 vs CP group.图3 TUNEL检测各组肾脏小管上皮细胞凋亡状况
4 rHuEPO治疗减轻了顺铂诱导的AKI SD大鼠肾脏组织的未折叠蛋白反应
4.1 激光共聚焦结果 在CP或生理盐水经腹腔注射入大鼠体内后96 h,与control组相比,CP组及rHuEPO组GRP78(RFP标记,红色)蛋白表达明显增加;与CP组相比较,GRP78蛋白表达明显减少,见图4A。
4.2 Western blotting结果 与control组比较,CP组及CP+rHuEPO组GRP78蛋白质表达明显上调,差异显著(P<0.05);与CP组比较,CP+rHuEPO组GRP78蛋白质表达水平明显下调,差异显著(P<0.05),见图 4B。

Figure 4.rHuEPO attenuated CP-induced UPR in renal tubular epithelium cells.A:the expression level of GRP78 protein detected by immunofluorescence and observed by laser confocal microscopy(×400);B:Western blotting of GRP78.Mean±SD.n=12.*P <0.05 vs control group;#P <0.05 vs CP group.图4 rHuEPO治疗减轻了顺铂诱导的肾小管上皮细胞未折叠蛋白反应
讨 论
本研究证实在实验条件下10 mg/kg CP处理SD大鼠96 h后,与正常对照组相比,肾小管上皮细胞数减少,坏死细胞数增多及肾小管上皮细胞凋亡指数增高。与既往报道一致,这提示细胞凋亡在CP诱导的肾小管上皮小损伤中发挥着重要作用[7]。由于顺铂在体内肾脏的浓度显著高于肝脏、脾脏等器官,尤其是近端小管S3段,因而能够引起肾小管中毒性损害而诱导AKI。病理生理学研究提示顺铂可激活肾小管上皮细胞内一系列复杂信号通路,导致小管上皮细胞损伤和死亡[8];刺激肾脏实质细胞分泌IL-1β和TNF-α介导炎症损伤[9];介导肾脏血管损伤,并导致肾脏血流量减少和缺血损伤,使肾小球滤过率进一步下降[10]。其中,以顺铂诱导肾小管上皮细胞凋亡作用较为明显[11],因而将抗凋亡作为早期治疗靶点,深入研究CP诱导AKI时肾小管上皮细胞凋亡机制是重要研究领域。
rHuEPO是利用基因重组技术人工合成的促红细胞生成素。已有研究报道,rHuEPO能够改善CP诱导的AKI恢复。对肾脏的保护可能通过表达在人或鼠肾脏皮质、髓质、乳突及近端小管细胞系的EPOR发挥作用。EPOR属于细胞因子受体超家族成员,缺乏酪氨酸激酶活性。EPOR在肾脏不同类型的细胞均有表达,包括小管上皮细胞、肾小球系膜细胞及内皮细胞。Wen等[12]研究发现在脑缺血再灌注损伤过程中EPO-EPOR系统具有内源性保护作用,在脑缺血再灌注区域神经细胞上调EPOR和增加分泌EPO,并且EPOR上调要早于增加分泌EPO。本研究发现,EPOR在正常SD大鼠的肾脏广泛表达,经CP处理的大鼠EPOR发挥内源性保护作用表达增加,EPO治疗后可以短时期内增加血清中EPO水平,rHuEPO与肾脏部位的EPOR结合,同时,血清中EPO的快速增高可能抑制组织中EPOR及EPO mRNA表达,使肾脏组织EPOR表达量下降(图2)。
最近研究表明,通过ERS诱导的凋亡在缺血再灌注及药物肾毒性包括抗生素、免疫抑制剂、化疗药物等模型的病理生理机制中发挥重要作用[9]。内质网功能紊乱能够引起ERS,导致错误蛋白在内质网腔蓄积,过度或持续的ERS将会启动细胞的凋亡程序[13]。病理情况下内质网腔内蛋白折叠受抑制,活化多种信号通路进而未折叠蛋白反应被活化。GRP78属于热休克蛋白家族的成员,是ERS诱导未折叠蛋白反应网络的主要调节者。未折叠蛋白反应可使GRP78大量表达,并与内质网中错误折叠和未折叠蛋白结合,恢复蛋白质构象,稳定内环境,因此,GRP78在应激条件下对细胞起保护作用。我们的研究结果显示,CP组肾小管上皮细胞GRP78表达上调(图4),提示顺铂诱导的肾损伤启动了未折叠蛋白反应,GRP78显著上调以发挥内质网的自身稳定功能,尽管如此,肾小管上皮细胞仍发生凋亡可能是由于持续的未折叠蛋白反应激活了特异性的CHOP及caspase-12介导的凋亡通路。
许多研究报道EPO参与不同模型促进细胞生存信号,如 JAK/STAT、PKC 及 PI3K/Akt信号通路[14]。研究表明,保护细胞免于 ERS引起的凋亡需要PI3K/Akt通路活化;因此,ERS诱导的PI3K/Akt通路的活化是细胞生存信号[15]。我们的研究发现,应用rHuEPO预治疗CP处理的大鼠,能够明显降低CP诱导的未折叠蛋白反应,进而减轻CP所致的肾小管上皮细胞凋亡。然而,ERS期间是否有前生存通路Akt的活化,PI3K/Akt通路是否介导了外源性EPO减轻未折叠蛋白反应而发挥了抑制肾小管上皮细胞凋亡的作用,进一步的研究仍然是必要的。
[1] Kharbanda S,Ren R,Pandey P,et al.Activation of the c-Abl tyrosine kinase in the stress response to DNA-damaging agents[J].Nature,1995,376(6543):785-788.
[2] Leibbrandt ME,Wolfgang GH,Metz AL,et al.Critical subcellular targets of cisplatin and related platinum analogs in rat renal proximal tubule cells[J].Kidney Int,1995,48(3):761-770.
[3] Prachasilchai W,Sonoda H,Yokota-Ikeda N,et al.A protective role of unfolded protein response in mouse ischemic acute kidney injury[J].Eur J Pharmacol,2008,592(1-3):138-145.
[4] Spandou E,Tsouchnikas I,Karkavelas G,et al.Erythropoietin attenuates renal injury in experimental acute renal failure ischaemic/reperfusion model[J].Nephrol Dial Transplant,2006,21(2):330-336.
[5] Bagnis C,Beaufils H,Jacquiaud C,et al.Erythropoietin enhances recovery after cisplatin-induced acute renal failure in the rat[J].Nephrol Dial Transplant,2001,16(5):932-938.
[6] 黎磊石,刘志红,谢红浪,等.中国肾脏病学[M].第1版.北京:人民军医出版社,2008:1917-1923.
[7] Salahudeen AK,Haider N,Jenkins J,et al.Antiapoptotic properties of erythropoiesis-stimulating proteins in models of cisplatin-induced acute kidney injury[J].Am J Physiol Renal Physiol,2008,294(6):F1354-F1365.
[8] Liu H,Baliga R.Endoplasmic reticulum stress-associated caspase 12 mediates cisplatin-induced LLC-PK1 cell apoptosis[J].J Am Soc Nephrol,2005,16(7):1985-1992.
[9] Ramesh G,Reeves WB.TNF-alpha mediates chemokine and cytokine expression and renal injury in cisplatin nephrotoxicity[J].J Clin Invest,2002,110(6):835-842.
[10] Pabla N,Dong Z.Cisplatin nephrotoxicity:mechanisms and renoprotective strategies[J].Kidney Int,2008,73(9):994-1007.
[11]王 骏,黄先锋,余学清.骨髓间充质干细胞共培养减轻顺铂所致的肾小管上皮细胞损伤[J].中国病理生理杂志,2008,24(7):1378-1383.
[12] Wen TC,Rogido M,Genetta T,et al.Permanent focal cerebral ischemia activates erythropoietin receptor in the neonatal rat brain[J].Neurosci Lett,2004,355(3):165-168.
[13] Song S,Chew C,Dale BM,et al.A requirement for the p85 PI3K adapter protein BCAP in the protection of macrophages from apoptosis induced by endoplasmic reticulum stress[J].J Immunol,2011,187(2):619-625.
[14] Ma R,Xiong N,Huang C,et al.Erythropoietin protects PC12 cells from β-amyloid25-35-induced apoptosis via PI3K/Akt signaling pathway[J].Neuropharmacology,2009,56(6-7):1027-1034.
[15] Mao W,Iwai C,Liu J,et al.Darbepoetin alfa exerts a cardioprotective effect in autoimmune cardiomyopathy via reduction of ER stress and activation of the PI3K/Akt and STAT3 pathways[J].J Mol Cell Cardiol,2008,45(2):250-260.

