辣椒素抑制大鼠肝纤维化的实验研究*
俞富祥, 朱千东, 余正平, 张启瑜
(温州医科大学附属第一医院肝胆胰外科,浙江温州325000)
肝纤维化是各类慢性肝病共同的病理学基础。其中25%~40%最终发展为肝硬化甚至肝癌,是一类世界性的严重危害人们健康的主要疾病。肝星状细胞(hepatic stellate cells,HSCs)的活化与增殖是肝纤维化发生发展的中心环节。HSCs增殖激活后可分泌大量细胞外基质,引起胶原纤维沉积导致纤维化。阻止HSCs的增殖活化有可能阻断肝纤维化和肝硬化的进程[1-3]。辣椒素是辣椒中的主要辛辣成分,近年来的研究成果显示其具有止痛、降脂减肥及抗癌等[4-6]多种药理活性。作者前期预实验发现较低浓度的辣椒素能抑制HSCs增殖,诱导HSCs凋亡,本研究继续探讨辣椒素对HSCs活性的影响及纤维化相关基因的表达,探讨辣椒素能否用于治疗肝纤维化及其可能的作用机制。
材料和方法
1 材料及试剂
SD大鼠由温州医学院实验动物中心提供;HSCT6细胞系购自中科院上海细胞库;辣椒素购自Sigma;CCK-8购自日本同仁化学公司;DMEM和胎牛血清购自 Gibco,Bcl-2、Bax、Cyt-C 等Ⅰ抗购自 CST;Annexin V/PI apoptosis kit购自杭州联科生物技术有限公司;全自动酶标仪(Bio-Rad);FACS流式细胞仪(BD)。
2 方法
2.1 细胞培养 HSCs接种于含10%胎牛血清的DMEM培养液中,置37℃、5%CO2、饱和湿度的培养箱中常规培养,根据细胞生长情况,每2~3 d换液1次。
2.2 DCFH-DA法检测HSCs中活性氧的水平 收集对数期细胞,用培养液稀释成细胞悬液,加入96孔板,每孔100 μL,含细胞 5×104个,加入辣椒素(0、50、100、150 和200 μmol/L),培养24 h 后吸去上清液,加入用 DMEM培养液稀释好的10 μmol/L DCFH-DA溶液,置孵箱孵育0.5 h,用DMEM培养液洗2遍后荧光显微镜下观察荧光亮度。
2.3 CCK-8比色法检测HSCs增殖 96孔板每孔培养细胞5×104,培养24 h后按不同浓度分别向各孔中加入辣椒素 (0、50、100、150 和200 μmol/L),每个浓度设5个复孔。培养液中辣椒素0 mg/L的HSCs为空白对照组。培养24 h后每孔加入CCK-8溶液20 μL,继续培养2 h,用自动酶标仪于450 nm处检测每孔的吸光度(A)值,间接计算细胞增殖程度。
2.4 Western blotting法检测HSCs中α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的表达 按前述方法分组加入不同浓度辣椒素,培养48 h后,在各培养体系HSCs中分别加入现配的细胞裂解液,冰上裂解30 min,于4 ℃、12 000 r/min离心15 min,取上清进行蛋白定量。取一定量蛋白样品上样。SDSPAGE胶电泳分离,转移至PVDF膜,封闭缓冲液室温摇床振荡1 h,加入α-SMA抗体 (1∶100),4℃过夜,TBST 漂洗3次,10 min/次,孵育Ⅱ抗(1∶30 000),37 ℃恒温振摇1 h;TBST漂洗3次,10 min/次,化学发光,显影、定影,对胶片图像扫描,用凝胶图像处理系统Gel-Pro Analyzer分析目标带的灰度值。
2.5 RT-PCR法检查HSCs肝纤维化相关基因表达
按前述方法根据不同辣椒素浓度分组,HSCs培养24 h,由长风生物科技公司设计大鼠基质金属蛋白酶(matrix metalloproteinase 1,MMP-1)、金属蛋白酶组织抑制物 1(tissue inhibitor of metalloproteinase 1,TIMP-1)、转化生长因子β1(transforming growth factor β1,TGF-β1)及内参照 GAPDH 的引物,利用 RT-PCR技术,分别测定各组细胞中上述基因的mRNA表达情况。具体如下:MMP-1上游引物 5′-CTCCCTTGGACTCACTCATTCTA-3′,下 游 引 物 5′-AGAACATCACCTCTCCCCTAAAC-3′,扩增片段长 227 bp;TIMP-1 上游引物 5′-CCTCTGGCATCCTCTTGTTG-3′,下游引物 5′-CGCTGGTATAAGGTGGTCTC-3′,扩增片段长157 bp;TGF-β1上游引物:5′-GAGGCGGTGCTCGCTTTGT-3′,下游 引 物 5′-CGGGTGACTTCTTTGGCGTAG-3′,扩增片段长 107 bp;GAPDH 上游引物 5′-GAGGACCAGGTTGTCTCCTG-3′,下游引物 5′-GGATGGAATTGTGAGGGAGA-3′,扩增片段长 215 bp;用GAPDH为内参照,分别扩增MMP-1、TIMP-1和TGF-β1。反应条件为:94℃ 5 min预变性,扩增40个循环,每个循环包括:94℃ 30 s,52.1℃ 30 s,72℃45 s。
2.6 流式细胞术检测HSCs凋亡 按前述方法根据不同浓度辣椒素浓度分组,HSCs在6孔板中作用24 h后,用不含EDTA的胰酶消化,每个样本收集约2×105个细胞,1 500 r/min离心5 min后,弃去培养液,用PBS洗涤细胞2次,1 500 r/min离心5 min,加入 200 μL binding buffer重悬细胞;加入5 μL annexin V-FITC 混匀后,再加入 5 μL propidium iodide,混匀;室温、避光反应20 min后上机检测,流式细胞仪激发波长488 nm,发射波长530 nm。
2.7 肝脏组织病理学检查 选择体质量250~300 g的SD大鼠,采用50%四氯化碳植物油溶液腹腔注射3个月,获得肝纤维化模型。将不同剂量辣椒素(0、2.5、5.0、7.5 mg/kg)分别腹腔注射肝纤维化大鼠,将正常大鼠及注射5.0 mg/kg辣椒素的正常大鼠设为正常对照及阴性对照组,每组大鼠5只,每周注射2次,共4周,最后1次注射后继续饲养1周。处死大鼠,取肝行石蜡切片和HE、α-SMA染色。
2.8 肝组织羟脯氨酸和血清III前胶原肽及透明质酸测定 使用肝羟脯氨酸试剂盒测定肝脏胶原含量。肝组织(80 mg)在冰冻条件下匀浆,匀浆液经37℃孵育消化过夜后,匀浆液离心复溶于测试液中,匀浆液中的羟脯氨酸在550 nm波长测定A值,由已知羟脯氨酸浓度的标准液的A值建立标准曲线,根据测试液的A值计算出肝组织内的羟脯氨酸浓度。按试剂盒说明采用放射免疫法测定大鼠血清Ⅲ型胶原和透明质酸水平。
3 统计学处理
数据采用SPSS 13.0统计软件处理,数据以均数±标准差(mean±SD)表示,两样本均数间比较用t检验。多个样本均数间的比较用方差分析,以P<0.05为差异有统计学意义。
结 果
1 辣椒素抑制HSCs中活性氧的产生
荧光显微镜观察可见,与对照组比较,随着培养液中辣椒素浓度的增加,HSCs中活性氧的产生呈明显递减趋势,见图1。

Figure 1.The reactive oxygen species in HSCs treated with capsaicin at different concentrations(×100).A:0 μmol/L;B:50 μmol/L;C:100 μmol/L;D:150 μmol/L;E:200 μmol/L.图1 荧光法检测各培养体系HSCs中活性氧的生成
2 辣椒素抑制了HSCs的增殖
与对照组相比,随着培养液中辣椒素浓度增加,HSCs增殖程度明显下降,差别有统计学意义(P<0.05),见表1。
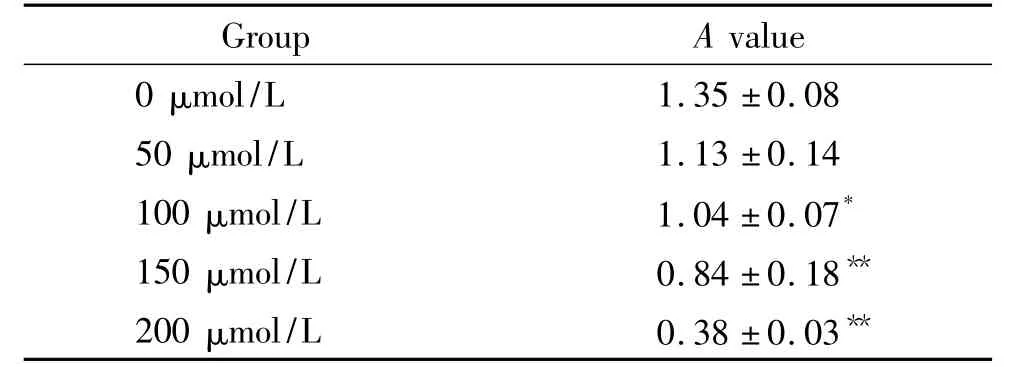
表1 各培养体系中HSCs的细胞增殖程度的比较Table 1.The effect of capsaicin on the proliferation of activatedHSCs(Mean±SD.n=5)
3 辣椒素抑制HSCs中α-SMA的表达
Western blotting法检测可见,随着培养液中辣椒素浓度增加,与对照组相比较,HSCs中的α-SMA表达水平明显下降,差别有统计学意义(P<0.05),见图2。
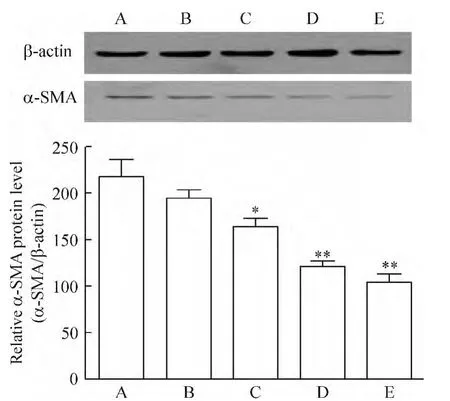
Figure 2.The effect of capsaicin on α-SMA expression in activated HSCs.A:0 μmol/L;B:50 μmol/L;C:100 μmol/L;D:150 μmol/L;E:200 μmol/L.Mean ± SD.n=3.*P <0.05,**P <0.01 vs A group or B group.图2 各培养体系中HSCs的α-SMA表达
4 辣椒素调节HSCs中MMP-1、TIMP-1和TGF-β1mRNA的表达
RT-PCR检测结果表明,与对照组相比,随着培养液中辣椒素浓度增加,HSCs中MMP-1 mRNA表达未见明显变化 (P>0.05),但 TIMP-1及 TGF-β1mRNA却呈降低趋势,差别有统计学意义 (P<0.05),见图 3。

Figure 3. The effects of capsaicin on MMP-1,TGF-β1and TIMP-1 mRNA expression in activated HSCs.A:0 μmol/L;B:50 μmol/L;C:100 μmol/L;D:150 μmol/L;E:200 μmol/L.Mean ± SD.n=6.*P <0.05,**P <0.01 vs A group or B group.图3 各培养体系中 HSCs MMP-1、TGF-β1及 TIMP-1 mRNA的表达
5 辣椒素促进了HSCs的凋亡
流式细胞术的检测结果显示,与对照组相比,随着培养液中辣椒素浓度增加,HSCs的凋亡率逐步升高,差别有统计学意义 (P<0.05),见图4。

Figure 4.The effect of capsaicin on apoptosis of activated HSCs.A:0 μmol/L;B:50 μmol/L;C:100 μmol/L;D:150 μmol/L;E:200 μmol/L.Mean ± SD.n=6.*P <0.05,**P <0.01 vs A group or B group.图4 各培养体系中HSCs的凋亡情况
6 肝纤维化模型鼠肝脏组织病理学的改变
肝脏病理切片HE染色检查发现,肝纤维化模型大鼠肝脏肝细胞呈片状坏死,肝小叶结构破坏严重,纤维间隔形成。随着辣椒素注射液剂量的增加,肝细胞变性坏死逐渐减轻,纤维间隔变窄,肝小叶结构残留增多,肝脏纤维化程度减轻,而阴性对照组肝脏病理未见明显变化,见图5。肝脏病理切片α-SMA染色检查发现,随着辣椒素注射液剂量的增加,肝纤维化模型大鼠肝组织中α-SMA表达量逐渐降低,见图6。

Figure 5.The effect of capsaicin on pathologic changes of the liver tissues in vivo(HE staining,×100).A:0 mg/kg;B:2.5 mg/kg;C:5.0 mg/kg;D:7.5 mg/kg;E:normal control group(normal rats);F:negative control group(normal rats treated with 5.0 mg/kg capsaicin).图5 各组大鼠肝脏病理切片HE染色
7 肝组织羟脯氨酸含量及血清Ⅲ型胶原和透明质酸水平的变化
检测结果显示,随着辣椒素注射液浓度的增加,肝组织羟脯氨酸含量及血清Ⅲ型胶原和透明质酸水平均呈逐渐降低趋势,各组间差别有统计学意义(P <0.05),见表2。

Figure 6.The effect of capsaicin on α-SMA expression in the liver tissues in vivo(immunohistochemical staining,×100).A:0 mg/kg;B:2.5 mg/kg;C:5.0 mg/kg;D:7.5 mg/kg.图6 各组大鼠肝脏病理切片α-SMA免疫组化染色
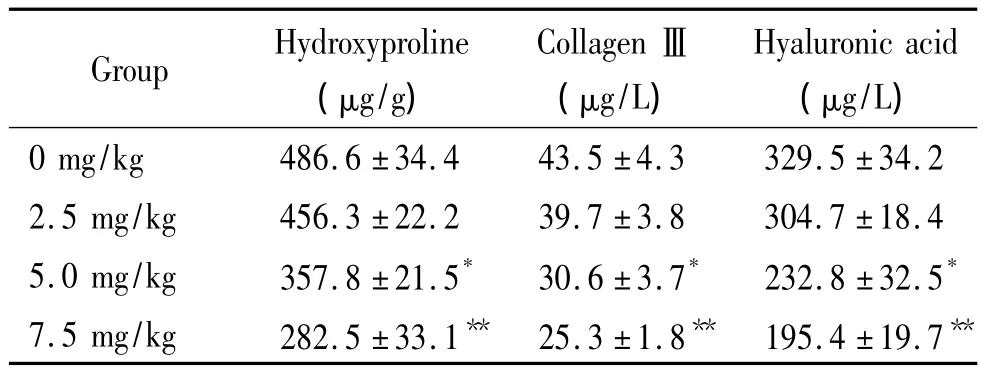
表2 各组大鼠肝脏胶原纤维蛋白及血浆纤维化水平Table 2.The effects of capsaicin on the hydroxyproline expression in the liver tissues,and the serum levels of collagen III and hyaluronic acid in the rats with liver fibrogenesis(Mean±SD.n=5)
讨 论
我国是肝炎高发国家,肝炎迁延不愈最终发展成肝硬化,由肝硬化导致的肝功能衰竭或肝癌是引起患者死亡的主要原因,严重影响人民的健康。因此,阻断或延缓肝纤维化的发展是目前研究治疗肝硬化的关键。HSCs属于肝脏的间质细胞,它在肝纤维化过程中扮演着重要的角色。针对HSCs的治疗是预防和治疗肝纤维化的关键环节[7-9]。
辣椒素是辣椒中的主要辛辣成分。辣椒素在各种辣椒中含量从0.5%~1%不等。辣椒素具有多种药理活性,既往对辣椒素的研究主要集中于抗炎、抗氧化、止痛、抗肿瘤等的作用[10-11],而辣椒素与HSCs的活化增殖及辣椒素与肝纤维化的关系研究则未见相关报道。
辣椒素具有抗氧化特性,它能清除自由基,终止自由基造成的脂质过氧化,有效抑制活性氧诱发的氧化应激反应,本实验结果显示,辣椒素的抗氧化作用可抑制HSCs活化增殖过程中活性氧的产生,从而参与抑制HSCs的活化与增殖过程。
HSCs活化后MMP-1表达降低而TIMP-1和TGF表达升高,升高的TIMP-1和TGF-β1反过来又可促进HSCs活化及纤维化基质的分泌,从而促进肝纤维化[8]。而本实验显示,尽管辣椒素对HSCs的MMP-1表达无明显影响,但辣椒素抑制HSCs的增殖活化,而且抑制HSCs的TIMP-1和TGF-β1表达,综合以上效应,我们认为辣椒素在减轻肝纤维化方面可能具有一定的疗效。
我们通过四氯化碳诱导建立的大鼠肝纤维化模型,经腹腔注射辣椒素的体内研究发现,辣椒素确实能在一定程度上有效抑制肝纤维化进程。对于辣椒素在体内如何起到抗肝纤维化作用,我们推测一定浓度的辣椒素可能通过抑制HSCs的增殖激活,促进其凋亡,而且抑制促纤维化基因TIMP-1与TGF-β1的表达,减缓了四氯化碳诱导的肝纤维化进程。
根据目前初步研究的结果显示,辣椒素可通过抑制HSCs的活性而发挥抗纤维化作用。但我们在研究中也发现辣椒素不仅可引起HSCs的凋亡,而且也可引起正常肝细胞的凋亡,只是肝细胞损伤变性程度较HSCs轻而已,因此,对辣椒素的活体研究有待进一步深入。
[1] Friedman SL.Hepatic stellate cells:protein,multifunction and enigmatic cells of the liver[J].Physiol Rev,2008,88(1):125-172.
[2] Yu J,Zhang S,Chu ES,et al.Peroxisome proliferatoractivated receptors gamma reverses hepatic nutritional fibrosis in mice and suppresses activation of hepatic stellate cells in vitro[J].Int J Biochem Cell Biol,2010,42(6):948-957.
[3] 舒建昌,朱海燕,吕 霞,等.神经生长因子对肝星状细胞胶原分泌及形态学的影响[J].中国病理生理杂志,2011,7(12):2396-2398.
[4] 祝丽丽,胡万乐,刘长宝,等.辣椒素对结直肠癌裸鼠皮下移植瘤的抑制作用及机制[J].中华肿瘤杂志,2013,35(4):256-261.
[5] Janssens PL,Hursel R,Martens EA,et al.Acute effects of capsaicin on energy expenditure and fat oxidation in negative energy balance[J].PLoS One,2013,8(7):e67786.
[6] Huang SP,Chen JC,Wu CC,et al.Capsaicin-induced apoptosis in human hepatoma HepG2 cells[J].Anticancer Res,2009,29(1):165-174.
[7] Friedman SL.Hepatic fibrosis:overview[J].Toxicology,2008,254(3):120-129.
[8] Hong IH,Park SJ,Goo MJ,et al.JNK1 and JNK2 regulate α-SMA in hepatic stellate cells during CCl4-induced fibrosis in the rat liver[J].Pathol Int,2013,63(10):483-491.
[9] 俞富祥,宋才鑫,吴志伟,等.脂肪特异性蛋白27对大鼠肝星状细胞活化的影响[J].中国病理生理杂志,2013,29(9):1597-1602.
[10]Pramanik KC,Boreddy SR,Srivastava SK.Role of mitochondrial electron transport chain complexes in capsaicin mediated oxidative stress leading to apoptosis in pancreatic cancer cells[J].PLoS One,2011,6(5):e20151.
[11]Lee SH,Richardson RL,Dashwood RH,et al.Capsaicin represses transcriptional activity of beta-catenin in human colorectal cancer cells[J].J Nutr Biochem,2011,23(6):646-655.

