乙型肝炎病毒X蛋白截短突变体的构建及其对Wnt/β-catenin信号通路转录活性的影响*
谢 青,陈林林, 李 治,单晓亮, 聂 丹,段玉洁, 权会琴,唐 霓
(重庆医科大学感染性疾病分子生物学教育部重点实验室,重庆400016)
肝细胞癌(hepatocellular carcinoma,HCC)是我国最常见的恶性肿瘤之一,长期慢性乙型肝炎病毒(hepatitis B virus,HBV)感染是导致HCC的主要病因[1]。Wnt/β-catenin信号通路是广泛存在于真核生物中的一条高度保守的信号通路,其异常激活与多种肿瘤如肝癌、子宫癌、黑色素瘤等的发生发展密切相关[2]。研究证实,乙型肝炎病毒X蛋白(hepatitis B virus X protein,HBx)可以通过异常激活 Wnt/βcatenin信号通路,参与HCC的发生,但具体机制不明[3]。
HCC患者中普遍存在异质的HBx缺失突变体,表达截短的HBx蛋白致其功能发生改变,并极可能参与肝细胞的恶性转化[4]。为此,我们构建了一系列HBx截短突变体,这些区域涵盖了已有文献报道的HCC组织中HBx蛋白自然截短突变的主要位点,并且涉及HBx的反式激活域等功能域。本实验通过细胞转染和荧光素酶报告系统,研究HBx不同截短突变体在细胞内的定位及其对Wnt/β-catenin信号通路转录活性的影响,探讨HBV相关肝癌的发生机制。
材料和方法
1 主要质粒和细胞
人肝癌细胞系Huh7、人胚肾上皮细胞HEK293、真核表达载体 pAdTrack-TO4-HBx、pEGFP-C1、pTop-Luc以及E.coli DH10B均为本实验室保存。
2 主要试剂
Taq DNA聚合酶购自TaKaRa;限制性核酸内切酶HindⅢ和KpnⅠ、T4 DNA连接酶、Wizard质粒提取试剂盒及萤光素酶活性检测试剂盒均为Promega产品;抗绿色荧光蛋白(green fluorescent protein,GFP)抗体购自碧云天;鼠抗IgG购自Abcam;1%青/链霉素和DMEM培养基购自HyClone;胎牛血清购自 Gibco;4′,6-联脒-2-苯基吲哚二盐酸盐(4’,6-diamidino-2-phenylindole dihydrochloride,DAPI)购自Roche;LipofectamineTM2000购自 Invitrogen;发光底物ECL购自Millipore;其它生化试剂均为进口分装或国产分析纯。引物序列见表1,由上海Invitrogen公司合成。

表1 引物序列Table 1.Sequences of the primers
3 主要方法
3.1 HBx截短突变体的构建及鉴定 根据HBx基因全长序列设计5对截短体[缺失C端49~154 aa(HBx1)、C 端85~154 aa(HBx2)、N 端1~57 aa+C端141~154 aa(HBx3)、N 端1~57 aa(HBx4)或N端1~84 aa(HBx5)]的引物,以 pAdTrack-TO4-HBx质粒作为模板,聚合酶链反应(polymerase chain reaction,PCR)扩增上述截短突变体,反应条件:96℃ 2 min,92 ℃ 30 s,63 ℃ 30 s,72 ℃ 30 s,共35 个循环,最后在72℃延伸5 min。取2 μL PCR产物在2%琼脂糖凝胶电泳、用凝胶成像仪记录。PCR产物用无水乙醇沉淀法纯化后克隆入pEGFP-C1载体的HindⅢ和KpnⅠ酶切位点,T4 DNA连接酶16℃过夜连接,产物转化E.coli DH10B感受态菌。挑选阳性克隆,扩增后提取质粒进行酶切鉴定并测序。
3.2 细胞转染及荧光显微镜观察 将HEK293细胞按每孔2×105细胞铺于24孔板,待细胞生长至80%融合率时进行转染。将0.5 μg质粒和2 μL LipofectamineTM2000稀释到50 μL无血清DMEM中制备转染复合物,轻轻混匀,室温静置20~30 min。用500 μL无血清DMEM轻轻洗涤细胞后,加入250 μL无血清DMEM至每孔。将转染复合物加入24孔板,轻轻摇匀后,置CO2孵箱中37℃孵育。转染后4 h用1 mL含10%胎牛血清的DMEM替换转染液。转染后36 h,用4%多聚甲醛固定,DAPI染核后,在激光共聚焦显微镜下观察HBx和增强型GFP(enhanced GFP,EGFP)融合蛋白的表达及其细胞定位。3.3 重组蛋白的Western blotting检测 取100 μL的细胞裂解液,裂解瞬时转染各截短突变体基因的HEK293细胞,收集上清液,每孔上样量20 μg,12%SDS-PAGE分离后,转移到PVDF膜上。5%脱脂牛奶室温封闭1 h,将膜孵以抗GFP抗体4℃过夜。TBST洗膜40 min,HRP酶标鼠抗IgGⅡ抗室温孵育1 h。洗涤后,加入底物发光剂ECL 1 mL,10 s后吸干发光剂,用单层透明薄膜包裹后曝光胶片。
3.4 萤光素酶报告基因检测 按照3.2的方法,Huh7细胞瞬时转染pTOP-Luc报告质粒,12 h后重铺细胞,待细胞贴壁后分别转染pEGFP-C1及各HBx不同截短突变体,并设立空白对照组。转染后24 h,按照Promega公司萤光素酶检测试剂盒说明书进行操作,检测pTOP-Luc萤光素酶活性。具体方法:将24孔板中的细胞用PBS充分洗涤后,每孔加入100 μL的1×Passive Lysis Buffer,充分裂解细胞约10~15 min后,将其收集于1.5 mL EP管中,室温14 000 r/min离心10 min。取50 μL上清于另一1.5 mL EP管中,加入20 μL萤光素酶底物工作液,充分混匀后再立即用萤光发光计测量萤火虫萤光素酶的活性。每组的相对萤光素酶活性用实验组萤火虫萤光素酶活性与对照组萤火虫萤光素酶活性的比值来表示。实验重复3次。
4 统计学处理
每次实验设3个复孔,进行独立的3次重复实验。用SPSS 15.0统计软件分析。数据用均数±标准差(mean±SD)表示,各组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 HBx截短突变体目的基因的PCR扩增
以pAdTrack-TO4-HBx为模板,分别用相应引物扩增目的基因 HBxWT、HBx1、HBx2、HBx3、HBx4和HBx5,PCR产物经2%琼脂糖凝胶电泳显示,DNA片段的大小分别约为 462 bp、144 bp、255 bp、248 bp、290 bp和209 bp,与预期结果一致,见图1、2。切下目的条带,用胶回收试剂盒回收DNA,经2%琼脂糖凝胶电泳鉴定,为单一条带DNA。

Figure 1.Schematic diagram of HBx-truncating mutation constructs.HBxWT:full length of HBx protein;HBx1:1~48 aa of HBx protein;HBx2:1~84 aa of HBx protein;HBx3:58~140 aa of HBx protein;HBx4:58~154 aa of HBx protein;HBx5:85~154 aa of HBx protein;fHBxWT,fHBx1,fHBx2,fHBx3,fHBx4 and fHBx5:fusion proteins of HBxWT,HBx1,HBx2,HBx3,HBx4and HBx5with EGFP,respectively.图1 HBx截短突变体结构模式图

Figure 2.PCR products of HBx truncated mutants.Lane 1:HBxWT(462 bp);Lane 2:HBx1(144 bp);Lane 3:HBx2(255 bp);4:HBx3(248 bp);Lane 5:HBx4(290 bp);Lane 6:HBx5(209 bp);Lane 7:pEGFP-C1 vector(47 000 bp);M1:DNA marker 2000;M2:DNA marker λ-EcoT14Ⅰ.图2 HBx截短突变体的PCR扩增
2 HBx截短突变体重组质粒的鉴定
重组质粒 fHBxWT,1~5用 HindⅢ和 KpnⅠ双酶切后,经2%琼脂糖凝胶电泳,可见约4.7 kb的pEGFPC1 质粒片段和 462 bp、144 bp、255 bp、248 bp、290 bp和209 bp的目的基因片段,符合预期结果,见图3。重组质粒测序鉴定,证实克隆片段序列与HBx全长基因组中的对应序列相一致,且插入方向正确。
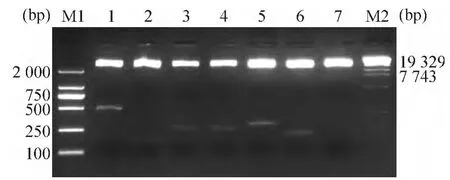
Figure 3.Identification of HBx-truncating mutation recombinant plasmids digested by restricted enzymes HindⅢand KpnⅠ.Lane 1:fHBxWT;Lane 2:fHBx1;Lane 3:fHBx2;Lane 4:fHBx3;Lane 5:fHBx4;Lane 6:fHBx5;Lane 7:pEGFP-C1 vector;M1:DNA marker 2000;M2:DNA marker λ-EcoT14Ⅰ.图3 HBx截短突变体重组质粒的酶切鉴定
3 HBx截短突变体重组质粒的表达
融合 EGFP的 HBx截短突变体瞬时转染HEK293细胞。48 h后收集细胞总蛋白,Western blotting检测各截短突变体的表达情况,均检测到与预计相对分子量相一致的融合表达蛋白,见图4。
4 HBx截短突变体在HEK293细胞中的定位
融合EGFP的HBx截短突变体瞬时转染HEK293细胞。36 h后固定细胞,DAPI染核后于激光共聚焦显微镜下观察HBx不同截短突变体在HEK293细胞中的定位。fHBxWT主要定位于HEK293细胞的胞质中,呈不均一的粗大颗粒,胞核中也有少量表达。N端缺失突变体(fHBx4和fHBx5)主要定位于细胞核周胞质;C端缺失突变体(fHBx1和 fHBx2)在胞质胞核中则呈均匀分布;N端1~57 aa+C端141~154 aa缺失突变体(fHBx3)的细胞定位情况则类似于fHBxWT,见图5。
5 HBx截短突变体对Wnt/β-catenin转录活性的影响
本实验中,报告质粒pTOP-Luc带有6个能够被β-catenin识别的 T细胞因子 4(T-cell factor 4,TCF4)重复序列,其萤光素酶的表达受转录复合物β-catenin/TCF4的调节,两者呈正相关关系。因此,报告基因产物的萤光素酶活性反映了 β-catenin/TCF4活性,即经典Wnt通路的活性。在Huh7细胞中外源转染fHBxWT后萤光素酶活性约为空白对照组的 69.5 倍,转染 fHBx1、fHBx2、fHBx3、fHBx4和 fHBx5后其萤光素酶活性较fHBxWT明显下降,分别下降了78.7%、84.7%、75.7%、93.8%和95.5%,见图6。

Figure 4.The expression of fusion proteins of HBx truncated mutants with EGFP in HEK293 cells.Vector:EGFP protein;mock:total protein of HEK293 cells.GAPDH served as a loading control.图4 HBx截短突变体重组质粒融合蛋白的表达
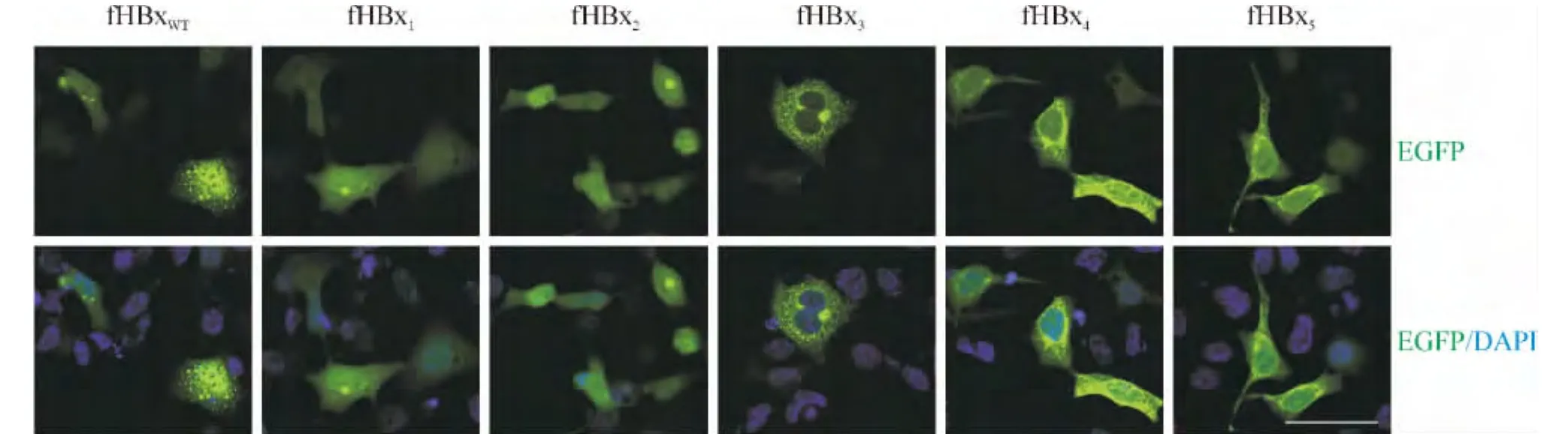
Figure 5.The expression and location of fusion proteins of HBx-truncated mutants with EGFP in HEK293 cells.Nuclei were stained with DAPI.Scale bar=50 μm.图5 HBx截短突变体重组质粒在HEK293细胞中的定位
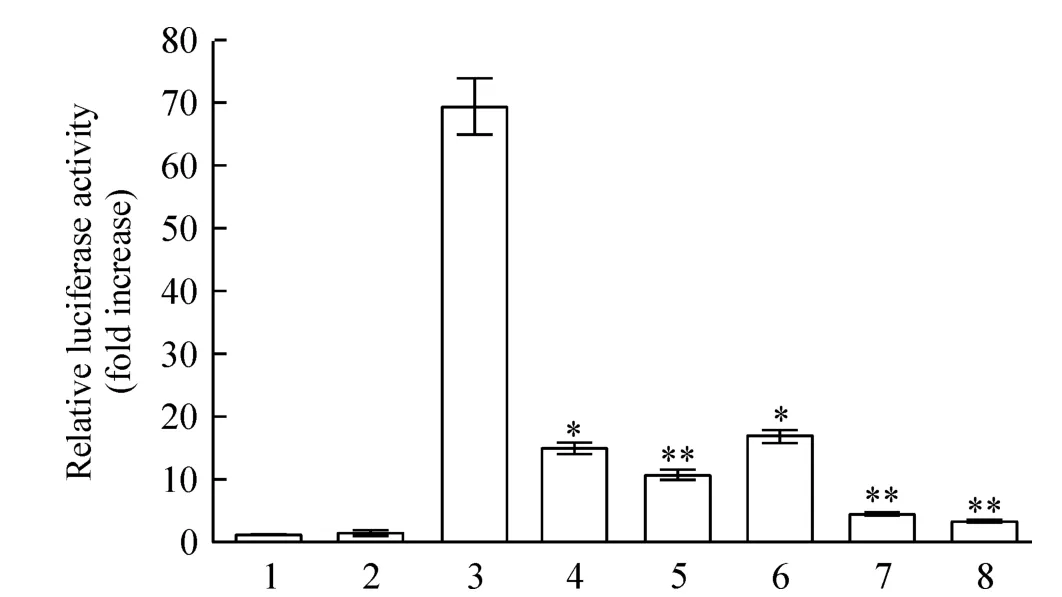
Figure 6.Effects of HBx truncated mutants on β-catenin/TCF4 transcriptional activity of Wnt signaling pathway in Huh7 cells.1:empty cell control;2:pEGFP-C1 vector;3:fHBxWT;4:fHBx1;5:fHBx2;6:fHBx3;7:fHBx4;8:fHBx5.Mean±SD.n=3.*P<0.05,**P <0.01 vs 3.图6 Huh7细胞中HBx截短突变体对Wnt/β-catenin转录活性的影响
讨 论
HBx基因定位于HBV基因组第1 374~1 836位核苷酸之间,是HBV DNA中最小的开放读码框,也是功能重叠最明显的区域,编码由145~154个氨基酸组成、分子量约为17 kD的HBx蛋白。根据HBx蛋白的氨基酸序列与土拨鼠肝炎病毒(woodchuek hepatitis virus,WHV)和地松鼠肝炎病毒(ground squirrel hepatitis virus,GSHV)序列的同源性,将HBx分成 A(1~20 aa)、B(21~57 aa)、C(58~84 aa)、D(85~119 aa)、E(120~140 aa)和 F(141~154 aa)6个区域。
近年来的研究发现,HBV DNA尤其是HBx基因频繁整合于宿主基因组,导致染色体的不稳定和缺失突变体的发生,与 HCC的发生发展密切相关。Hoare等[5]发现在 18例肝癌患者中有 10例(58.8%)存在 HBx缺失突变。Chen等[6]对 HBsAg阳性的肝癌患者进行HBx检测,通过序列比对,发现大部分肿瘤HBx蛋白存在羧基端缺失。另外,研究发现在一些HCC癌组织中分别发现了C端截短20或35个氨基酸的HBx截短体[7-9]。因此,在肝癌组织中HBx蛋白的缺失突变,尤其是C端缺失是一个主要特征。C端缺失突变的HBx具有完全不同于野生型HBx的功能。肿瘤组织中的HBx缺失突变体能够抑制野生型HBx抗增殖和反式激活能力,而C端缺失突变体则能增强原癌基因ras及c-myc的转化能力,并明显促进肝癌细胞的增殖与浸润能力[10-13]。同时,越来越多的证据也证实,HBx缺失突变体可以通过p53、NF-κB等途径取消野生型HBx所具有的促细胞凋亡能力[14]。因此,HBx的不同缺失突变,尤其是C端的缺失,使其在调节细胞增殖、分化及转化的过程出现紊乱,可能与HCC的发生发展相关。
通过我们的实验发现,HBx不同编码区缺失突变体在HEK293细胞中的定位不同,这可能与细胞中HBx表达水平的高低密切相关。有研究表明,在瞬时转染过表达系统中,HBx主要位于胞浆并附着包膜,小部分在核内。HBx保留有核输出信号,可与核受体Crm-1结合,诱导HBx的出核。另外,HBx还可以与一些转入因子如p53、Smad4相互作用,从而诱导HBx在胞浆与胞核之间的穿梭调节[15]。HBx具有广泛的转录激活能力,可通过激活胞浆信号转导或直接与相关转录因子相互作用调控宿主基因的表达。HBx的这种双重转录调节作用与其在细胞内的表达水平以及细胞定位密切相关。当HBx在细胞中呈低量表达时,它主要分布于胞核,通过与转录因子(如CREB、AP-1等)或基础转录元件TATA结合蛋白等相互作用直接调控多种基因的转录效应;当在细胞中高水平表达时,HBx则主要聚集在胞质,通过影响线粒体功能,从而干预细胞内复制的信号转导系统,参与对细胞增殖、凋亡等的调控[16]。
Wnt信号通路是真核生物中的一条广泛存在的高度保守的信号通路,在胚胎的发育过程中起到重要的作用。目前研究发现,Wnt信号通路与多种肿瘤的发生密切相关,如肝癌、肺癌、结肠癌、黑色素瘤等[2]。胞浆内 β-catenin表达或稳定性增高是肿瘤发生过程的中心事件,其原因可归纳为三大类:(1)异常Wnt信号,导致β-catenin降解障碍;(2)β-catenin结构改变,不能被磷酸化;(3)参与β-catenin降解调节的分子改变,如Wnt信号途径负性调节子(APC、Axin和β-TrCP)的失活突变、正性调节子Dvl过度表达、Wnt蛋白拮抗剂(如sFRP、WIF-1和DKK-1)的表达下调等[2,17-18]。
通过脂质体介导的转染方法,我们发现HBx不同编码区缺失突变体对Wnt/β-catenin信号通路转录活性的作用不同。与野生型HBx相比,HBx不同截短突变体对Wnt/β-catenin信号通路转录活性均明显下降,可能与HBx缺失突变体对胞浆中β-catenin的表达及稳定性的改变有关。最近的研究显示HBx可以通过甲基化E-cadherin启动子,抑制E-cadherin转录水平上的表达,从而稳定肝癌细胞质中的β-catenin,使其在胞质中积聚,入核后与TCF家族的转录因子相互结合,导致下游靶基因异常活化,最终参与肿瘤的发生发展[19]。此外,HBx还能刺激受体酷氨酸激酶,激活Ras/Raf/MAPK信号通路,稳定βcatenin从而异常活化Wnt信号通路,可能参与HCC的发生发展[20]。由此我们推断:HBx可能通过直接或间接与β-catenin结合,促使其在细胞浆和细胞核内聚集,影响其转录后调控作用,其具体分子机制尚需进一步研究。
本实验成功构建了一系列HBx N端、C端不同编码区缺失突变体和融合EGFP的表达载体,该区域涵盖了已报道的HCC中HBx蛋白自然发生截短突变的主要位点,为深入研究HBx不同缺失突变体的生物学功能及其对Wnt/β-catenin信号通路转录活性的影响研究奠定了基础。
[1] Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[2] 李海英,张 力,潘欢乐.Wnt信号通路在食管癌细胞放射抗拒性形成中的作用[J].中国病理生理杂志,2012,28(9):1623-1626.
[3] Fallot G,Neuveut C,Buendia MA.Diverse roles of hepatitis B virus in liver cancer[J].Curr Opin Virol,2012,2(4):467-473.
[4] Lee JH,Han KH,Lee JM,et al.Impact of hepatitis B virus(HBV)X gene mutations on hepatocellular carcinoma development in chronic HBV infection[J].Clin Vaccine Immunol,2011,18(6):914-921.
[5] Hoare J,Henkler F,Dowling JJ,et al.Subcellular localisation of the X protein in HBV infected hepatocytes[J].J Med Virol,2001,64(4):419-426.
[6] Chen WN,Oon CJ,Leong AL,et al.Expression of integrated hepatitis B virus X variants in human hepatocellular carcinomas and its significance[J].Biochem Biophys Res Commun,2000,276(3):885-892.
[7] Hsia CC,Nakashima Y,Tabor E.Deletion mutants of the hepatitis B virus X gene in human hepatocellular carcinoma[J].Biochem Biophys Res Commun,1997,241(3):726-729.
[8] Ma NF,Lau SH,Hu L,et al.COOH-terminal truncated HBV X protein plays key role in hepatocarcinogenesis[J].Clin Cancer Res,2008,14(16):5061-5068.
[9] 张玉霞,徐 菲,张旭照.慢性HBV感染肝组织的C端截短型HBx蛋白功能研究[J].中国肿瘤,2008,17(12):1048-1052.
[10] Nijhara R,Jana SS,Goswami SK,et al.Sustained activation of mitogen-activated protein kinases and activator protein 1 by the hepatitis B virus X protein in mouse hepatocytes in vivo[J].J Virol,2001,75(21):10348-10358.
[11]Yoo YG,Cho S,Park S,et al.The carboxy-terminus of the hepatitis B virus X protein is necessary and sufficient for the activation of hypoxia-inducible factor-1α[J].FEBS Lett,2004,577(1-2):121-126.
[12]Sirma H,Giannini C,Poussin K,et al.Hepatitis B virus X mutants,present in hepatocellular carcinoma tissue abrogate both the antiproliferative and transactivation effects of HBx[J].Oncogene,1999,18(34):4848-4859.
[13]Fu X,Tan D,Hou Z,et al.The effect of miR-338-3p on HBx deletion-mutant(HBx-d382)mediated liver-cell proliferation through cyclinD1 regulation[J].PLoS One,2012,7(8):e43204.
[14] Wei Y,Neuveut C,Tiollais P,et al.Molecular biology of the hepatitis B virus and role of the X gene[J].Pathol Biol(Paris),2010,58(4):267–272.
[15] Forgues M,Difilippantonio MJ,Linke SP,et al.Involvement of Crm1 in hepatitis B virus X protein-induced aberrant centriole replication and abnormal mitotic spindles[J].Mol Cell Biol,2003,23(15):5282-5292.
[16] Jung SY,Kim YJ.C-terminal region of HBx is crucial for mitochondrial DNA damage[J].Cancer Lett,2013,331(1):76-83.
[17]Ban KC,Singh H,Krishnan R,et al.GSK-3β phosphorylation and alteration of β-catenin in hepatocellular carcinoma[J].Cancer Lett,2003,199(2):201-208.
[18] Ding Q,Xia W,Liu JC,et al.Erk associates with and primes GSK-3β for its inactivation resulting in upregulation of β-catenin[J].Mol Cell,2005,19(2):159-170.
[19] Kew MC.Hepatitis B virus x protein in the pathogenesis of hepatitis B virus-induced hepatocellular carcinoma[J].J Gastroenterol Hepatol,2011,26(Suppl 1):144-152.
[20]Arzumanyan A,Friedman T,Kotei E,et al.Epigenetic repression of E-cadherin expression by hepatitis B virus x antigen in liver cancer[J].Oncogene,2012,31(5):563-572.

