运动训练通过诱导自噬、抑制凋亡改善老龄大鼠心脏功能*
张 昊, 王伟伟, 薛 过, 张伟华, 王丽娜,林 岩, 姜晓姝, 田 野, 徐长庆, 赵雅君△
(哈尔滨医科大学 1病理生理教研室,4机能中心,黑龙江哈尔滨150086;2黑龙江省电力医院病理科,黑龙江哈尔滨150090;3齐齐哈尔医学院病理生理教研室,黑龙江齐齐哈尔161006)
随着社会人口老龄化速度的加快,人们对衰老及衰老相关性疾病日益重视。研究显示,心肌衰老伴随着心肌收缩力下降,心输出量减少,最终导致心功能障碍,心血管疾病发生[1]。
自噬是真核细胞将胞质内损伤、衰老的蛋白质降解,满足自身代谢和细胞器更新需要,维持细胞稳态的重要机制[2]。研究发现,抑制自噬可引起衰老有关的病理反应[3];而增强自噬可延缓衰老及延长寿命[4-5]。因此,寻找合适的能够诱导自噬的干预措施,对延缓衰老及预防衰老相关疾病的发生有重要意义。
细胞凋亡是在基因调控下引起的细胞主动死亡过程[6]。心肌细胞凋亡对维持心脏正常形态结构具有重要作用、并与心脏的病理过程密切相关[7]。研究发现,随年龄增加心肌细胞氧化损伤增强、线粒体功能障碍、钙稳态失衡增强、能量产生减少,这些因素均能导致细胞坏死和细胞凋亡增加。线粒体是影响细胞凋亡进程的核心要素,线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)是线粒体内外信息交流的枢纽,其开放是调控线粒体途径细胞凋亡的重要环节[8]。文献报道,中低强度的有氧运动可改善线粒体的功能,使心脏在形态、结构、代谢、功能方面产生一系列良好适应,使心脏功能增强[9]。
本实验通过观察运动训练对衰老大鼠心脏功能、心肌细胞自噬[包括自噬相关蛋白5(autophagyrelated protein 5,Atg5)、Beclin 1和微管相关蛋白1轻链3(microtubule-associate protein 1 light chain 3,LC3)表达]、mPTP开放及细胞凋亡的影响,探讨运动训练在改善老龄心脏功能中的作用及机制,为通过运动训练的方法预防或减轻年龄相关的心血管疾病提供理论依据。
材料和方法
1 材料
Atg5、Beclin 1、LC3、细胞色素 C(cytochrome C,Cyt C)、GAPDH和Cyt C氧化酶Ⅳ (Cyt C oxidaseⅣ,COX-Ⅳ)Ⅰ抗(Proteintech),羊抗鼠IgG-AP和羊抗兔IgG-APⅡ抗(北京中杉金桥公司),TUNEL试剂盒(Roche),心肌线粒体分离试剂盒(碧云天生物技术有限公司),BCA蛋白浓度测定试剂盒(碧云天生物技术研究所),其它试剂均为国产分析纯。
2 主要仪器
FT-200动物跑步机(成都泰盟科技有限公司),US-640型紫外分光光度计(Beckman),Model 550酶标仪(Bio-Rad),H-600透射电镜(Hitachi),低温离心机(Beckman),恒温水浴锅(成都泰盟科技有限公司)。
3 主要方法
3.1 实验分组 雄性 Wistar大鼠,清洁级,由哈尔滨医科大学附属第二医院动物中心提供。实验分3组。青年组(young),体重(230±20)g,自由饮水进食的3月龄大鼠。老年组(old),18月龄自由饮水进食的大鼠,体重(500±20)g。老年运动组(old+exercise,old+Ex):18月龄大鼠,梯度跑台运动6周,跑台速度为20 m/min,以20 min/d开始运动,每3 d运动时间增加5 min,直至60 min/d时,运动时间不再变化。
3.2 超声心动图测定大鼠心脏功能 大鼠麻醉后仰卧位固定,胸部备皮,小动物超声探头(14.0 MHz)置于大鼠左前胸,连接超声检查仪,进行超声检查[10]。测量左心室收缩末期直径(left ventricular end-systolic diameter,LVESD)、左心室舒张末期直径(left ventricular end-diastolic diameter,LVEDD)、左心室射血分数(left ventricular ejection fraction,LVEF)和左心室缩短分数(left ventricular fractional shortening,LVFS)。
3.3 透射电镜观察大鼠心肌超微结构及自噬体取大鼠左心室心尖部组织体积约(1~2)mm×1 mm×1 mm大小,4℃戊二醛磷酸缓冲液固定液24 h。常规脱水、浸透、包埋、染色后制成50~70 nm的超薄切片,透射电镜下观察心肌组织超微结构变化及自噬体的形成。
3.4 Western blotting检测心肌组织Atg5、Beclin 1 和LC3蛋白的表达 取大鼠左心室前壁组织加入蛋白裂解液,低温研磨后置于冰上作用30 min,4℃、12 000×g离心15 min,取上清,以牛血清白蛋白为标准,用Bradford法对提蛋白进行定量。取80 μg蛋白,进行10%SDS-PAGE电泳,然后100 V 1 h转印至硝酸纤维素膜上。该膜在含80 g/L脱脂奶粉的封闭液中封闭37℃作用1 h后,加入Atg5、Beclin 1和LC3Ⅰ/Ⅱ抗体 (1∶500)4℃孵育过夜。第2天取出膜进行反复洗膜,之后将膜与碱性磷酸酶标记的IgG抗体(1∶1 000)室温轻摇1 h,洗膜、显色,同时以用GAPDH抗体(1∶500)作为内参照。
3.5 TUNEL法检测心肌细胞凋亡 取大鼠左心室前壁组织进行石蜡切片,按试剂盒说明书操作,采用TUNEL法检测心肌细胞凋亡。光镜下凋亡的细胞核染成棕褐色,每张切片随机取5个以上的高倍视野,数不少于200个心肌细胞核,计算细胞凋亡指数(apoptotic index,AI;%)=阳性细胞核数/(阳性细胞核数+阴性细胞核数)×100%。
3.6 分离大鼠心肌线粒体 线粒体的分离采用常规差速离心法。取大鼠左心室肌组织200 mg冰浴上剪碎,加入线粒体分离介质冰上研磨制成组织匀浆(心肌组织∶介质 =1∶5),低温(-4℃)、800×g离心5 min,将匀浆后的上清再次12 000×g离心10 min,弃上清,获取的沉淀即为提取的心肌线粒体,用线粒体贮存缓冲液重新悬起线粒体备用。
3.7 Western blotting检测心肌线粒体Cyt C蛋白表达 分离的大鼠心肌线粒体,加入蛋白裂解液进行裂解,Westernblotting检测线粒体CytC蛋白的表达(抗体稀释倍数1∶500),具体操作方法同上。
3.8 分光光度计法测定钙诱导的mPTP开放 应用上述方法提取到的大鼠心肌线粒体用Bradford方法测定线粒体蛋白含量。反应开始时在线粒体反应缓冲液(250 mmol·L-1sucrose,5 mmol·L-1KH2PO4,3 mmol·L-1琥珀酸钠,pH 7.2)内加入线粒体,使线粒体蛋白终浓度为0.5 g·L-1,混匀后记录其在540 nm处的初始吸光度(A540),1 min后加入200 μmol·L-1的 CaCl2,连续记录 20 min 内吸光度的变化,每间隔1 min记录1次。CaCl2可使线粒体肿胀,导致mPTP开放,使线粒体吸光度值下降,因此,线粒体的吸光度值越小,说明mPTP的开放程度越大。
3.9 透射电镜观察心肌线粒体超微结构的变化 取差速离心法获得的大鼠心肌线粒体约1~2 mm3,4℃戊二醛磷酸盐缓冲液固定24 h。常规脱水、浸透、包埋、染色后制成50~70 nm的超薄切片,透射电镜下观察心肌组织超微结构变化及自噬体的形成。
4 统计学处理
数据应用SPSS 16.0统计软件处理,每组数据用均数±标准差(mean±SD)表示,以P<0.05为差异有统计学意义。多组间比较用单因素方差分析。
结 果
1 大鼠心脏功能变化
超声心动图测量大鼠心脏功能结果显示,与young组比较,old组左心功能明显降低,表现为LVEDD及LVESD显著增大,LVEF及LVFS均显著降低(均 P<0.05);与 old组比较,old+Ex组的LVEDD及 LVESD较 old组有明显降低,LVEF和LVFS显著提高(均 P <0.05),见表1。

表1 各实验组大鼠心脏功能变化情况Table 1.Changes of heart functions of rats in different groups(Mean±SD.n=8)
2 心肌超微结构变化
电子显微镜可见,young组心肌肌原纤维排列整齐,肌节结构清晰,线粒体(白色箭头所示)基质致密,嵴排列整齐,并可见双层膜的自噬体(黑色箭头所示)。Old组大鼠心肌肌原纤维排列紊乱,明暗带模糊,线粒体基质密度降低、数量减少,偶见自噬体,肌原纤维间可见大量脂褐素颗粒沉积。Old+Ex组大鼠心肌线粒体基质致密、数目增多、膜完整,肌丝间脂褐素颗粒沉积减少,自噬体形成明显增多,见图1。

Figure 1.Transmission electron microscopy for myocardial ultrastructure(black arrows indicate autophagosome and white arrows indicate mitochondria)in rats(×10 000).A:young group;B:old group;C:old+Ex group.图1 透射电镜下观察大鼠心肌超微结构的变化
3 心肌Beclin 1、Atg5和LC3Ⅱ/Ⅰ蛋白表达
与young组比较,old组大鼠心肌Atg5与Beclin 1蛋白表达水平降低(P<0.01),LC3Ⅰ向 LC3Ⅱ转换明显减少,使 LC3Ⅱ/Ⅰ比值下降(P<0.01);与old组比较,old+Ex组心肌Atg5与Beclin 1蛋白表达增加(P <0.01),LC3Ⅱ/Ⅰ比值增加(P <0.01),见图2。
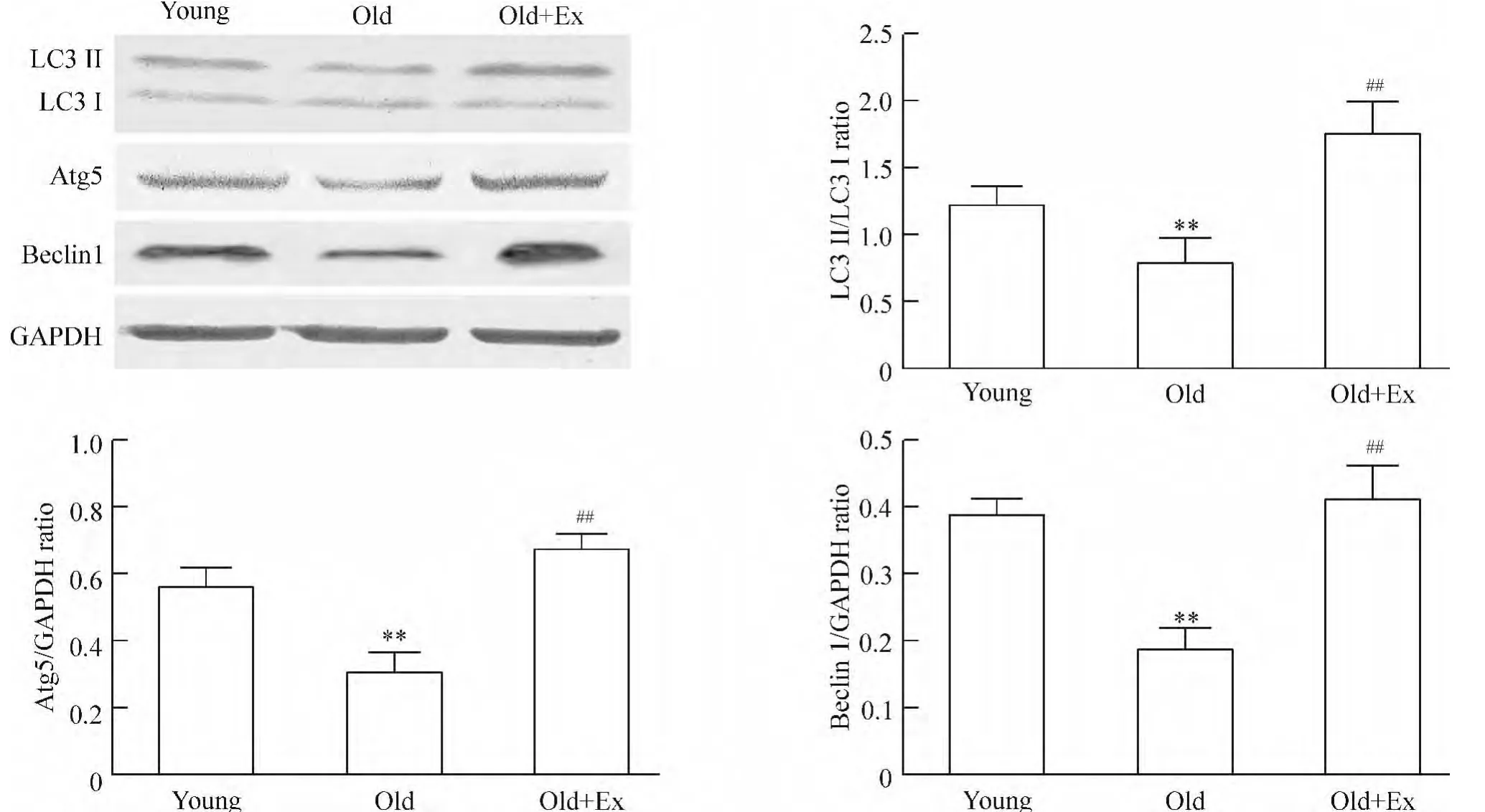
Figure 2.Western blotting analysis of the changes of Atg5,Beclin 1 and LC3 Ⅱ/Ⅰprotein expression in cardiac tissues of rats.Mean ±SD.n=3.**P <0.01 vs young group;##P <0.01 vs old group.图2 免疫印迹法分析大鼠心肌组织Atg5、Beclin 1及LC3Ⅱ/Ⅰ蛋白质表达变化
4 心肌细胞凋亡分析
TUNEL方法检测细胞凋亡结果显示,old组心肌细胞凋亡率为(13.3±2.1)%,明显高于青年组的(1.9 ±0.5)%,差异有统计学意义(P <0.01)。Old+Ex组的细胞凋亡率为(7.6±1.1)%,明显低于 old 组(P <0.01),见图3。
5 大鼠心肌线粒体超微结构变化
透射电镜下可见分离的young组心肌线粒体内、外膜完整,线粒体嵴排列整齐,基质致密;在old组,可见线粒体基质密度明显下降,嵴排列紊乱,多数线粒体膜破裂,完整线粒体数目明显降低;在old+Ex组,可见线粒体基质较致密,膜完整线粒体数目增多,见图4。
6 心肌线粒体Cyt C蛋白表达
Western blotting结果显示,与young组比较,old组心肌线粒体Cyt C表达水平明显降低(P<0.01);与old组比较,old+Ex组Cyt C蛋白表达水平明显增加,有显著差异(P <0.01),见图5。
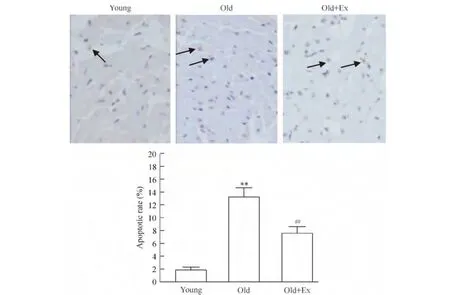
Figure 3.Detection of cardiomyocyte apoptosis with TUNEL assay(×400).The arrows indicate the apoptotic cells.Mean±SD.n=3.**P <0.01 vs young group;##P <0.01 vs old group.图3 TUNEL方法检测大鼠心肌细胞凋亡
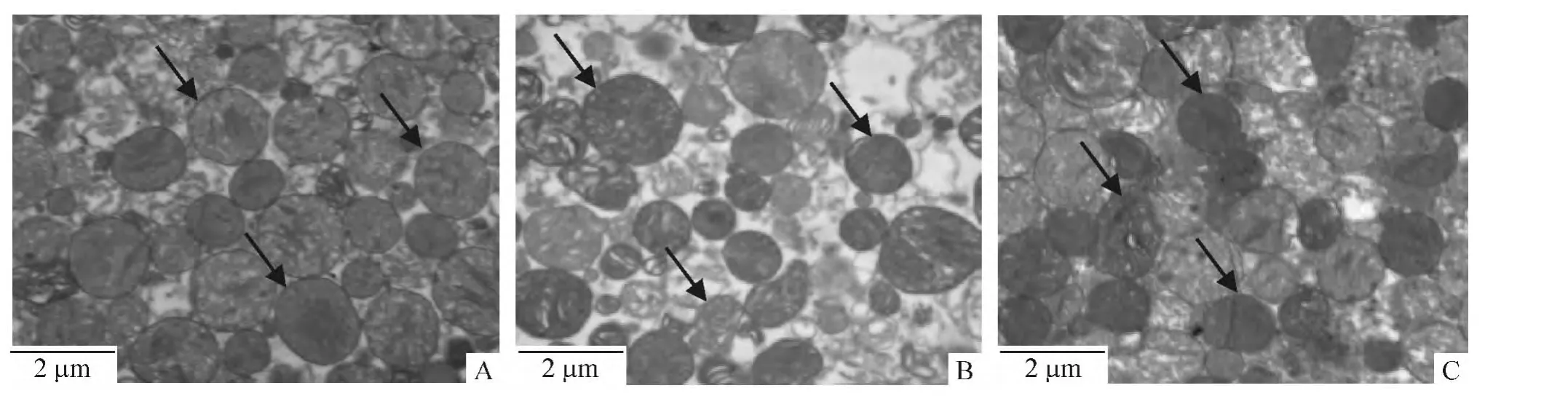
Figure 4.Transmission electron microscopy to observe the ultrastructure of mitochondria isolated from rat hearts(×20 000).A:young group;B:old group;C:old+Ex group.图4 透射电镜观察分离的大鼠心肌线粒体超微结构的变化
7 mPTP开放状态
与young组比较,old组线粒体的A540值出现明显的下降 (P<0.01)。而old+Ex组的A540值明显高于old组,组间比较差异显著(P<0.05),见图6。
讨 论

Figure 5.Western blotting analysis of the changes of Cyt C protein expression in mitochondria isolated from cardiac tissues of rats.Mean ± SD.n=3.**P <0.01 vs young group;##P <0.01 vs old group.图5 免疫印迹方法检测大鼠心肌线粒体Cyt C蛋白质表达变化
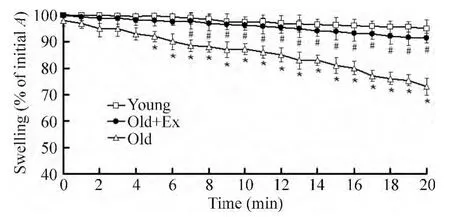
Figure 6.Assay of calcium-induced opening of mitochondrial permeability transition pore(mPTP)in mitochondria isolated from cardiac tissues of rats.Mean±SD.n=6.*P < 0.05 vs young group;#P < 0.05 vs old group.图6 钙诱导的线粒体通透性转换孔开放测定
细胞自噬是由一系列自噬相关蛋白介导的,这些蛋白质在自噬体形成的不同阶段发挥作用,如Beclin 1(酵母Atg6的同系物)和Atg5是哺乳类动物参与自噬的特异性基因,通过检测其蛋白表达,可以证明自噬的发生。LC3是自噬的标志蛋白,自噬形成时,胞浆LC3(LC3Ⅰ型)会酶解掉一小段多肽,转变为LC3Ⅱ(位于自噬体的膜上),因此,利用LC3Ⅱ/Ⅰ的比值可以评价自噬水平的高低[11]。此外,应用透射电镜动态观察自噬体的形成是检测自噬发生的金标准[11]。本研究中,我们首先利用透射电镜观察大鼠心肌自噬体的形成,发现老龄大鼠心肌自噬体形成明显减少、同时我们也观察到老龄大鼠心肌Beclin 1和Atg5蛋白表达下调、心肌细胞LC3Ⅱ/LC3Ⅰ的比值降低,研究显示老龄大鼠心肌细胞自噬水平明显下降。本研究进一步发现,持续6周的有氧运动训练,大鼠心肌Beclin 1和Atg5表达增加,LC3Ⅰ向LC3Ⅱ转换增加,透射电镜下观察到具有双层膜结构的自噬体形成明显增多;同时我们注意到,运动训练的老龄大鼠LVEF与LVFS明显升高(与old组比较,P<0.05),LVESD与LVEDD均缩小(与old组比较,P<0.05)。这说明运动训练在上调老龄大鼠心肌自噬水平同时,也提高了老龄大鼠的心脏功能。我们分析,运动训练可能是通过增强老龄心肌自噬活性,加速衰老心肌细胞内损伤细胞器的清除及变性蛋白质的更新,减轻老龄心肌的细胞损伤,改善老龄大鼠的心脏功能。已有文献报道,适宜强度的运动训练可通过上调细胞自噬水平降解细胞内的代谢废物,维持细胞自身稳态[12]。Chen 等[13]在心脏的研究显示,对心肌梗塞小鼠进行每天30 min、速度1 km·h-1、为期4周的跑台运动,运动组小鼠LC3Ⅱ/LC3Ⅰ比值是非运动组的2.1倍,证实运动训练可通过增强自噬活性提高损伤蛋白的降解速率,减轻细胞损伤,增强心脏功能。
线粒体凋亡途径是介导细胞凋亡的一个重要途径。mPTP是位于线粒体内、外膜间的多蛋白孔道,正常生理情况下,mPTP呈短暂、间歇性的低通透性开放状态,参与ADP/ATP的转运,维持线粒体跨膜电位,调节线粒体的正常功能。病理情况下,mPTP呈现不可逆的高通透性开放,导致Cyt C及凋亡诱导因子从线粒体膜间腔中释放入胞浆,引起细胞凋亡或死亡[8]。本研究显示老年大鼠心肌氧化应激增强(肌丝间有大量脂褐素颗粒沉积),线粒体超微结构损伤较青年组明显、线粒体通透转换孔开放数目增加,心肌细胞凋亡率增加。而6周有氧运动训练的老龄大鼠心肌肌丝间脂褐素颗粒沉积明显减少,自噬体形成增多;与老年组比,线粒体mPTP开放数目减少,线粒体Cyt C表达上调,TUNEL染色阳性细胞减少。这提示,适宜的运动训练可能通过提高老龄大鼠心肌的抗氧化能力、减轻老龄心肌的线粒体的结构损伤,进而抑制mPTP的开放及线粒体Cyt C的释放,减少了心肌细胞凋亡发生。相关研究支持我们的结论,Kavazis等[14]的研究显示适宜的运动训练能增强心脏抗凋亡的能力;耐力训练能够减少Cyt C从心肌线粒体的释放[15];Marcil等[16]研究表明适宜的运动能降低mPTP开放的敏感性;但也有研究显示,过于剧烈的运动可损害心肌的结构与功能,引起心肌细胞凋亡。许思毛等[17]研究发现大负荷跑台运动可引起大鼠心肌细胞线粒体结构功能破坏,[Ca2+]i升高,ATP 含量下降;金其贯等[18]发现过度训练抑制心肌Bcl-2蛋白表达,促进Fas蛋白的表达,诱导心肌细胞凋亡。其机制可能是大强度的力竭运动使机体自由基生成增多,线粒体氧化磷酸化水平降低,诱导线粒体膜通透性改变,最后导致细胞凋亡[19]。
近年来研究发现,自噬与凋亡可先后发生或同时共存于同一细胞中。自噬可通过清除破损线粒体延迟和对抗凋亡。自噬对细胞凋亡的抑制作用可能与自噬体包裹损伤的线粒体,进而阻止了Cyt C释放入细胞质,抑制凋亡小体的形成有关[20-21]。基于此,我们分析,本研究中运动训练可能是先激活了老龄大鼠心肌细胞自噬,通过自噬清除细胞内损伤的线粒体,进而抑制了线粒体途径的细胞凋亡,改善了老龄大鼠心脏功能,这也可能是运动训练减少年龄相关心血管疾病发生的机制之一。但是,心肌衰老的病理生理机制比较复杂,运动训练对衰老心肌的影响与运动的频率、持续时间、运动量等诸多因素有关。因此,运动训练能否通过激活自噬、抑制凋亡机制降低年龄相关的心血管疾病的发生率,仍有待于进一步研究。
[1] Shim YH.Cardioprotection and ageing[J].Korean J Anesthesiol,2010,58(3):223-230.
[2] 余小艳,张艳林,曹勇军,等.组蛋白脱乙酰酶SIRT1与细胞自噬[J].中国病理生理杂志,2013,29(8):1520-1524.
[3] Nair S,Ren J.Autophagy and cardiovascular aging:lesson learned from rapamycin[J].Cell Cycle,2012,11(11):2092-2099.
[4] Madeo F,Eisenberg T,Büttner S,et al.Spermidine:a novel autophagy inducer and longevity elixir[J].Autophagy,2010,6(1):160-162.
[5] LaRocca TJ,Gioscia-Ryan RA,Hearon CM Jr,et al.The auto-phagy enhancer spermidine reverses arterial aging[J].Mech Ageing Dev,2013,134(7-8):314-320.
[6] 张 彦,姜叙诚,郭晓奎.脓毒症中的细胞凋亡[J].中国病理生理杂志,2009,25(10):2068-2072.
[7] 刘 伟,冯 兵.能量代谢途径改变对心肌细胞凋亡的影响[J].中国病理生理杂志,2004,20(12):2342-2346.
[8] 齐一鸣,黄俊琪.2型登革病毒通过线粒体途径诱导EA.hy926细胞凋亡[J].中国病理生理杂志,2013,29(3):385-389.
[9] Bezzerides V,Rosenzweig A.Saying yes to exercise and NO to cardiac injury[J].Circ Res,2011,108(12):1414-1416.
[10]王伟伟,薛 过,张 昊,等.运动训练对老龄大鼠心肌多胺代谢的影响[J].中国病理生理杂志,2012,28(9):1543-1548.
[11]杜海磊,邱伟华,杨卫平.细胞自噬与肿瘤[J].中国病理生理杂志,2010,26(2):401-404.
[12] He C,Sumpter R Jr,Levine B.Exercise induces autophagy in peripheral tissues and in the brain[J].Autophagy,2012,8(10):1548-1551.
[13] Chen CY,Hsu HC,Lee BC,et al.Exercise training improves cardiac function in infarcted rabbits:involvement of autophagic function and fatty acid utilization[J].Eur J Heart Fail,2010,12(4):323-330.
[14] Kavazis AN,Smuder AJ,Min K,et al.Short-term exercise training protects against doxorubicin-induced cardiac mitochondrial damage independent of HSP72[J].Am J Physiol Heart Circ Physiol,2010,299(5):H1515-H1524.
[15]Kavazis AN,McClung JM,Hood DA,et al.Exercise induces a cardiac mitochondrial phenotype that resists apoptotic stimuli[J].Am J Physiol Heart Circ Physiol,2008,294(2):H928-H935.
[16]Marcil M,Bourduas K,Ascah A,et al.Exercise training induces respiratory substrate-specific decrease in Ca2+-induced permeability transition pore opening in heart mitochondria[J].Am J Physiol Heart Circ Physiol,2006,290(4):H1549-H1557.
[17]许思毛,上官若男,彭峰林,等.运动预处理对大负荷跑台运动引起的大鼠心肌损伤干预作用及其机制探讨[J].运动科学,2012,32(7):45-52.
[18]金其贯,邓荣华,李宁川,等.过度训练对大鼠心肌细胞凋亡的影响[J].中国运动医学杂志,2000,19(4):356-358.
[19] Huang CC,Lin TJ,Chen CC,et al.Endurance training accelerates exhaustive exercise-induced mitochondrial DNA deletion and apoptosis of left ventricle myocardium in rats[J].Eur J Appl Physiol,2009,107(6):697-706.
[20] He C,Bassik MC,Moresi V,et al.Exercise-induced BCL2-regulated autophagy is required for muscle glucose homeostasis[J].Nature,2012,481(7382):511-515.
[21] Qu X,Zou Z,Sun Q,et al.Autophagy gene-dependent clearance of apoptotic cells during embryonic development[J].Cell,2007,128(5):931-946.

