产虾青素酿酒酵母工程菌的构建
谢贵各,朱丽,蒋宇,戈梅,倪孟祥
产虾青素酿酒酵母工程菌的构建
谢贵各,朱丽,蒋宇,戈梅,倪孟祥
210009 南京,中国药科大学生命科学与技术学院(谢贵各、倪孟祥);200240 上海来益生物药物研发中心(朱丽、戈梅);200240 上海工业微生物所(蒋宇)
对酿酒酵母固有的 β-胡萝卜素代谢途径进行扩展,构建能够合成虾青素的酿酒酵母工程菌。
对不同来源的虾青素合成基因(β-胡萝卜素羟化酶)与(β-胡萝卜素酮化酶)进行随机组合,采用 overlap PCR 技术构建串联表达质粒,并将其导入产 β-胡萝卜素酿酒酵母工程菌内,发酵产物经 HPLC 和 UPLC-MS 鉴定,确定其成分。
构建出 8 种TEF1p--ADH1t-PGK1P--CYC1t组合的串联表达模式,其中基因组合分别为11,14 工程菌 HCCB08571、HCCB08572 产生了虾青素;工程菌 HCCB08566、HCCB08568、HCCB08573 未检测到产物虾青素,而出现了中间产物玉米黄质和斑蝥黄质。
成功构建了产生虾青素及其中间体的酿酒酵母工程菌。
β 胡萝卜素; 酿酒酵母菌; β-胡萝卜素羟化酶; β-胡萝卜素酮化酶; 虾青素
虾青素是一种脂溶性天然类胡萝卜素,可作为维生素 A 的前体,其抗氧化功能比维生素 E 强 500 倍[1]。虾青素的自然界来源非常有限,难以满足市场需求。其生物合成途径已基本清晰,先是合成 β-胡萝卜素[2],然后在β-胡萝卜素羟化酶(crtZ)β-胡萝卜素酮化酶(crtW)两种酶的催化下[3-5],经不同的中间体,最终生成虾青素[6],如图 1 所示。近年来,利用基因工程技术生产虾青素的研究陆续发表,如 Huang 等[7]将分别来源于,的基因导入西红柿,使得虾青素的产量达到 16.1 mg/g(DCW)。Lemuth 等[8]将来源于,PCC 73102 的基因在中表达,获得虾青素产量为 1.4 mg/g(DCW)。Hasunuma 等[5]将来源于.strain SD212 的基因导入烟草中,获得 0.5% 的虾青素(DCW)。
本文在课题组前期构建的 β-胡萝卜素酿酒酵母工程菌基础上,调取或合成不同来源的基因,采用 overlap PCR 技术构建成 8 种TEF1p--ADH1t-PGK1P--CYC1t 组合的串联表达模式,以期获得产虾青素的酿酒酵母工程菌。
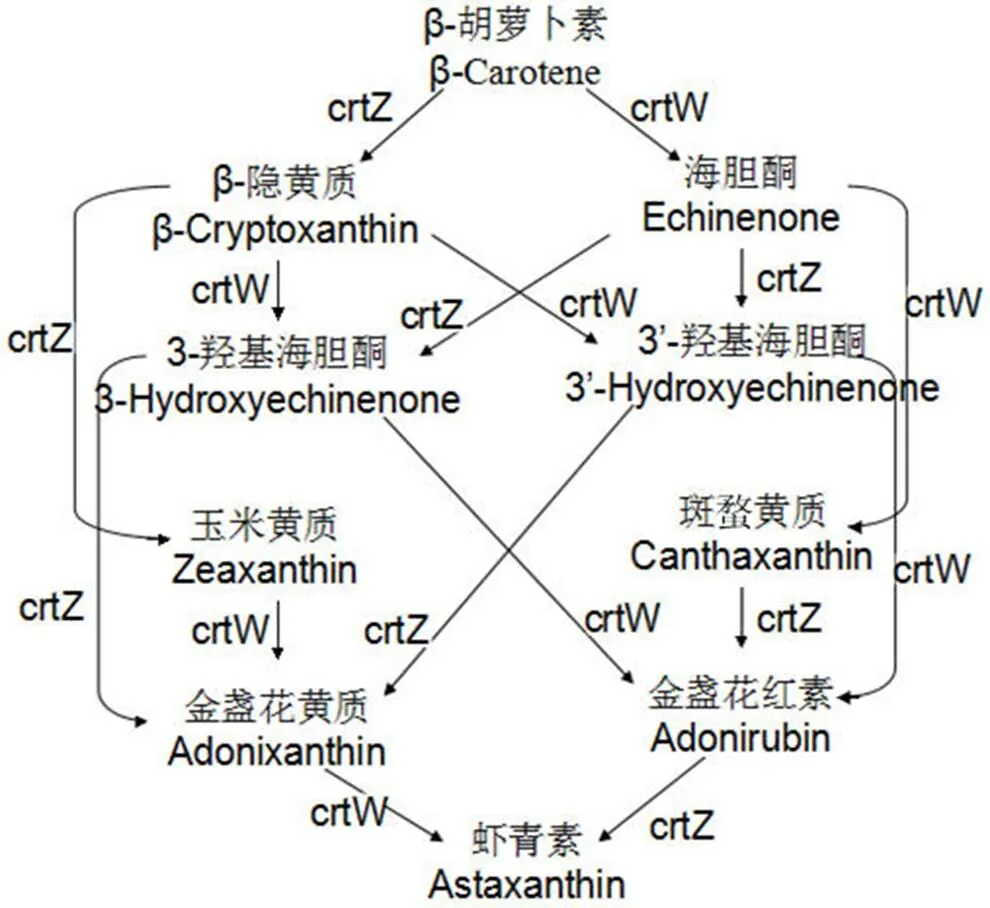
图 1 β-胡萝卜素到虾青素的生物催化途径
Figure 1 Astaxanthin biosynthesis pathway started from β-carotene
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 本研究所用的菌株 HCCB08526 和质粒 pYES/KanX-2 由本实验室保藏;DH5α 及 pMD19-T 购自日本 Takara公司;工程菌pUC571(1基因来源于)、pUC57-1(1基因来源于)、pUC57-2(2基因来源于)、pUC57-2(2基因来源于)、pUC57-3(3基因来源于spN81106)、pUC573(3基因来源于spN81106)、pUC57-(基因来源于)、pUC57-4(4基因来源于LMG 20103)、pUC57-4(4基因来源于sp. SD212)均由本实验室保藏。
1.1.2 主要溶液和培养基 抗生素(含 50 mg/ml 氨苄青霉素溶液、50 mg/ml 卡那霉素溶液、200 mg/L G418 溶液);YPD 培养基(含葡萄糖 2%、酵母提取物 1%、胰蛋白胨 2%、固体培养基添加 2% 琼脂)和 LB 培养基(含NaCl 1%、胰蛋白胨 1%、酵母提取物 1%、固体培养基添加 2% 琼脂)。
1.1.3 酶与主要试剂 限制性内切酶购自日本 Takara 公司;KOD 高保真酶购自日本 Toyobo 公司;Frozen EZ yeast Transformation IIT2001 购自美国 Zymo research 公司。
1.1.4 本研究所用的引物见表 1。
1.2 方法
1.2.1 pLYXGG1-8 表达质粒的构建 用表 1 所示引物,以酿酒酵母基因组为模板扩增TEF1p、PGK1P 启动子和 ADH1t 终止子片段,以 1.1.1 所述的亚克隆质粒为模板扩增不同来源的、基因,随后经 overlap PCR扩增出 8 种 TEF1p--ADH1t-PGK1P-组合表达片段,基因组合信息见表 2,并亚克隆至 T 载体。
将测序验证正确的亚克隆质粒经RΙ/Ι 双酶切后,回收 3000 bp 左右的片段与经相同酶切的载体质粒 pYES2/KanX-2 连接,构建成为重组表达质粒 pLYXGG1-8。
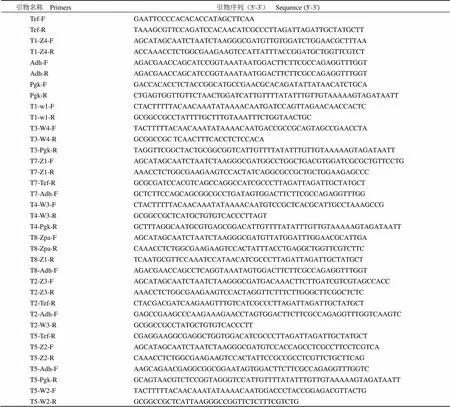
表 1 本研究所用引物

表 2 crtZ-crtW基因的不同组合方式
1.2.2 酿酒酵母工程菌 HCCB08566-08573 的构建 重组表达质粒转入 HCCB08526,转化方法按照试剂盒说明书进行。活化后的工程菌涂布于 YPD + G418(200 mg/L)平板,30 ℃静置培养2 d,筛选目的菌株。
1.2.3 酿酒酵母工程菌的发酵和产物检测 从培养平板上挑取阳性菌落,接入 25 ml YPD 培养基(250 ml 摇瓶),30 ℃,220 r/min培养 48 h。然后将种子液按照 4% 的比例转接到新鲜的 YPD 培养基中,30 ℃,220 r/min培养 5 d。发酵结束后,提取产物,并用 HPLC 进行检测[9]。
1.2.4 酿酒酵母工程菌发酵产物 UPLC-MS 鉴定 HPLC 制备虾青素样品中的主要物质,旋干浓缩后进行 UPLC-MS 分析[10]。
2 结果
2.1 含不同基因组合表达质粒的构建
从图 2 可以看出,pLYXGG1-8 基因组合片段长度均在 3000 bp 左右,与目标片段长度大小一致。

M:1 kb DNA Ladder;1 ~ 8:TEF1p-crtZ-ADH1t-PGK1P-crtW 8 种组合片段(pLYXGG1-8)
Figure 2 Agarose electrophoresis analysis of PCR products of eight combinations
2.2 酿酒酵母工程菌 HCCB08566-08573 构建
工程菌HCCB08566-08573 与对照组 HCCB08526 相比,菌体颜色进一步加深,说明其产生了更多的类胡萝卜素成分,如图 3 所示。
2.3 8 种酿酒酵母工程菌发酵产物分析
图 4 中A、B、C 是指发酵产物进行 HPLC 检测获得的峰,其保留时间分别为 7.5、9、11 min。
从 HPLC 结果可以看出,对比原始菌株 HCCB08526,工程菌 HCCB08571、HCCB08572 出现多种新物质峰。针对 HPLC 出现的 A、B、C 3 个新物质峰进行了 UPLC-MS 鉴定,以确定其成分。
A 物质的保留时间为 7.5 min,与虾青素标准品一致;从图 5 的 MS 结果可以看出[M+H] 597.22,[M+Na]619.37,与虾青素的相对分子量596.86 相符,证明该物质为虾青素。

图 3 工程菌 HCCB08566-08573 与对照菌 HCCB08526 平板生长情况
Figure 3 The different growth conditions between engineered strain HCCB08566-08573 and control
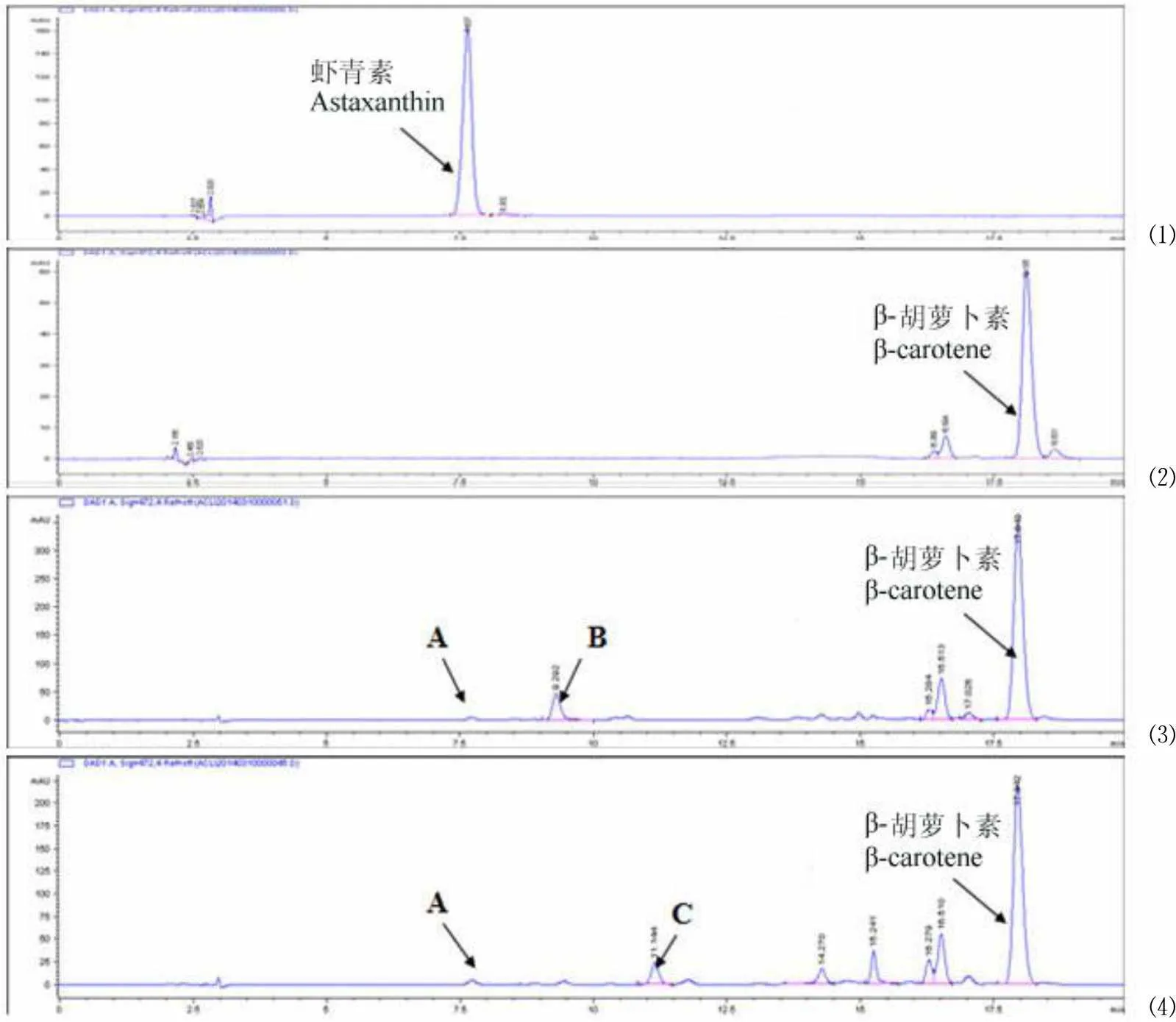
⑴ ⑵ ⑶ ⑷
Figure 4 Results of fermentation products of engineeredby HPLC assay
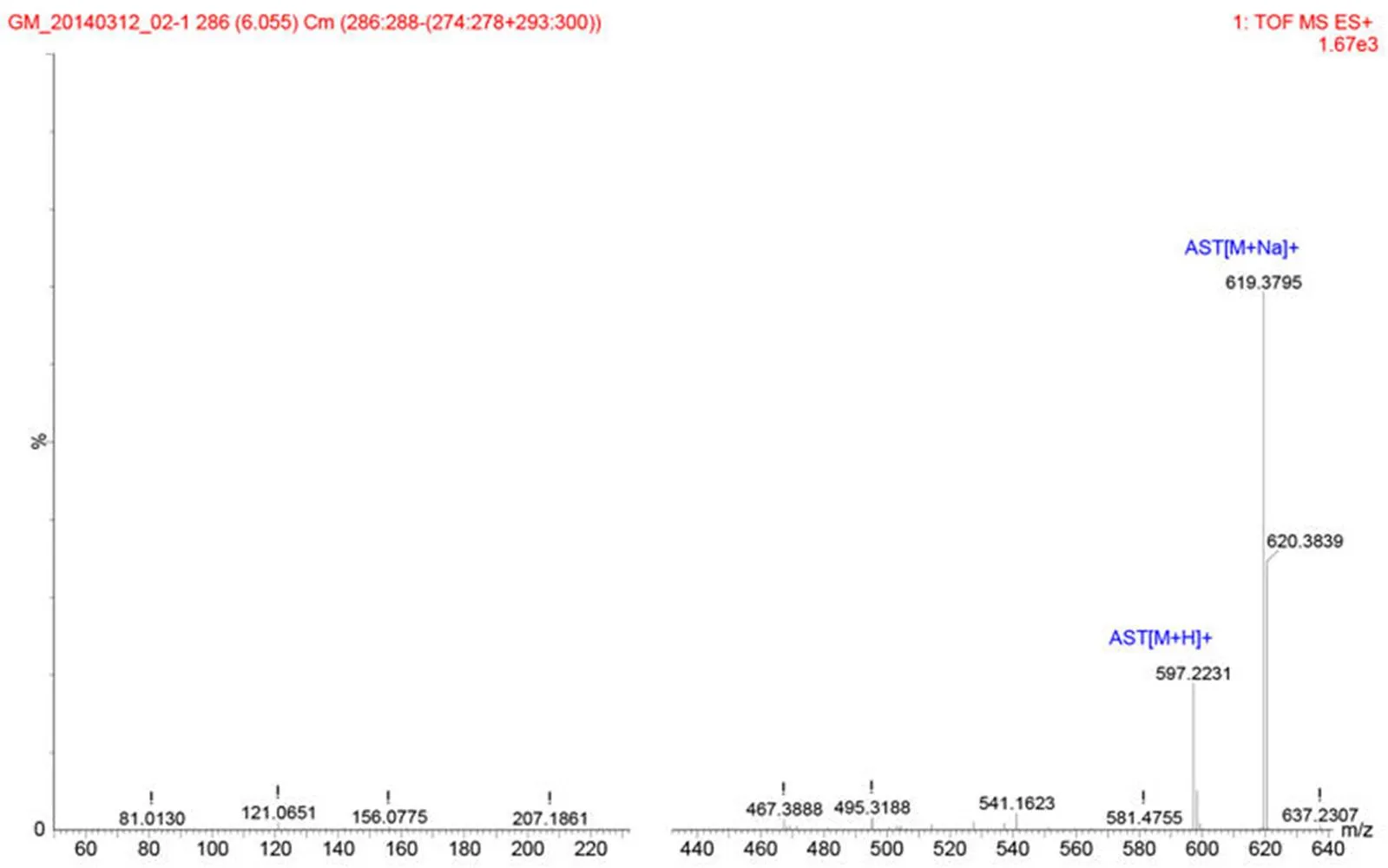
图 5 A物质(虾青素)质谱鉴定结果
Figure 5 MS results of A (Astaxanthin)
B 物质的保留时间为 9 min,该化合物的 MS 图谱(图 6)显示其分子量为 M+(568.4),与玉米黄质一致;其主要离子峰 393、444 等也与玉米黄质相符,证明该化合物为玉米黄质。
C 物质的保留时间为 11 min,该化合物的 MS 图谱(图 7)显示其分子量为 M+(565.4),与斑蝥黄质一致;其主要离子峰 133、363 等也与斑蝥黄质相符[11]。证明该化合物为斑蝥黄质。
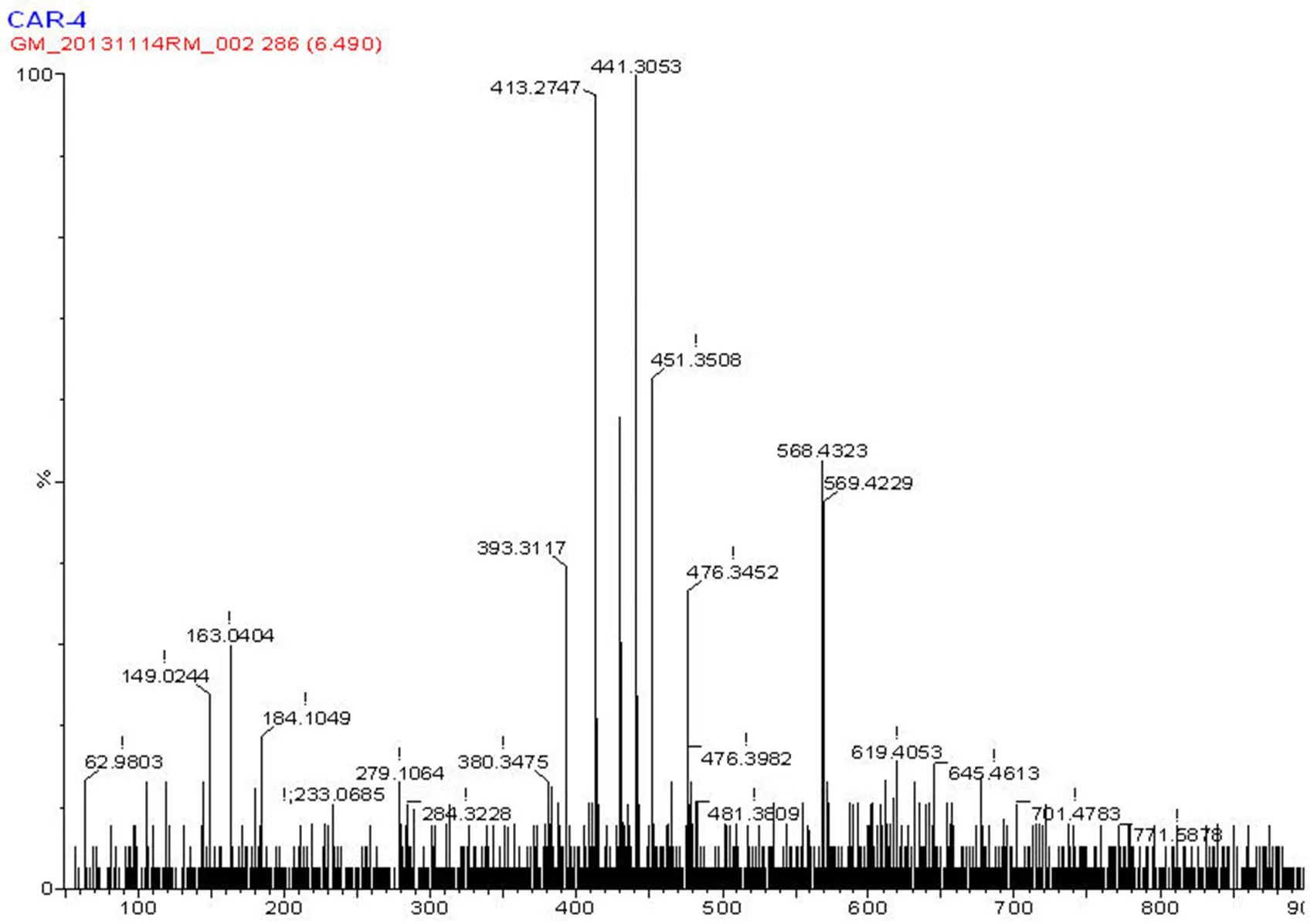
图 6 B 物质(玉米黄质)质谱鉴定结果
Figure 6 MS results of B (Zeaxanthin)
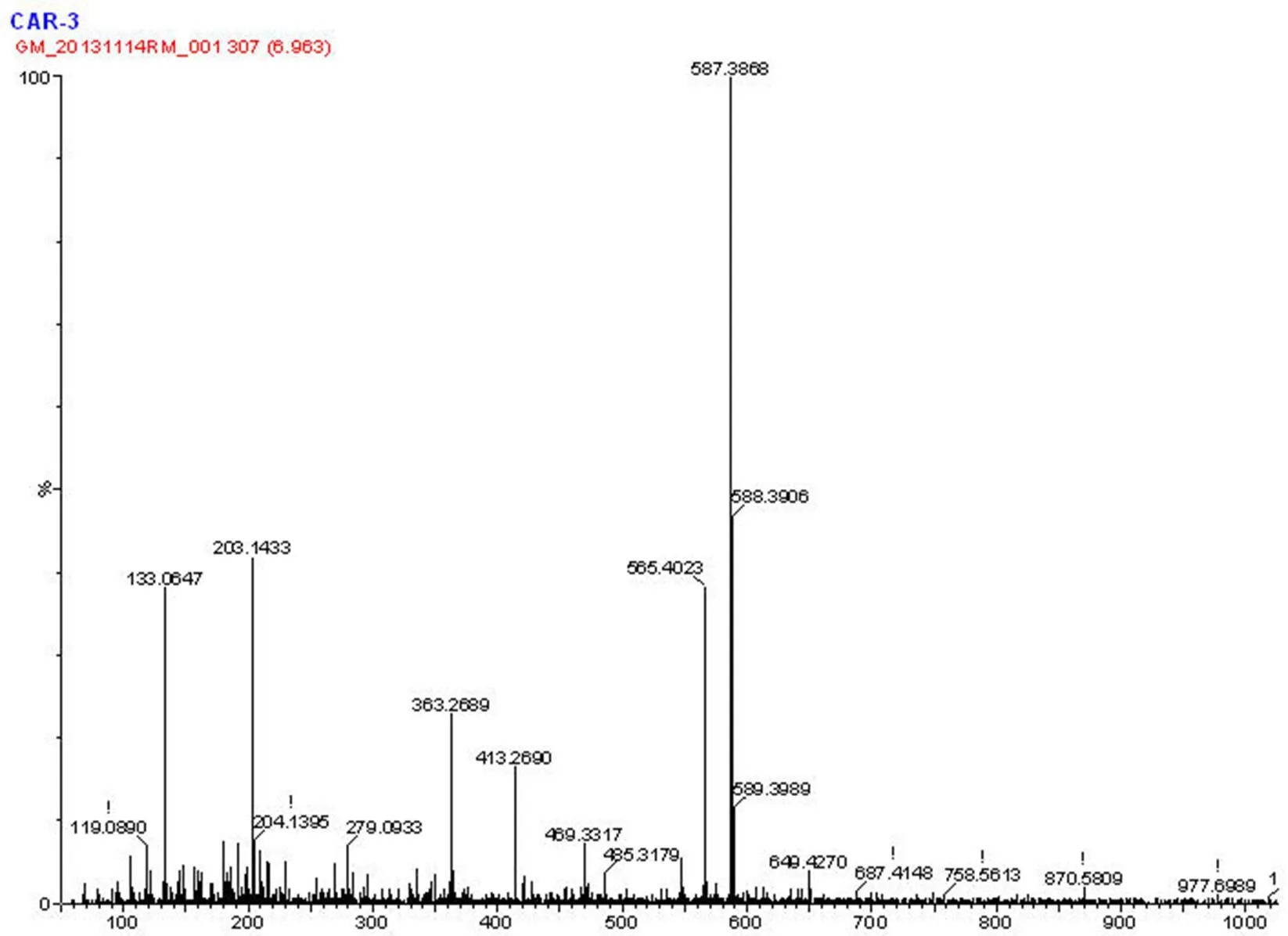
图 7 C物质(斑蝥黄质)质谱鉴定结果
Figure 7 MS results of C (Canthaxanthin)
由此,我们对 8 种工程菌相对于原始菌出现新的发酵产物进行了归类总结,见表 3。总体来看,酿酒酵母工程菌较原始菌株 HCCB08526 的单菌落均较大,颜色均加深。HPLC及 UPLC-MS 检测结果表明,工程菌HCCB08566-08573 β-胡萝卜素的产量有所下降,说明基因组合发挥了催化作用,其中 HCCB08571 和 HCCB08572 检测到虾青素成分,而 HCCB08566、HCCB08568、HCCB08573 没有检测到虾青素,但分别检测到有中间体玉米黄质与斑蝥黄质存在。
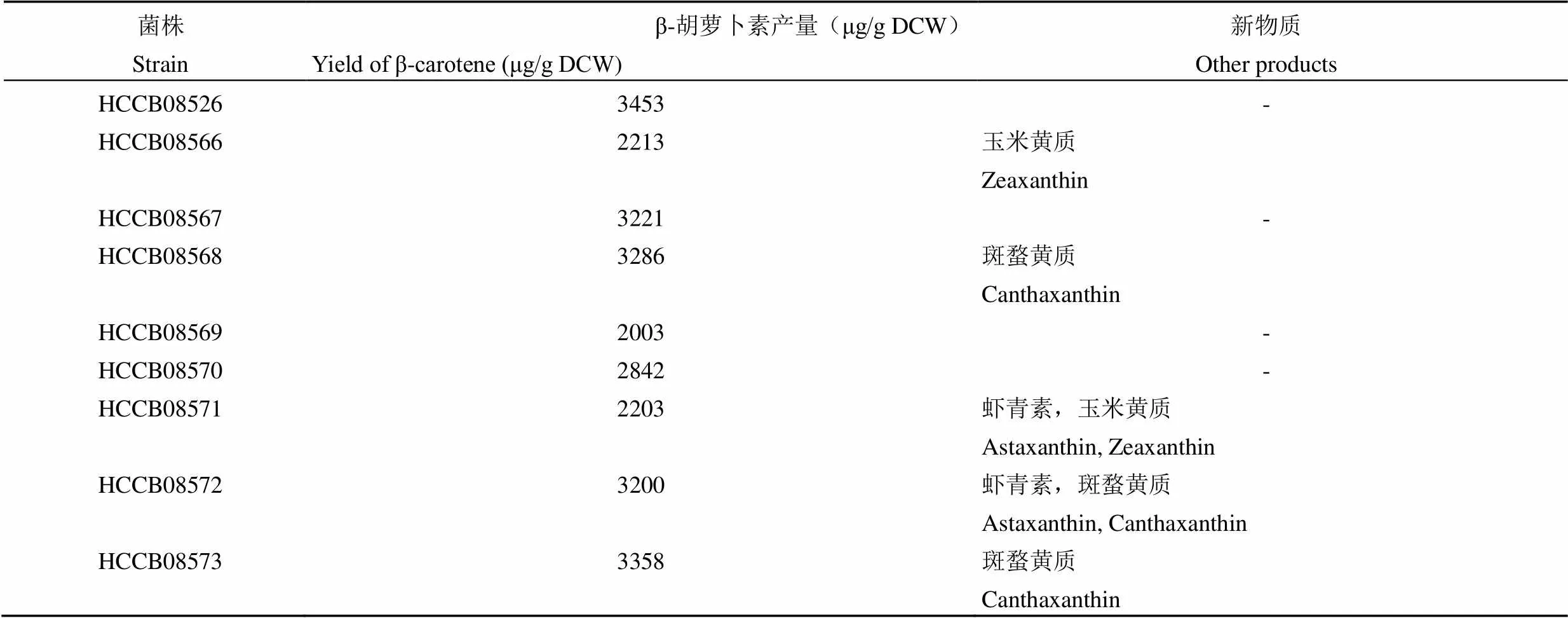
表 3 HCCB08566-08573 发酵结果
3 讨论
酿酒酵母作为一种 GRAS 模式生物[12],其毒性小,生长速度快,能在简单培养基上生长[13],是真核基因表达系统的首选。
本研究首次成功利用 HCCB08526 构建了产虾青素、斑蝥黄质、玉米黄质的酿酒酵母工程菌。从中间体的表达量可以看出,基因1、4、、1、4催化活性相对较高。不同组合的工程菌分别催化产生了虾青素、玉米黄质及斑蝥黄质。未成功合成虾青素的原因可能是构建的工程菌中的酶表达量不足以完成复杂的催化过程;前体物质不能积累到足以完成向虾青素的转化量;、基因与底物的亲和力有限等[14],有待进一步研究。
志谢 特别感谢上海医药工业研究院陈代杰研究员对本研究的经验性指导与建议。
[1] Kindlund PJ. Astaxanthin. Nutrafoods, 2011, 10(2-3):49-53.
[2] Gao SL, Zhu L, Jiang Y, et al. Construction of engineering Saccharomyces cerevisiae producing β-carotene. Ind Microbiol, 2013, 43(6):14-17. (in Chinese)
高书良, 朱丽, 蒋宇, 等. 产β-胡萝卜素酿酒酵母工程菌的构建. 工业微生物, 2013, 43(6):14-17.
[3] Ye VM, Bhatia SK. Pathway engineering strategies for production of beneficial carotenoids in microbial hosts. Biotechnol Lett, 2012, 34(8): 1405-1414.
[4] Jayaraj J, Devlin R, Punja Z. Metabolic engineering of novel ketocarotenoid production in carrot plants. Transgenic Res, 2008, 17(4):489-501.
[5] Hasunuma T, Miyazawa S, Yoshimura S, et al. Biosynthesis of astaxanthin in tobacco leaves by transplastomic engineering. Plant J, 2008, 55(5):857-868.
[6] Lee JH, Kim YT. Cloning and characterization of the astaxanthin biosynthesis gene cluster from the marine bacterium Paracoccus haeundaensis. Gene, 2006, 370:86-95.
[7] Huang JC, Zhong YJ, Liu J, et al. Metabolic engineering of tomato for high-yield production of astaxanthin. Metab Eng, 2013, 17:59-67.
[8] Lemuth K, Steuer K, Albermann C. Engineering of a plasmid-free Escherichia coli strain for improved in vivo biosynthesis of astaxanthin. Microb Cell Fact, 2011, 10:29.
[9] Lai JP, Jiang Y, He XW, et al. Seperation and determination of astaxanthin from microalgal and yeast samples by molecularly imprinted picrospheres. J Chromatogr B Analyt Technol Biomed Life Sci, 2004, 804(1):25-30.
[10] López-Cervantes J, Sánchez-Machado DI, Gutiérrez-Coronado MA, et al. Quantification of astaxanthin in shrimp waste hydrolysate by HPLC. Biomed Chromatogr, 2006, 20(10):981-984.
[11] Lu Y, Kuang BH, Zhang B. Synthesis of canthaxanthin by one step. Fine Chem, 2000, 17(2):74-75, 78. (in Chinese)
陆豫, 匡滨海, 张彬. 一步法合成斑蝥黄. 精细化工, 2000, 17(2): 74-75, 78.
[12] Botstein D, Chervitz SA, Cherry JM. Yeast as a model orgnism. Science, 1997, 277(5330):1259-1260.
[13] Liu L, Li MC, Hu GW, et al. Expression of ATCC16266△6-fatty acid desaturase gene from mortierella alpina in saccharomyces cerevisiae. Chin J Biotechnol, 2001, 17(2):161-164. (in Chinese)
刘莉, 李明春, 胡国武, 等. 高山被孢霉ATCC16266Δ6-脂肪酸脱氢酶基因在酿酒酵母中的表达. 生物工程学报, 2001, 17(2):161- 164.
[14] Li TL, Cai HN, Li LJ, et al. Research progress for biosynthetic pathway related genes of astaxanthin in Phaffia rhodozyma. Microbiol China, 2013, 40(9):1673-1685. (in Chinese)
李天丽, 蔡慧农, 李利君, 等. 法夫酵母虾青素合成途径相关基因的研究进展. 微生物学通报, 2013, 40(9):1673-1685.
Construction of recombinantproducing astaxanthin
XIE Gui-ge, ZHU Li, JIANG Yu, GE Mei, NI Meng-xiang
To construct the engineering strain producing astaxanthin by extending β-carotene metabolism pathway in.
,genes of different origins were randomly combinated to construct the tandem expression plasmids through overlap PCR techniques, and then transformed intoto obtain the engineered strain with astaxanthin synthesis. Fermented products were identified by HPLC and UPLC-MS to determine their composition.
8 patterns of gene multimers TEF1p--ADH1t-PGK1P--CYC1t were constructed, but astaxanthin was expressed by the engineered strains HCCB08571 and HCCB08572 with1-1 and1-4 combinations, respectively. The astaxanthin were not detected in the fermentants of the other engineered strains and the intermediates, zeaxanthin and canthaxanthin were found.
strains producing astaxanthin and its intermediates are successfully constructed in this study.
beta carotene; Saccharomyces cerevisiae;;; Astaxanthin
NI Meng-xiang, Email: nimx_2000@yahoo.com.cn
10.3969/cmba.j.issn.1673-713X.2014.06.006
倪孟祥,Email:nimx_2000@yahoo.com.cn
2014-04-03
Author Affiliations: College of Life Science and Technology, China Pharmaceutical University, Nanjing 210009, China (XIE Gui-ge, NI Meng-xiang); Shanghai Laiyi Biomedical Research Center, Shanghai 200240, China (ZHU Li, GE Mei); Shanghai Industrial Institute of Microbiology, Shanghai 200240, China (JIANG Yu)

