吉西他滨对肺微血管内皮细胞的损伤及表没食子儿茶素没食子酸酯的保护作用
刘旭杰,秦烨,陈淑珍
吉西他滨对肺微血管内皮细胞的损伤及表没食子儿茶素没食子酸酯的保护作用
刘旭杰,秦烨,陈淑珍
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所肿瘤室
观察吉西他滨对大鼠肺微血管内皮细胞的影响及表没食子儿茶素没食子酸酯的保护作用。
利用植块法分离大鼠肺微血管内皮细胞。SRB 法检测药物对肺微血管内皮细胞和 A549 增殖的影响。流式细胞仪用于检测细胞周期和细胞凋亡。Western blot 法检测凋亡相关蛋白含量。测定细胞内活性氧和超氧化物歧化酶水平以及乳酸脱氢酶渗透情况。
吉西他滨能显著减少肺微血管内皮细胞细胞增殖并将其阻滞于 S 期。吉西他滨引起肺微血管内皮细胞细胞凋亡具有时间依赖性,处理 24、48、72 h 后细胞凋亡率分别为 7.2%、15.4%、23.3%。同时,吉西他滨作用后细胞内活性氧含量上升,而处理 48 h 后超氧化物歧化酶水平显著下降。进一步研究发现,表没食子儿茶素没食子酸酯能够提高吉西他滨处理后肺微血管内皮细胞的存活率,并且减弱吉西他滨造成的超氧化物歧化酶水平的下降。
吉西他滨对肺微血管内皮细胞具有损伤作用,能够引起肺微血管内皮细胞的凋亡和氧化应激的发生,而表没食子儿茶素没食子酸酯对吉西他滨引起的肺微血管内皮细胞损伤具有保护作用。
内皮细胞; 氧化性应激; 儿茶酚类; 吉西他滨
吉西他滨(gemcitabine)是一种脱氧胞苷类似物,在临床上被广泛应用于胰腺癌、非小细胞肺癌、乳腺癌、卵巢癌、膀胱癌等实体瘤的治疗[1]。但随着临床应用范围的扩大,其引发严重肺毒性的报道也逐渐增多。临床研究显示,超过 23% 的患者由于使用吉西他滨,出现严重呼吸困难、弥散性肺泡损伤、间质性肺炎等肺部症状[2]。严重肺损伤限制了化疗的延续性和患者的生活质量。因此,研究吉西他滨导致肺损伤的机制并加以改善是提高其临床效果的一个重要方向。
肺微血管内皮细胞(pulmonary microvascular endothelial cells,PMVECs)是肺泡毛细血管单位的基本组成部分,在维持内稳态及引发炎症等方面发挥重要作用。PMVECs 易于受到吸入性或肺循环中毒剂的影响,引发动物和人的急性肺损伤[3]。研究显示,氧化应激是药物诱发肺毒性的损伤机制之一,其能够引发细胞凋亡、炎症反应、血管结构和功能的异常[4]。体内活性氧(reactive oxygen species,ROS)水平的上升或氧化防御机制的失调,均能引发氧化应激。已有报道,多种胰腺癌细胞对吉西他滨的敏感性与细胞内 ROS 水平正相关[5]。
本论文通过分离大鼠肺微血管内皮细胞并进行体外培养,分别从细胞凋亡和氧化应激两方面研究吉西他滨对 PMVECs 的影响。表没食子儿茶素没食子酸酯(EGCG)是从绿茶中提取的多酚类物质,属于儿茶素家族,具有抗增殖、抗突变、抗氧化、防癌等多种作用[6]。本文同时探索 EGCG 对吉西他滨引起 PMVECs 损伤的保护作用。
1 材料与方法
1.1 材料
1.1.1 动物 雄性Sprague-Dawley 大鼠(SPF 级),购自军事医学科学院动物中心,体重 100~120 g,动物合格证号:SCXK-(军)2012-0004。
1.1.2 细胞株 人非小细胞肺癌 A549 为本实验室保存。
1.1.3 试剂和试剂盒 吉西他滨购自中国食品药品检定研究院,批号:100622-201202;EGCG 购自江西绿康天然产物有限责任公司,纯度为 98%,批号:D98-120602;ROS 荧光探针CM-H2DCFDA 购自美国 Invitrogen 公司;磺基罗丹明B(SRB)、PI 均购自美国 Sigma Aldrich 公司;DMEM 高糖培养基、RPMI 1640 培养基均购自美国 Hyclone 公司;胎牛血清购自美国 Gibco 公司;小鼠抗大鼠 CD31 抗体购自美国 Abcam 公司;兔抗 caspase-3 抗体、兔抗 PARP 抗体均购自美国 CST 公司;小鼠抗 β-actin 抗体购自天津三箭生物技术有限公司;罗丹明标记的山羊抗小鼠 IgG 抗体、辣根酶标记山羊抗小鼠/兔 IgG 抗体均购自北京中杉金桥生物技术有限公司;化学发光 HRP 底物试剂盒购自美国 Millipore 公司;RIPA 细胞裂解液购自北京 GenStar 公司;Annexin V-FITC/PI 凋亡试剂盒购自北京宝赛生物公司;乳酸脱氢酶(LDH)细胞毒性检测试剂盒、总超氧化物歧化酶(SOD)活性检测试剂盒均购自碧云天生物技术研究所。
1.1.4 仪器 TE2000-U 型荧光显微镜为日本 Nikon 公司产品;Multiskan MK 3 酶标仪为美国 Thermo 公司产品;Coulter epics XL 流式细胞仪为美国 Beckman 公司产品。
1.2 方法
1.2.1 大鼠 PMVECs 的分离、培养和鉴定 选用体重 100~120 g 的健康雄性 SD 大鼠,参考文献[7-8],按植块培养方法进行大鼠 PMVECs 的原代培养。同时应用抗 CD31 抗体进行免疫荧光法鉴定,取其中 3 ~ 5 代细胞用于实验研究。
1.2.2 细胞培养 人非小细胞肺癌 A549 培养于含 10% 胎牛血清的 RPMI 1640 培养基中,于 37 ℃、5% CO2条件下培养。
1.2.3 SRB 法检测细胞增殖抑制活性 取对数生长期的细胞,每孔 100 μl 接种于 96 孔培养板,置于培养箱,经 24 h 贴壁后,每孔加入 100 μl 不同浓度的药液;继续培养 48~72 h 后,弃去培养基并加入 100 μl 10% 三氯乙酸溶液,于 4 ℃固定 1 h,用蒸馏水冲洗 5 次后晾干;然后加入 0.4% SRB,染色 5 min,用 1% 乙酸溶液冲洗 5 次后晾干;加入 100 μl Tris 溶液(10 mmol/L)溶解结合的 SRB;使用酶标仪于 560 nm 波长读取各孔光吸收值。
1.2.4 Annexin V-FITC/PI 染色法检测细胞凋亡 取对数生长期的细胞培养于 25 cm2细胞培养瓶(5 × 105个/瓶);培养 24 h 后加入不同浓度的药物进行培养,依据试剂盒操作步骤进行样品处理,然后使用流式细胞仪检测凋亡细胞比例。
1.2.5 细胞周期分析 细胞以 5 × 105个/瓶接种于 25 cm2细胞培养瓶;经 24 h 培养贴壁后,加入 1 μmol/L 吉西他滨分别处理 24、48、72 h;利用胰酶消化收集细胞,并用 70% 乙醇溶液于–20 ℃固定过夜;使用 50 μg/ml PI 染色 30 min 后,流式细胞仪检测细胞周期。
1.2.6 Western blot 检测 将待检测细胞置于冰上,并用 RIPA 细胞裂解液处理细胞 30 min,收集细胞裂解液;于 4 ℃使用 12 000 ×离心细胞裂解液 15 min,并收集上清;然后利用 12% 凝胶进行 SDS-PAGE 电泳,并转至 PVDF 膜上;使用 5% 脱脂牛奶溶液封闭膜上非特异抗原位点,再加入相应一抗(1:1000 稀释)4 ℃孵育过夜,并用 TBST 洗 5 次;然后加入对应二抗(1:4000 稀释),再用 TBST 洗 5 次;使用 HRP 底物试剂盒进行显影。
1.2.7 ROS 含量检测 以 5 × 103个/孔将 PMVECs 种于 96 孔黑壁透明底培养板,培养24 h 使其贴壁;给予 0.1、1、10 μmol/L 吉西他滨处理 12 h;药物处理后,使用 PBS 洗 1 次,并加入 10 μmol/L CM-H2DCFDA作用 30 min;使用荧光酶标仪读取各孔荧光强度。使用以下公式计算各孔荧光强度增值百分比:
荧光增值百分比=[(F1– F0)/F0]× 100%,其中,F1为给药组荧光强度;F0为对照组荧光强度。
1.2.8 乳酸脱氢酶细胞毒性检测 根据乳酸脱氢酶细胞毒性检测试剂盒操作步骤,检测 0.1、1、10 μmol/L 吉西他滨处理后,PMVECs 细胞培养液上清中 LDH 含量的变化。
1.2.9 细胞内 SOD 活性检测 以0.1、1、10 μmol/L 药物浓度处理细胞48、72 h,按照总 SOD 活性检测试剂盒操作步骤,利用 WST 法进行样品处理,并用酶标仪在 450 nm 波长处检测值。
1.3 统计学处理
2 结果
2.1 PMVECs 形态学及免疫荧光鉴定结果
通过显微镜观察,植块贴壁后,血细胞首先从组织块边缘游出;培养 24 h 后,PMVECs开始由植块周围爬出,贴壁生长;继续培养至 60 ~ 72 h 间,晃动培养瓶使组织块脱落并吸弃,避免成纤维细胞爬出。培养至 9 d,细胞基本汇合成片后,进行传代培养。由于血细胞不贴壁,随传代操作被弃去。PMVECs 在显微镜下呈现上皮样细胞形态,汇集成片后,呈铺路石样排列生长(图 1A、B)。与 PBS 替代一抗的阴性对照组相比,PMVECs 的免疫荧光检测呈现 CD31 抗原阳性表达(图 1C、D)。
2.2 吉西他滨对 PMVECs 和 A549 的增殖抑制活性
为了评估吉西他滨的血管损伤作用,使用不同浓度(0.01、0.03、0.1、0.3、1、3、10 μmol/L)吉西他滨分别处理 PMVECs 和 A549 细胞 48 和 72 h。然后利用 SRB 法检测细胞存活率。结果显示,吉西他滨对两种细胞的抑制增殖作用具有浓度依赖性和时间依赖性(图 2),而且对于两种细胞来说,吉西他滨的抑制作用均在 0.03 ~ 1 μmol/L 浓度范围内呈现显著变化。因此,吉西他滨在抑制肿瘤细胞生长的浓度范围内对 PMVECs 亦有损伤作用。
2.3 吉西他滨对 PMVECs 产生 S 期阻滞作用
为了进一步说明吉西他滨抑制细胞增殖的机制,我们检测了 1 μmol/L 吉西他滨处理 24、48 和 72 h 后,PMVECs 细胞周期的变化。结果显示,吉西他滨处理后 S 期细胞所占比例增加,并呈现时间依赖性,药物处理 24、48 和 72 h 相对应的S 期细胞比例为 15.0%、27.4%、35.5%、47.2%;G2/M 期细胞显著减少(图 3)。同时,Sub-G1峰比例逐渐增加,说明吉西他滨引起细胞周期阻滞,继而导致细胞凋亡发生。
2.4 吉西他滨诱导 PMVECs 凋亡
细胞凋亡也是药物引起损伤的一个表现,本研究利用 Annexin V/PI 染色法检测细胞凋亡情况。1 μmol/L 吉西他滨处理细胞后,PMVECs 的凋亡率随时间延长而增加;与对照组 6.2% 的凋亡率比较,药物作用 24、48 和 72 h 相对应的凋亡率分别为 7.2%、15.4%、23.3%(图 4A)。吉西他滨引起的细胞凋亡也具有浓度依赖性,药物浓度为 0.1、1、10 μmol/L 时细胞凋亡率为 6.9%、13.7%、11.6%,而对照组为 6.9%。为了进一步说明吉西他滨处理与 PMVECs 细胞凋亡的关系,利用Western blot对细胞内凋亡相关蛋白的表达及活化情况进行了检测。根据图 4C 显示,吉西他滨作用 48 h 后能够激活 PMVECs 细胞内 caspase-3,同时也上调 PARP 剪切体的含量。由此可以判断,吉西他滨能够诱导 PMVECs 细胞凋亡。
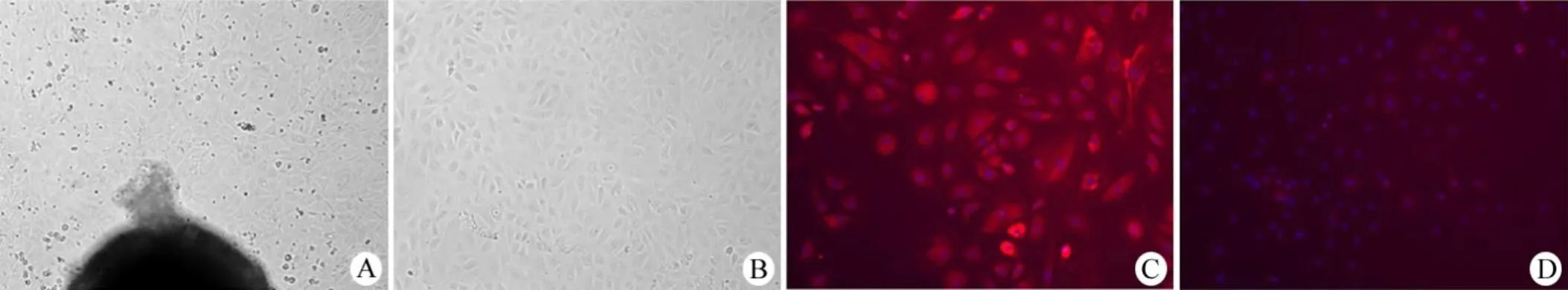
图 1 PMVECs 的原代培养(A:组织块贴壁后 60 h 细胞生长状态;B:90 h 后细胞生长状态)和使用抗 CD31 抗体进行 PMVECs 免疫荧光鉴定(红色表示 CD31 位点;蓝色表示细胞核;C:鉴定组,一抗和二抗;D:对照组,PBS 和二抗)(× 100)
Figure 1 Primary culture of PMVECs (A: The proliferation of PMVECs in 60 h after explants adhered to flasks; B: The proliferation of PMVECs in 90 h) and PMVECs identified with CD31 antibody by immunofluorescence staining (Red color represents CD31; Blue color indicates nuclei; C: Identification, primary antibody and secondary antibody; D: Control, PBS and secondary antibody) (× 100)
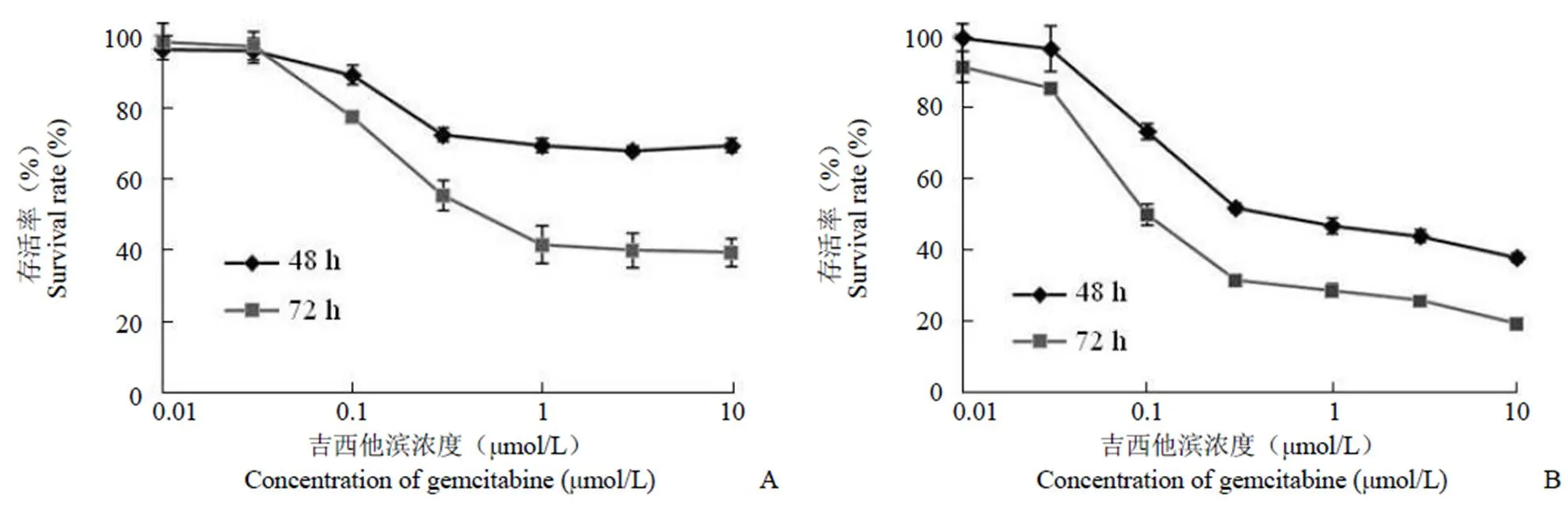
图 2 吉西他滨对于 PMVECs(A)和 A549(B)的抑制增殖作用(n = 4)
Figure 2 Anti-proliferation effects of gemcitabine in PMVECs (A) and A549 (B) cells (n = 4)
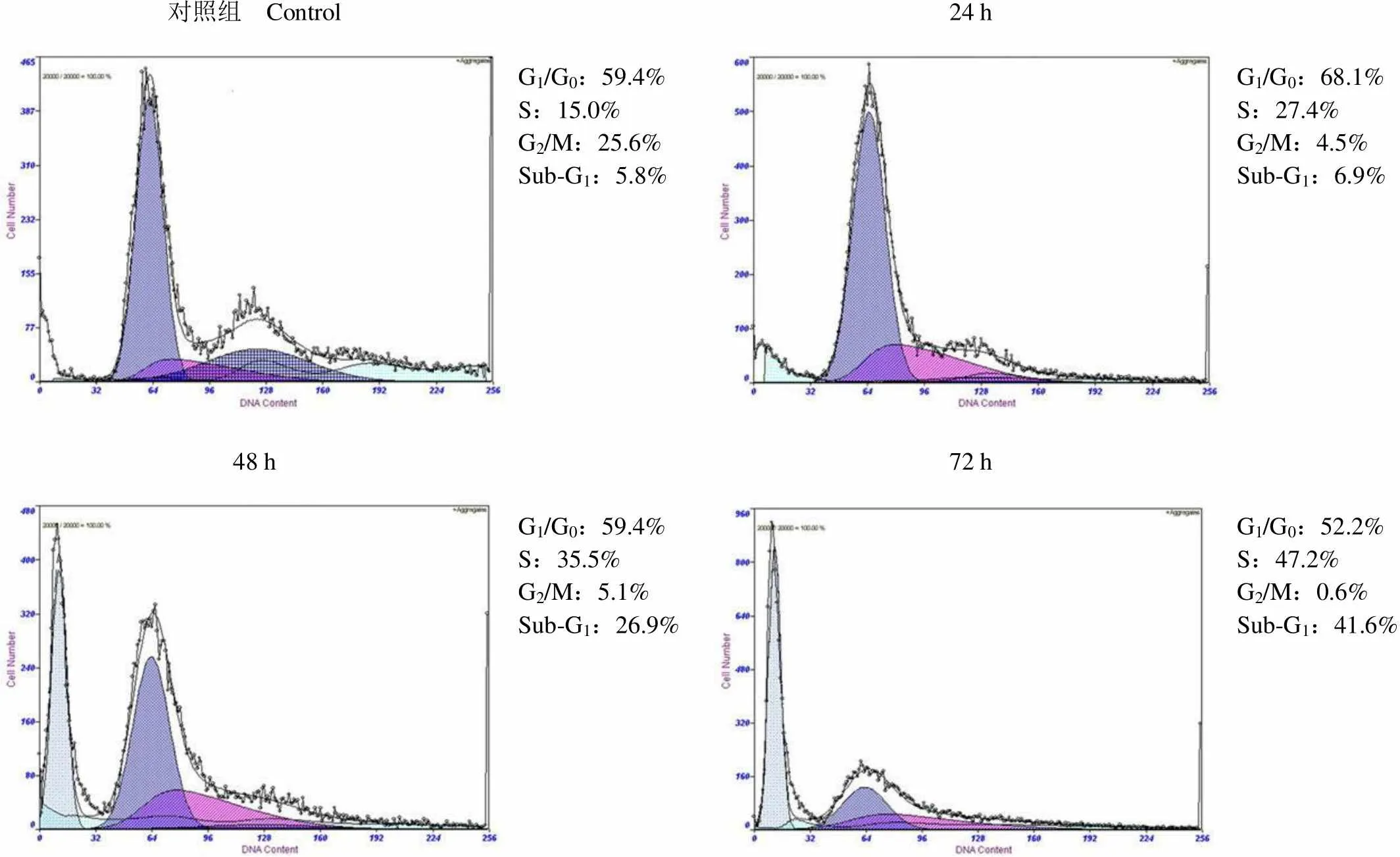
对照组 Control24 h G1/G0:59.4%S:15.0%G2/M:25.6%Sub-G1:5.8%G1/G0:68.1%S:27.4%G2/M:4.5%Sub-G1:6.9% 48 h72 h G1/G0:59.4%S:35.5%G2/M:5.1%Sub-G1:26.9%G1/G0:52.2%S:47.2%G2/M:0.6%Sub-G1:41.6%
Figure 3 Effects of gemcitabine on the regulation of cell cycle distribution in PMVECs
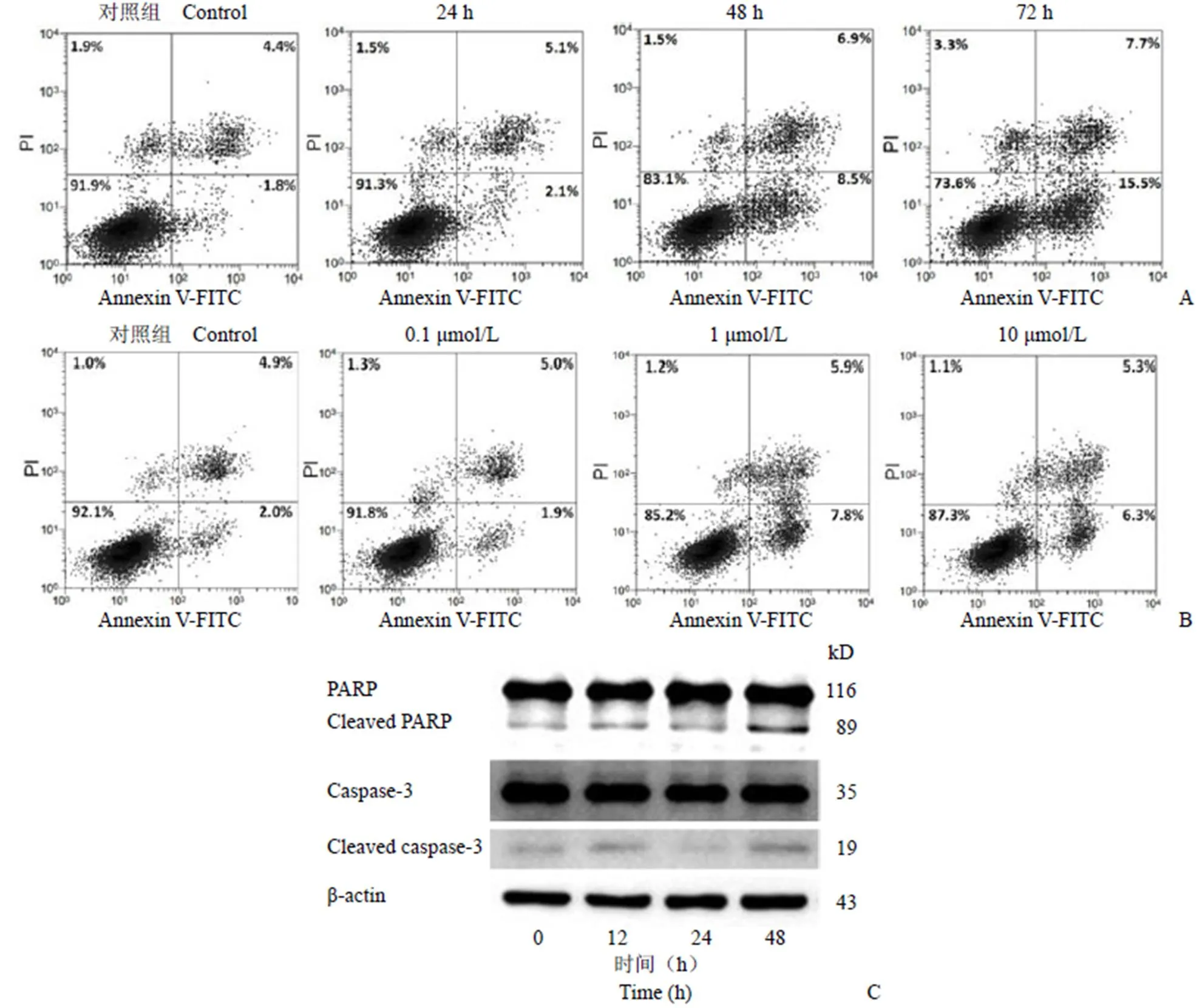
图 4 吉西他滨引起 PMVECs 细胞凋亡(A:不同作用时间对细胞凋亡的影响;B:不同药物浓度对细胞凋亡的影响;C:凋亡相关蛋白表达情况)
Figure 4 Gemcitabine caused apoptosis of PMVECs (A: Cell apoptosis at the different times; B: Cell apoptosis at the different concentrations of gemcitabine; C: The expression of apoptosis-related proteins)
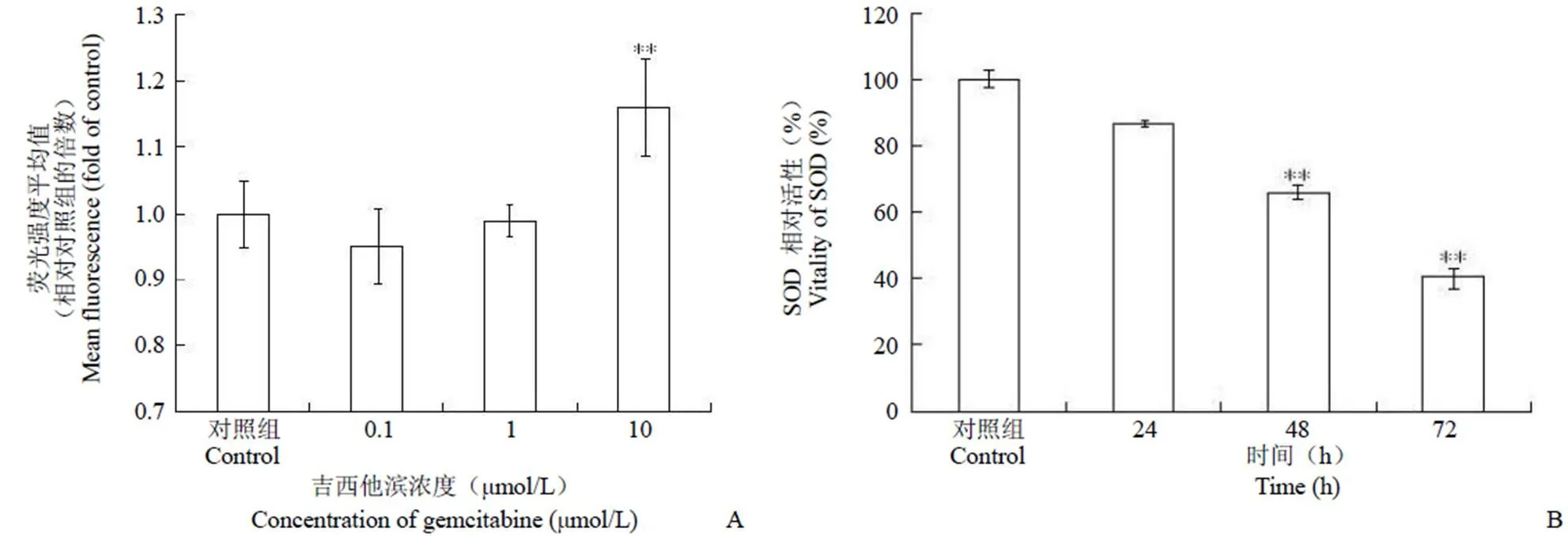
图 5 吉西他滨处理后 PMVECs 产生氧化应激(A:ROS 含量;B:SOD 活性)(**P < 0.01,n = 3)
Figure 5 Gemcitabine induced oxidative stress in PMVECs (A: ROS; B: SOD) (**< 0.01, n = 3)
2.5 吉西他滨处理后 PMVECs 产生氧化应激
2.5.1 细胞内 ROS 含量的检测 通过检测细胞内 ROS 含量,判断 PMVECs 经过吉西他滨处理后是否出现氧化应激。由于 CM-H2DCFDA 能够进入细胞,与细胞内 ROS 反应生成荧光物质,所以可以通过产生的荧光强度对细胞内 ROS 进行定量分析。PMVECs 在不同浓度吉西他滨处理 12 h 后,10 μmol/L 药物组细胞内荧光强度出现明显提升(**< 0.01),相对对照组增值为(16.0 ± 7.3)%(图 5A)。
2.5.2 细胞内 SOD 水平的检测 除了检查 ROS 水平,我们进一步检测了细胞内氧化防御机制中关键酶 SOD 的活性。经过吉西他滨处理后,细胞内 SOD 水平显著下降(**< 0.01)。吉西他滨处理 24、48、72 h 后,细胞内 SOD 活力分别相当于对照组的(86.2 ± 0.9)%、(65.9 ± 2.0)%、(40.2 ± 2.9)%(图 5B)。
2.5.3 LDH 细胞毒性检测 为了检测细胞氧化应激后是否出现膜损伤,进行了 LDH 细胞毒性检测,通过细胞培养基上清中 LDH 含量反映细胞膜受损情况。图 6 显示细胞培养基上清中 LDH 含量随吉西他滨浓度增加而显著上升,同时随着作用时间延长,LDH 含量也有所提高。相对对照组,10 μmol/L 吉西他滨作用 48 和 72 h 对应的 LDH 相对增值为(21.1 ± 7.8)%、(28.8 ± 6.5)%,具有显著性差异(**< 0.01)。
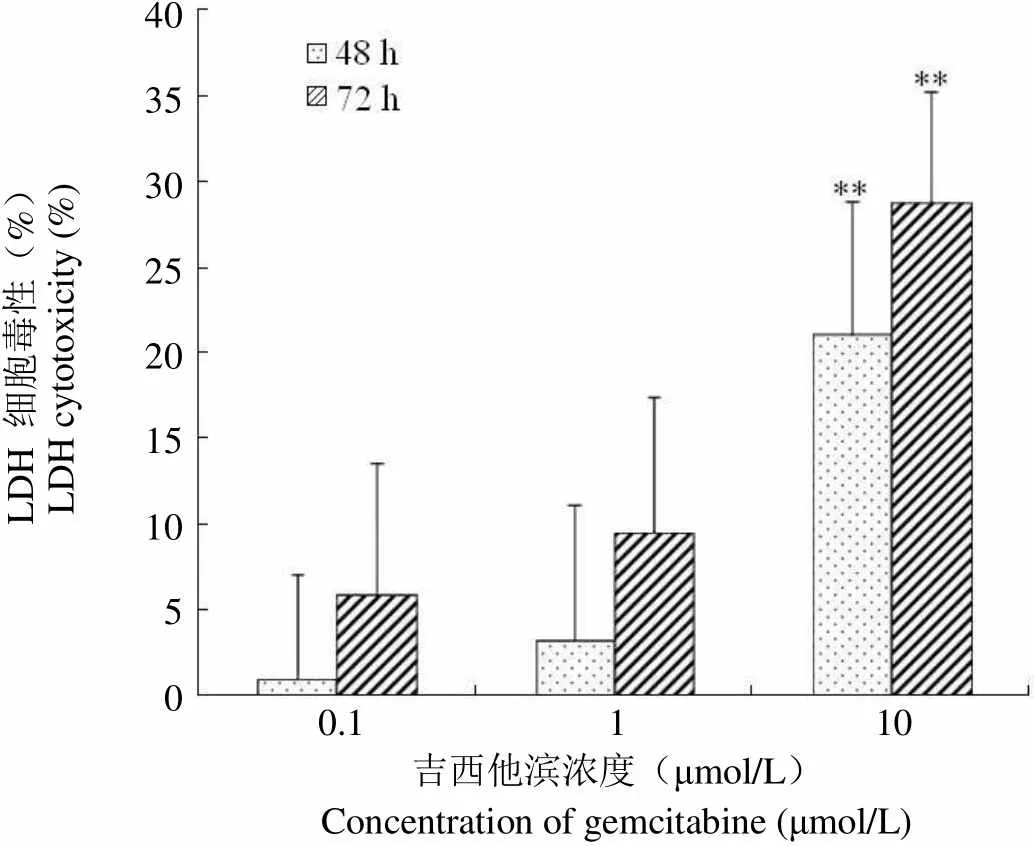
LDH 细胞毒性(%)LDH cytotoxicity (%)4035302520151050 0.1 1 10 吉西他滨浓度(μmol/L)Concentration of gemcitabine (μmol/L)
Figure 6 LDH cytotoxicity assay of PMVECs with gemcitabine (**< 0.01, n = 3)
2.6 EGCG 对吉西他滨损伤 PMVECs 的保护作用
2.6.1 EGCG 增加 PMVECs 存活率 通过 SRB 法检测多种血管保护药对吉西他滨损伤PMVECs 的作用,我们发现 EGCG 具有保护作用。如图 7 显示,EGCG 单药或与吉西他滨联用时均能显著提高 PMVECs 的存活(*< 0.05),并具有浓度依赖性。其中 0.1和1 μmol/L 吉西他滨单药处理后, PMVECs 存活率分别为(96.4 ± 2.4)%、(54.3 ±2.7)%,而 25 μmol/L EGCG 与 0.1、1 μmol/L 吉西他滨联用时,存活率分别为(127.9 ± 20.9)% 和(64.4 ± 4.1)%;而 EGCG 对于吉西他滨抑制肺癌 A549 细胞的作用并无明显影响(图 7)。
2.6.2 EGCG 提高 PMVECs 细胞内 SOD 水平 检测细胞内总 SOD 活性的结果如图 8 所示,25 μmol/L EGCG 单药组与阴性对照组相比,PMVECs 内 SOD 活性增加了(30.2 ± 2.0)%,(**< 0.01)。同时,25 μmol/L EGCG 和 1 μmol/L吉西他滨联用组与 1 μmol/L 吉西他滨单药组比较,SOD 活性提高了(30.1 ± 9.0)%(**< 0.01)。因此,说明 EGCG 能够提高 PMVECs 细胞内 SOD 水平,一定程度逆转吉西他滨引起的 SOD 水平下降。
Figure 7 Effects of EGCG and gemcitabine on the survival of PMVECs (A) and A549 (B) cells (*< 0.05)
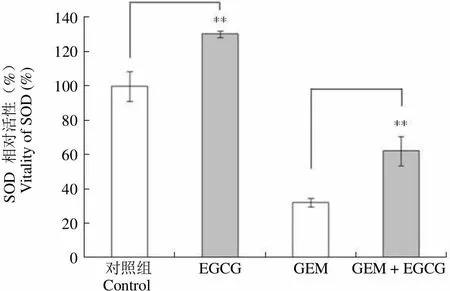
SOD 相对活性(%)Vitality of SOD (%)140120100806040200 对照组 EGCG GEM GEM + EGCG Control
Figure 8 Effects of EGCG and gemcitabine on the activity of SOD in PMVECs (EGCG: 25 μmol/L; GEM: 1 μmol/L;**< 0.01, n = 3)
3 讨论
理想的抗癌药物应能够在抑制肿瘤细胞的同时不影响正常组织细胞的功能。因此,研究目前抗癌药物的副作用并加以改善是探索理想药物的捷径。在目前的临床实践中,吉西他滨是最常见的抗肿瘤药物之一,被 FDA 批准用于治疗多种肿瘤。然而,Belknap 等[9]的研究显示,1997 – 2003 年,关于吉西他滨引起肺毒性的报告有 178 篇。而针对吉西他滨引发的肺损伤,主要通过停止给予吉西他滨并使用甾体类药物治疗,如甲基强的松龙,但仍有一部分患者出现致死症状[10-12]。有研究表明,急性肺损伤与药物引起的肺血管内皮细胞损伤有关[3]。本文通过分离大鼠 PMVECs,研究吉西他滨对大鼠 PMVECs 的体外作用。与吉西他滨对肺癌 A549 细胞的作用相似,其对 PMVECs 具有时间依赖性和浓度依赖性的抑制增殖作用,并具有S 期阻滞作用。因此,吉西他滨发挥抗癌作用的同时也抑制了 PMVECs 的活性。
吉西他滨作为脱氧胞苷类似物,能够掺入 DNA 合成并干扰 DNA 复制。有文献报道,吉西他滨的细胞毒作用主要是掺入 DNA 并启动细胞凋亡进程,而不是仅终止 DNA 复制[13-14]。我们的结果显示,吉西他滨引起的细胞凋亡率主要随药物作用时间延长而提高,但当药物浓度达到一定水平后凋亡率变化无明显浓度依赖性。同时,细胞内凋亡相关蛋白 caspase-3 和 PARP 的检测也说明吉西他滨能够引起 PMVECs 凋亡。而以上结果中,吉西他滨引起的细胞凋亡并不是十分明显。因此,凋亡可能是吉西他滨损伤肺微血管内皮细胞的一个途径,而不是主要的损伤途径。吉西他滨引起的内皮损伤可能是多种机制综合的结果,我们同时检测了氧化应激在此过程中发挥的作用。
细胞内 ROS 水平的稳定是影响细胞氧化还原平衡和细胞增殖的重要因素。虽然细胞具有精密的氧化调控机制,但是许多抗肿瘤药物仍能引起细胞的氧化应激。氧化应激一方面参与对肿瘤细胞的细胞毒作用,如吉西他滨能够提升 A549 细胞的 ROS 水平[15];另一方面引起对正常组织的损伤,如吉西他滨的结构类似物阿糖胞苷能够通过引发氧化应激而促进体外培养的大脑皮层神经元细胞凋亡[16]。同时,大量文献显示,ROS 的产生能够诱导内皮细胞凋亡,进而引发血管损伤[17-19]。我们通过检测吉西他滨对 PMVECs 细胞内 ROS 和 SOD 的影响发现,吉西他滨能够降低细胞内氧化防御机制关键酶 SOD 的活性,并提升 ROS 水平。LDH 细胞毒性显示吉西他滨处理后的 PMVECs 出现细胞膜渗漏的现象。这些结果说明,吉西他滨能够通过氧化途径损伤 PMVECs。
EGCG 具有一定的心血管保护作用,包括调节内皮功能紊乱、心肌肥大、高血压、心肌细胞损伤等作用[20]。本文实验结果表明,EGCG 在相对小剂量(25 μmol/L)时与吉西他滨联用能够减弱吉西他滨对 PMVECs 的增殖抑制作用,而在相应药物剂量下并未影响吉西他滨对肺癌 A549 细胞的抑制作用,表现出对正常内皮细胞和肿瘤细胞的不同作用效果。同时,EGCG 也能增加 PMVECs 细胞内 SOD 的活性,此种作用可能是 EGCG 显示出对 PMVECs 具有保护作用的原因。然而,EGCG 对 A549 细胞并未显示出保护作用,推断 ROS 在吉西他滨对 A549 细胞的细胞毒性中作用微弱,而在 PMVECs 损伤中具有较大影响;具体原因尚需要进一步探索。总之,EGCG 对吉西他滨作用于肿瘤细胞和正常血管内皮的影响具有差异。
综上所述,吉西他滨能够引起肺微血管内皮细胞损伤,而这种损伤作用一方面通过增加细胞凋亡产生,另一方面通过引起细胞的氧化应激介导。而 EGCG 能够在不影响吉西他滨对肿瘤细胞的抑制作用下,减弱吉西他滨引起的内皮细胞损伤。吉西他滨与 EGCG 的联用方式有待于进一步研究,可为减缓吉西他滨所引起的肺毒性提供帮助。
[1] Gesto DS, Cerqueira NM, Fernandes PA, et al. Gemcitabine: a critical nucleoside for cancer therapy. Curr Med Chem, 2012, 19(7):1076- 1087.
[2] Saif MW. Pulmonary toxicity associated with gemcitabine. JOP, 2010, 11(2):189-190.
[3] Orfanos SE, Mavrommati I, Korovesi I, et al. Pulmonary endothelium in acute lung injury: from basic science to the critically ill. Intensive Care Med, 2004, 30(9):1702-1714.
[4] Lum H, Roebuck KA. Oxidant stress and endothelial cell dysfunction. Am J Physiol Cell Physiol, 2001, 280(4):C719-C741.
[5] Donadelli M, Costanzo C, Beghelli S, et al. Synergistic inhibition of pancreatic adenocarcinoma cell growth by trichostatin A and gemcitabine. Biochim Biophys Acta, 2007, 1773(7):1095-1106.
[6] Schramm L. Going green: the role of the green tea component EGCG in chemoprevention. J Carcinog Mutagen, 2013, 4(142):1000142.
[7] Li M, Yang MH, Liu Y. Comparison and improvement of rat pulmonary microvascular endothelial cell culture methods. J Clin Rehabil Tissue Eng Res, 2008, 12(31):6141-6144. (in Chinese)
李敏, 杨明会, 刘毅. 大鼠肺微血管内皮细胞培养方法的对比和改进. 中国组织工程研究与临床康复, 2008, 12(31):6141-6144.
[8] Vichai V, Kirtikara K. Sulforhodamine B colorimetric assay for cytotoxicity screening. Nat Protoc, 2006, 1(3):1112-1116.
[9] Belknap SM, Kuzel TM, Yarnold PR, et al.Clinical features and correlates of gemcitabine-associated lung injury: findings from the RADAR project. Cancer, 2006, 106(9):2051-2057.
[10] Hiraya D, Kagohashi K, Sakamoto N, et al. Gemcitabine-induced pulmonary toxicity in a patient with pancreatic cancer. JOP, 2010, 11(2):186-188.
[11] Galvão FH, Pestana JO, Capelozzi VL. Fatal gemcitabine-induced pulmonary toxicity in metastatic gallbladder adenocarcinoma. Cancer Chemother Pharmacol, 2010, 65(3):607-610.
[12] Yakabe T, Kitahara K, Komiya K, et al. Severe eosinophilic pneumonia presenting during gemcitabine adjuvant chemotherapy. World J Surg Oncol, 2013, 11:167.
[13] Huang P, Plunkett W. Induction of apoptosis by gemcitabine. Semin Oncol, 1995, 22(4 Suppl 11):19-25.
[14] Ostruszka LJ, Shewach DS. The role of DNA synthesis inhibition in the cytotoxicity of 2′, 2′-difluoro-2′-deoxycytidine. Cancer Chemother Pharmacol, 2003, 52(4):325-332.
[15] Zhao C, Gao W, Chen T. Synergistic induction of apoptosis in A549 cells by dihydroartemisinin and gemcitabine. Apoptosis, 2014, 19(4):668-681.
[16] Geller HM, Cheng KY, Goldsmith NK, et al. Oxidative stress mediates neuronal DNA damage and apoptosis in response to cytosine arabinoside. J Neurochem, 2001, 78(2):265-275.
[17] Du XL, Sui GZ, Stockklauser-Färber K, et al. Introduction of apoptosis by high proinsulin and glucose in cultured human umbilical vein endothelial cells is mediated by reactive oxygen species. Diabetologia, 1998, 41(3):249-256.
[18] Cai H. Hydrogen peroxide regulation of endothelial function: origins, mechanisms, and consequences. Cardiovasc Res, 2005, 68(1):26-36.
[19] Coyle CH, Martinez LJ, Coleman MC, et al. Mechanisms of H2O2-induced oxidative stress in endothelial cells. Free Radic Biol Med, 2006, 40(12):2206-2213.
[20] Khurana S, Venkataraman K, Hollingsworth A, et al. Polyphenols: benefits to the cardiovascular system in health and in aging. Nutrients, 2013, 5(10):3779-3827.
Damage of gemcitabine towards pulmonary microvascular endothelial cells and protective effects of EGCG
LIU Xu-jie, QIN Ye, CHEN Shu-zhen
To investigate the damage of gemcitabine on rat pulmonary microvascular endothelial cells and the protective effect of EGCG.
PMVECs were isolated by modification of a tissue explant method. SRB assay was used to investigate the growth of PMVECs and A549 cells. Flow cytometry was applied to measure the cell cycle and apoptosis. Western blot was used to determine the content of apoptosis-related proteins. The activities of ROS, SOD and LDH were examined with microplate reader.
The exposure to gemcitabine decreased the survival of PMVECs and arrested PMVECs at S phase. Gemcitabine increased the number of apoptotic cells time-dependently and the percentage of apoptotic cells treated for 24, 48, 72 h were 7.2%, 15.4%, 23.3%, respectively. Meanwhile, intracellular ROS level of PMVECs was elevated and after 48 h the SOD level was lowered markedly after gemcitabine treatment. Further investigation revealed that EGCG increased cell viability of PMVECs with or without gemcitabine and augmented the intracellular SOD level of PMVECs reduced by gemcitabine.
These results suggest that gemcitabine injures PMVECs by inducing pulmonary endothelial cell apoptosis and oxidative stress. EGCG exerts the protective effect on gemcitabine-induced endothelial cells injury.
Endothelial cells; Oxidative stress; Catechols; Gemcitabine
CHEN Shu-zhen, Email: bjcsz@imb.pumc.edu.cn
10.3969/cmba.j.issn.1673-713X.2014.06.005
国家自然科学基金(81072664、81373437);“重大新药创制”国家科技重大专项(2012ZX09301002-001-022-01)
陈淑珍,Email:bjcsz@imb.pumc.edu.cn
2014-03-18
Author Affiliation: Laboratory of Oncology, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China

