内质网应激对3T3-L1脂肪细胞成纤维细胞生长因子21 mRNA表达的调节作用
万晓珊,刘彦隆,张翼,肖业臣,张海淼,许竹梅,肖健
内质网应激对3T3-L1脂肪细胞成纤维细胞生长因子21 mRNA表达的调节作用
万晓珊,刘彦隆,张翼,肖业臣,张海淼,许竹梅,肖健
325035 温州医科大学药学院(万晓珊、刘彦隆、张翼、肖业臣、许竹梅、肖健);430075 武汉华大医学检验所有限公司(张海淼)
在 mRNA 水平探讨内质网应激对 3T3-L1 脂肪细胞成纤维细胞生长因子 21 表达的影响。
利用经典鸡尾酒法诱导 3T3-L1 前脂肪细胞分化,再用毒胡萝卜内酯分别按照剂量梯度(0、6.25、12.5、25、50 和 100 nmol/L)和时间梯度(0、1、3、6 和 12 h)进行处理,实时 PCR 检测内质网应激相关蛋白C/EBP 同源蛋白和葡萄糖调节蛋白 78 以及成纤维细胞生长因子 21 mRNA 的表达水平。
毒胡萝卜内酯能诱导分化成熟的 3T3-L1 脂肪细胞发生内质网应激,促进 C/EBP 同源蛋白、葡萄糖调节蛋白 78 和成纤维细胞生长因子 21 mRNA 水平显著升高,且与毒胡萝卜内酯的剂量和处理时间呈正相关。当用 100 nmol/L毒胡萝卜内酯处理 6 h 后,成纤维细胞生长因子 21 mRNA 水平显著增高,为对照组的 114.55 倍(< 0.05)。蛋白激酶C 抑制剂钙磷酸蛋白 C 能阻断由毒胡萝卜内酯诱导的内质网应激,并伴随成纤维细胞生长因子 21 mRNA 水平的下降。
内质网应激能上调 3T3-L1 脂肪细胞成纤维细胞生长因子 21 mRNA 表达,且可被蛋白激酶C 抑制剂钙磷酸蛋白C 阻断。
内质网应激; 3T3-L1 细胞; 成纤维细胞生长因子 21
成纤维细胞生长因子(fibroblast growth factor,FGF)家族共有 22 个成员,分为 7 个亚家族,其主要功能涉及胚胎发育、细胞增殖、组织修复和肿瘤发生等[1-3]。2000年,Nishimura 等[4]首次从小鼠胚胎中分离得到 FGF21。研究发现,FGF21 是 FGF 家族中的一个非典型性成员,其主要生物学功能是调节糖脂代谢[5-8]。
目前认为,FGF21 主要在肝脏中表达,白色脂肪组织、胸腺、骨骼肌及胰岛 β 细胞中也有少量表达[5,9-10]。临床报告显示,非酒精性脂肪肝、2 型糖尿病和肥胖等代谢疾病患者的血清 FGF21 水平显著高于正常人群[11-13]。许多动物实验也得到了类似的结果,与野生型小鼠相比,高脂饮食诱导的肥胖小鼠和遗传型肥胖小鼠的血清 FGF21 水平明显升高,且在肝脏和白色脂肪组织中,FGF21 mRNA 水平呈高表达[7, 14-16]。这些研究结果表明在糖尿病和肥胖等病理状态下,FGF21 浓度“应激性”升高,提示这可能是一种反馈性调节,但具体调控机制尚未阐明。
内质网是真核细胞中一种重要的细胞器,是蛋白质合成、修饰的场所,参与糖类和脂类代谢,并维持细胞内钙平衡。但当细胞受到缺氧、毒性药物、感染等刺激时,内质网内未折叠蛋白聚集,钙离子平衡失调,引起内质网应激,这是机体的一种代偿性过程,对细胞有保护作用。大量研究报道,内质网应激与肥胖、胰岛素抵抗和糖尿病等代谢疾病密切相关。现已证实,肥胖可以引起肝脏和脂肪组织发生内质网应激[17-18],同时内质网应激也是触发胰岛素抵抗和 2 型糖尿病的核心机制[19-21]。
然而,肥胖和糖尿病等代谢性疾病中 FGF21 的变化是否与内质网应激有关尚未见报道。本研究用毒胡萝卜内酯(thapsigargin,TG)对已分化的脂肪细胞进行干预,建立内质网应激细胞模型,通过实时 PCR 检测内质网应激信号分子葡萄糖调节蛋白 78(glucose regulated protein 78,GRP78)和 C/EBP 同源蛋白(C/EBP homologous protein,CHOP)及 FGF21 的表达水平,为探讨代谢性疾病中 FGF21 的调控机制提供基础。
1 材料与方法
1.1 材料
小鼠前脂肪细胞株 3T3-L1 购于美国菌种保藏中心(ATCC);高糖 DMEM 培养基、RPMI 1640 培养基、胎牛血清(FBS)、实时 PCR 试剂盒购于美国 Invitrogen 公司;重组人胰岛素、地塞米松(dexamethasone,Dex)、3-异丁基-1-甲基黄嘌呤(isobutyl methylxanthine,IBMX)和毒胡萝卜内酯购于美国 Sigma 公司。
1.2 方法
1.2.1 小鼠 3T3-L1 脂肪细胞的培养和分化 用含 10% FBS 的高糖 DMEM 培养基培养和维持 3T3-L1 前脂肪细胞,用经典鸡尾酒法诱导其分化。当细胞长至接触抑制 2 d 后,用分化液I(含 10 mg/L 胰岛素、0.25 μmol/L Dex、0.5 mmol/L IBMX、10% FBS 的高糖 DMEM 培养基)培养2 d,再用分化液II(含 10 mg/L 胰岛素、10% FBS 的高糖 DMEM 培养基)培养 2 d,之后用含 10% FBS 的高糖 DMEM 培养基继续培养,每 2 天换液一次,分化8 ~ 9 d 后,分化率约为 90%,可用于下一步实验。对分化成熟的 3T3-L1 细胞更换新鲜的完全培养基,然后用不同剂量 TG(0、6.25、12.5、25、50 和 100 nmol/L)处理 6 h 和用 100 nmol/L TG 处理不同时间(0、1、3、6 和12 h),以 DMSO 处理组作为对照,分别收集细胞,每组至少重复 3 次。
用 250 nmol/L 蛋白激酶C 抑制剂钙磷酸蛋白C 预处理已分化的 3T3-L1 脂肪细胞 2 h,然后用 100 nmol/L TG 处理 6 h,以未处理组作为对照,收集细胞,至少重复 3 次。
1.2.2 实时 PCR 检测 CHOP、GRP78 及 FGF21 的 mRNA 水平 用 Trizol 法提取总 RNA,260/280比值为 1.8 ~ 2.0,经逆转录反应合成 cDNA。然后利用 SYBR 荧光实时 PCR 法检测 CHOP、GRP78 和 FGF21 mRNA 相对表达量。实验所用引物均由北京六合华大基因科技股份有限公司合成。以 β-actin 为内参照基因,β-actin 引物序列:上游5' TGGAATCCTGTGGCATCCATGAA AC 3';下游5' TAAAACGCAGCTCAGTAACAGTC CG 3'。CHOP 引物序列:上游5' GCATGAAGGAG AAGGAGCAG 3';下游5' CTTCCGGAGAGACAG ACAGG 3'。GRP78 引物序列:上游5' CAGATCTTCTCCACGGCTTC 3';下游5' GCAGGAGGAATTC CAGTCAG 3'。FGF21 引物序列:上游5' CTGGGG GTCTACCAAGCATA 3';下游5' CACCCAGGATT TGAATGACC 3'。反应体系为 10 μl,包含 Power SYBR Green PCR Master Mix 5 μl,上游引物 0.2 μl,下游引物 0.2 μl,cDNA 模板 0.5 μl,ddH2O 4.1 μl。反应条件:95 ℃预变性 5 min;95 ℃变性 30 s,58 ℃退火 45 s,40 个循环。每个样本设 3 个复孔,同时设无模板阴性对照。
1.3 统计学处理
反应结束后,各个样本的 Ct 值分别取平均数。以对照组的靶基因表达量为1,2-△△Ct即为实验组相对对照组靶基因表达的倍数。
2 结果
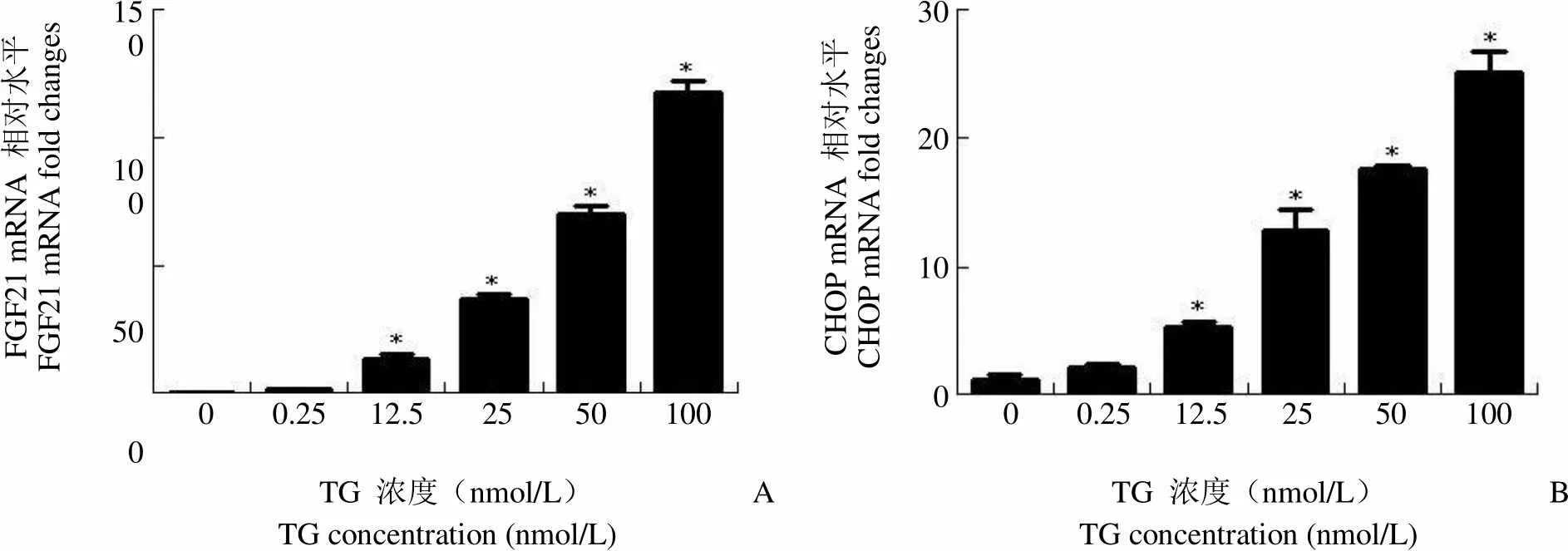
2.1 不同浓度 TG 对 3T3-L1 脂肪细胞 FGF21、CHOP 和 GRP78 mRNA 表达的影响
分别用不同浓度 TG 处理 3T3-L1 脂肪细胞 6 h,以 DMSO 作为空白对照,用实时 PCR 检测 FGF21、CHOP 和 GRP78 的 mRNA 表达水平。结果显示,FGF21、CHOP 和 GRP78 mRNA 水平随着剂量的升高呈递增趋势(图 1),当 TG 浓度为 100 nmol/L 时,FGF21、CHOP 和 GRP78 mRNA达到最高,具有显著性差异(< 0.05)。
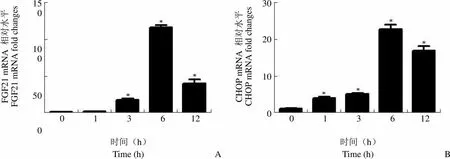
2.2 TG 处理不同时间对 3T3-L1 脂肪细胞 FGF21、CHOP 和 GRP78 mRNA 表达的影响
100 nmol/L TG 处理 3T3-L1 脂肪细胞 1、3、6 和 12 h 后,收集细胞,实时 PCR 检测 FGF21、CHOP 和 GRP78 的 mRNA 表达水平。如图 2 所示,随着处理时间的延长,FGF21、CHOP 和 GRP78 mRNA 表达水平上升,6 h 时达到峰值,12 h 后逐渐降低。处理 6 h,FGF21、CHOP 和 GRP78 mRNA 水平分别为对照组的 114.55、23.20和 12.33 倍,具有显著性差异(< 0.05)。因此,在后面的实验中我们选择 100 nmol/L TG 处理 6 h 作为最佳处理条件。
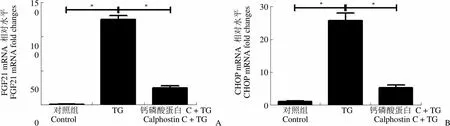
2.3 蛋白激酶C 抑制剂钙磷酸蛋白 C 对 TG 诱导的内质网应激的影响
250 nmol/L钙磷酸蛋白 C 预处理 3T3-L1 脂肪细胞 2 h,然后再加入100 nmol/L TG 处理 6 h,收集细胞,实时 PCR 检测 FGF21、CHOP 和GRP78 mRNA 的表达水平。如图 3 所示,与对照组相比,TG 单独处理组中,FGF21、CHOP 和GRP78 mRNA 水平显著升高(< 0.05),这与前期实验结果一致;与 TG 单独处理组相比,钙磷酸蛋白 C 预处理组中 FGF21、CHOP 和 GRP78 mRNA 水平显著降低(< 0.05)。
FGF21 mRNA 相对水平FGF21 mRNA fold changes150 100 50 0 CHOP mRNA 相对水平CHOP mRNA fold changes30 20 10 0 0 0.25 12.5 25 50 100 0 0.25 12.5 25 50 100 TG 浓度(nmol/L)TG concentration (nmol/L)A TG 浓度(nmol/L)TG concentration (nmol/L)B
Figure 1 Effect of different doses of TG on mRNA levels of FGF21 (A), CHOP (B) and GRP78 (C) in the differentiated 3T3-L1 cells (*< 0.05)
FGF21 mRNA 相对水平FGF21 mRNA fold changes150 100 50 0 CHOP mRNA 相对水平CHOP mRNA fold changes30 20 10 0 0 1 3 6 12 0 1 3 6 12 时间(h)Time (h)A 时间(h)Time (h)B
Figure 2 Effect of TG on mRNA levels of FGF21 (A), CHOP (B) and GRP78 (C) after treatment for different time in the differentiated 3T3-L1 cells (*< 0.05)
FGF21 mRNA 相对水平FGF21 mRNA fold changes150 100 50 0 CHOP mRNA 相对水平CHOP mRNA fold changes30 20 10 0 对照组 TG 钙磷酸蛋白 C + TG Control Calphostin C + TGA 对照组 TG 钙磷酸蛋白 C + TG Control Calphostin C + TGB
Figure 3 Effect of PKC inhibitor on TG-induced mRNA levels in the differentiated 3T3-L1 cells (*< 0.05)
3 讨论
FGF21 是一个与糖脂代谢有关的因子,临床研究和动物实验结果均显示,肥胖和糖尿病等病理状态下,FGF21 水平显著升高,且与甘油三酯、总胆固醇、低密度脂蛋白胆固醇、胰岛素等指标呈正相关,FGF21 的升高被认为是一种反馈性上调,但具体的分子机制未见报道。
文献报道,肥胖中脂质过量堆积、胞内能量流动和养分利用障碍会诱发内质网应激[17, 22],内质网应激激活的 IRE1α-JNK 信号通路会导致胰岛素受体及其底物功能障碍,这是发生胰岛素抵抗的重要原因[17, 23]。持续的胰岛素抵抗会促使胰岛素不断合成和分泌,进而引起胰岛 β 细胞的内质网发生代偿性扩张,蛋白质合成增加,导致未成熟的蛋白质在内质网中积累,进一步加重内质网应激,最终使 β 细胞衰竭,引发 2 型糖尿病。由此可见,肥胖、胰岛素抵抗和糖尿病中均存在不同程度的内质网应激,表明内质网应激与这些代谢疾病的发生发展密切相关。
TG 是内质网膜 Ca2+-ATP 酶抑制剂,诱导胞浆内 Ca2+浓度上升和内质网储存钙的下降,从而引起内质网应激。本实验应用 TG 处理体外分化培养的 3T3-L1 脂肪细胞,发现内质网应激的标志分子 GRP78 和 CHOP mRNA 水平随 TG 浓度的增加和作用时间的延长而逐渐增高,表明成功构建了 3T3-L1 脂肪细胞内质网应激模型。同时,FGF21 的 mRNA 水平也随着内质网应激加剧而升高。当用 100 nmol/L TG 处理 6 h 后,FGF21 的 mRNA 水平为对照组的 114.55 倍,与对照组有显著性差异,但是 12 h 后,表达水平又有所下降,这可能是由于处理时间过长,TG 对细胞产生了一定的毒性。而与 TG 处理组相比,蛋白激酶C 抑制剂钙磷酸蛋白 C 预处理阻断了内质网应激,CHOP 和 GRP78 的 mRNA 水平显著降低,同时伴随 FGF21 mRNA 水平的降低。表明在分化的 3T3-L1脂肪细胞中,内质网应激上调了 FGF21 表达,提示在肥胖和糖尿病等代谢性疾病中 FGF21 水平的升高可能是由内质网应激引起的。同时,TG 是一种典型的 Ca2+释放剂,而胞内高浓度 Ca2+会活化蛋白激酶C,我们推测 FGF21 的调控可能与 Ca2+介导的信号通路密切相关,具体机制有待进一步研究。
[1] Smallwood PM, Munoz-Sanjuan I, Tong P, et al. Fibroblast growth factor (FGF) homologous factors: new members of the FGF family implicated in nervous system development. Proc Natl Acad Sci U S A, 1996, 93(18):9850-9857.
[2] Olsen SK, Garbi M, Zampieri N, et al. Fibroblast growth factor (FGF) homologous factors share structural but not functional homology with FGFs. J Biol Chem, 2003, 278(36):34226-34236.
[3] Beenken A, Mohammadi M. The FGF family: biology, pathophysiology and therapy. Nat Rev Drug Discov, 2009, 8(3):235-253.
[4] Nishimura T, Nakatake Y, Konishi M, et al. Identification of a novel FGF, FGF-21, preferentially expressed in the liver. Biochim Biophys Acta, 2000, 1492(1):203-206.
[5] Kharitonenkov A, Shiyanova TL, Koester A, et al. FGF-21 as a novel metabolic regulator. J Clin Invest, 2005, 115(6):1627-1635.
[6] Kharitonenkov A, Wroblewski VJ, Koester A, et al. The metabolic state of diabetic monkeys is regulated by fibroblast growth factor-21. Endocrinology, 2007, 148(2):774-781.
[7] Coskun T, Bina HA, Schneider MA, et al. Fibroblast growth factor 21 corrects obesity in mice. Endocrinology, 2008, 149(12):6018-6027.
[8] Seo JA, Kim NH. Fibroblast growth factor 21: a novel metabolic regulator. Diabetes Metab J, 2012, 36(1):26-28.
[9] Wente W, Efanov AM, Brenner M, et al. Fibroblast growth factor-21 improves pancreatic beta-cell function and survival by activation of extracellular signal-regulated kinase 1/2 and Akt signaling pathways. Diabetes, 2006, 55(9):2470-2478.
[10] Mashili FL, Austin RL, Deshmukh AS, et al. Direct effects of FGF21 on glucose uptake in human skeletal muscle: implications for type 2 diabetes and obesity. Diabetes Metab Res Rev, 2011, 27(3):286-297.
[11] Chen WW, Li L, Yang GY, et al. Circulating FGF-21 levels in normal subjects and in newly diagnose patients with Type 2 diabetes mellitus. Exp Clin Endocrinol Diabetes, 2008, 116(1):65-68.
[12] Li L, Yang G, Ning H, et al. Plasma FGF-21 levels in type 2 diabetic patients with ketosis. Diabetes Res Clin Pract, 2008, 82(2):209-213.
[13] Chavez AO, Molina-Carrion M, Abdul-Ghani MA, et al. Circulating fibroblast growth factor-21 is elevated in impaired glucose tolerance and type 2 diabetes and correlates with muscle and hepatic insulin resistance. Diabetes Care, 2009, 32(8):1542-1546.
[14] Xu J, Lloyd DJ, Hale C, et al. Fibroblast growth factor 21 reverses hepatic steatosis, increases energy expenditure, and improves insulin sensitivity in diet-induced obese mice. Diabetes, 2009, 58(1):250-259.
[15] Samson SL, Sathyanarayana P, Jogi M, et al. Exenatide decreases hepatic fibroblast growth factor 21 resistance in non-alcoholic fatty liver disease in a mouse model of obesity and in a randomised controlled trial. Diabetologia, 2011, 54(12):3093-3100.
[16] Fisher FM, Estall JL, Adams AC, et al. Integrated regulation of hepatic metabolism by fibroblast growth factor 21 (FGF21) in vivo. Endocrinology, 2011, 152(8):2996-3004.
[17] Ozcan U, Cao Q, Yilmaz E, et al. Endoplasmic reticulum stress links obesity, insulin action, and type 2 diabetes. Science, 2004, 306(5695): 457-461.
[18] Hotamisligil GS. Endoplasmic reticulum stress and the inflammatory basis of metabolic disease. Cell, 2010, 140(6):900-917.
[19] Lefterova MI, Mullican SE, Tomaru T, et al. Endoplasmic reticulum stress regulates adipocyte resistin expression. Diabetes, 2009, 58(8):1879-1886.
[20] Back SH, Kang SW, Han J, et al. Endoplasmic reticulum stress in the β-cell pathogenesis of type 2 diabetes. Exp Diabetes Res, 2012: 618396.
[21] Yan S, Zheng C, Chen ZQ, et al. Expression of endoplasmic reticulum stress-related factors in the retinas of diabetic rats. Exp Diabetes Res, 2012:743780.
[22] Fu S, Yang L, Li P, et al. Aberrant lipid metabolism disrupts calcium homeostasis causing liver endoplasmic reticulum stress in obesity. Nature, 2011, 473(7348):528-531.
[23] Hotamisligil GS. Inflammation and endoplasmic reticulum stress in obesity and diabetes. Int J Obes (Lond), 2008, 32 Suppl 7:S52-S54.
Effect of endoplasmic reticulum stress on FGF21 mRNA expression in the differentiated 3T3-L1 cells
WAN Xiao-shan, LIU Yan-long, ZHANG Yi, XIAO Ye-chen, ZHANG Hai-miao, XU Zhu-mei, XIAO Jian
To study the effect of endoplasmic reticulum stress on FGF21 expression in the differentiated 3T3-L1 cells.
3T3-L1 pre-adipocytes were culturedand differentiated into adipocytes, and then treated with different concentrations of thapsigargin (TG) (0, 6.25, 12.5, 25, 50 and 100 nmol/L) for 6 h or 100 nmol/L TG for different time (0, 1, 3, 6 and 12 h). The mRNA levels of CHOP, GRP78 and FGF21 were detected using real time PCR.
TG-induced endoplasmic reticulum stress increased mRNA expression of CHOP,GRP78 and FGF21 in a dose- and time- dependent manner. FGF21 mRNA expression in 3T3-L1 adipocytes treated by 100 nmol/L TG for 6 h was significantly higher than that of control group (< 0.05). PKC inhibitor calphostin C markedly inhibited TG-induceed endoplasmic reticulum stress, and reduced FGF21 mRNA expression.
FGF21 mRNA expression can be up-regulated by endoplasmic reticulum stress, which can be inhibited by PKC inhibitor calphostin C.
Endoplasmic reticulum stress; 3T3-L1 cells; Fibroblast growth factor 21
XU Zhu-mei, Email: profxzm2008@126.com
10.3969/cmba.j.issn.1673-713X.2014.06.004
国家自然科学基金(81170813、81300311);浙江省自然科学基金(Y2100048、LY12H03001、LQ13H280002);浙江省重点科技创新团队项目(2010R50042)
许竹梅,Email:profxzm2008@126.com
2014-03-26
Author Affiliations: School of Pharmacy, Wenzhou Medical University, Wenzhou 325035, China (WAN Xiao-shan, LIU Yan-long, ZHANG Yi, XIAO Ye-chen, XU Zhu-mei, XIAO Jian); BGI Wuhan, Wuhan 430075, China (ZHANG Hai-miao)

