一种基于TIL的肿瘤相关抗原特异性T细胞的筛选方法
吴凤麟,韦嘉灝,贾筠,何免,邵红伟,黄树林
一种基于TIL的肿瘤相关抗原特异性T细胞的筛选方法
吴凤麟,韦嘉灝,贾筠,何免,邵红伟,黄树林
510006 广州,广东药学院生命科学与生物制药学院(吴凤麟、韦嘉灝、何免、邵红伟、黄树林),生物制药研究所(吴凤麟、邵红伟、黄树林),广东省生物技术候选药物研究重点实验室(吴凤麟、邵红伟、黄树林);523059 东莞市人民医院肿瘤内科(贾筠)
Wolfl 等[1]的研究建立了一种以 CD137 为表面标记,从人 CD8+T 细胞中快速鉴定和分离抗原特异性 T 细胞的方法。由于 CD137 分子表达于活化的 CD4+和 CD8+T 细胞表面[2],其表达上调依赖于 T 细胞经抗原刺激后活化,并可在抗原刺激后 12 h ~ 5 d 内持续表达[3]。因此可以 CD137 为标记,从 T 细胞中检测和分离比例较低的抗原特异性 T 细胞。
上述研究主要从健康人外周血单核细胞(peripheral blood monocyte,PBMC)中筛选 CD137+抗原特异性 T 细胞。然而由于成熟的外周血 T 细胞经历了胸腺的阴性选择,其 T 细胞抗原受体(T cell receptor,TCR)对自身抗原肽(接近肿瘤抗原肽)/MHC 复合物的亲和力低下[4],限制了以健康人 PBMC 筛选肿瘤抗原特异性 T 细胞的效率。因此,有必要寻找更理想的肿瘤抗原特异性 T 细胞筛选来源,这一来源应较为确定地含有可识别肿瘤相关抗原的 T 细胞亚群。
国外临床研究结果提示,肿瘤局部浸润的记忆性 T 细胞数量,与患者的预后和转归有明显相关性[5]。提示肿瘤浸润记忆性 T 细胞可在局部识别肿瘤抗原进而发挥抗肿瘤免疫效应。尤其是记忆性 T 细胞中的中枢型记忆性 T 细胞(central memory T cell,TCM)亚群可在体内长期存活,并保持其抗原特异性[6]。因此,来源于肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)中的记忆性 T 细胞,特别是 TCM有望为肿瘤抗原特异性 T 细胞提供更高效的筛选来源。
本实验首先从肝癌患者腹水 TIL 中纯化获得含有 TCM成分的 CD8+CD62L+T 细胞。选择 CD62L 为纯化标志的理由是:①CD62L 是初始 T 细胞和 TCM的共同标记。经 CD62L 纯化可排除已经抗原刺激活化,但抗原特异性未知的活化 T 细胞和效应型记忆性 T 细胞(effector memory T cell,TEM)[7]。②由于 TIL 细胞数量有限,并预先经过了 CD8 磁珠分选。纯化步骤过多将极大增加细胞损失数量,影响最终获得抗原特异性 T 细胞的数量。在纯化获得 CD8+CD62L+T 细胞后,我们鉴定了其中的 TCM比例。随后以肝癌相关抗原 AFP 九肽刺激 CD8+CD62L+T 细胞。以 CD137+T 细胞比例明确了抗原特异性 T 细胞活化程度后,最终通过磁珠纯化获得了针对 AFP 抗原肽的特异性 T 细胞。
1 材料与方法
1.1 材料
1.1.1 样本 HLA-A2+AFP+肝癌患者腹水样本由东莞市人民医院肿瘤内科收集,患者签署知情同意书。抽取HLA-A2+健康志愿者外周血样本。
1.1.2 细胞株 人 TAP 缺陷 T2 细胞株为本实验室保存。
1.1.3 主要试剂 RPMI 1640 培养基、胎牛血清为美国 Gibco 公司产品;人淋巴细胞分离液为天津灏洋生物制品科技有限责任公司产品;重组人 IL-2、IL-15 为美国 R & D 公司产品;HLA-A2 限制性 AFP218-226表位 9 肽(LLNQHACAV)由杭州中肽生化有限公司合成;PC5 标记抗人 CD8 抗体、FITC 标记抗人 CD62L 抗体、PE 标记抗人 CD44 抗体、ECD 标记抗人 CD45RO 抗体、PE 标记抗人 CD137 抗体均购自美国 BioLegend 公司;CD8 阴选磁珠试剂盒、CD62L 阳选磁珠试剂盒、CD137 阳选磁珠试剂盒均购自德国 Miltenyi 公司。
1.2 方法
1.2.1 腹水 TIL 分离 取新鲜抽取的 HLA-A2+AFP+肝癌患者腹水样本,与无菌生理盐水按 1:1 的比例稀释并混匀,加入淋巴细胞分离液,Ficoll-Hapaque 密度梯度离心法分离单个核细胞。
1.2.2 人 PBMC 分离 抽取 HLA-A2+健康人静脉血,Ficoll-Hapaque 密度梯度离心法分离 PBMC。
1.2.3 CD8+T 细胞纯化 腹水 TIL 及健康人 PBMC 分离当天,以免疫磁珠法完成 CD8+T 细胞纯化。根据试剂盒说明书完成操作。本步磁珠分离为阴选(杂细胞结合磁珠被吸附于分选柱,收集未结合磁珠而流出的 CD8+T 细胞)。
1.2.4 CD8+CD62L+T 细胞纯化 以免疫磁珠法从 CD8+T 细胞中进一步纯化 CD62L+T 细胞。根据试剂盒说明书完成操作。本步磁珠分离为阳选(杂细胞流出,洗脱并收集结合磁珠后被吸附于分选柱上的 CD62L+T 细胞)。最终获得 CD8+CD62L+T 细胞。在添加 10% 胎牛血清、双抗(青霉素 100 U/ml,链霉素 100 μg/ml)的 RPMI 1640 完全培养液中培养。分离后第 1 天,加入重组人 IL-2(50 IU/ ml)和重组人 IL-15(1 ng/ml)。每隔 3 天换液。
1.2.5 流式细胞术检测 T 细胞表面标志分子表达 PC5 标记 CD8 抗体、FITC 标记 CD62L 抗体、PE 标记 CD44 抗体、ECD 标记 CD45RO 抗体染色后上机。检测 CD8+CD62L+T 细胞中以上 4 种分子表达阳性的细胞比例。
1.2.6 肿瘤相关抗原肽刺激 T 细胞 T2 细胞负载 HLA-A2 限制性 AFP218-226表位 9 肽(1 μmol/L)刺激活化分别来源于肝癌患者 TIL 和健康人 PBMC 的 CD8+CD62L+T 细胞(数量为 5 × 106~ 1 × 107个,与 T2 细胞数量比例为 5:1)。在 T 细胞分离后于第 3 和第6 天进行两轮刺激。
1.2.7 CD137+T 细胞检测与纯化 第 2 轮抗原肽刺激 24 h 后。PE 标记 CD137 抗体染色,流式细胞术检测分别来源于肝癌患者 TIL 和健康人 PBMC 的 CD8+CD62L+T 细胞经抗原刺激后 CD137+T 细胞比例,并以免疫磁珠法完成 CD137+T 细胞纯化。
2 结果
2.1 CD8+CD62L+T 细胞纯化
以 CD8 阴选磁珠从来自肝癌患者腹水 TIL 和健康人外周血 PBMC 中(各完成 3 个样本)纯化 CD8+T 细胞,纯度均高于 95%。本步选择阴选磁珠的目的是避免 CD8+T细胞与抗体包被磁珠结合,影响下一步 CD62L+T 细胞纯化。获得 CD8+T 细胞后,于当日内完成第二步 CD62L+阳选磁珠纯化,获得分别来自肝癌患者腹水 TIL 和健康人外周血 PBMC 的 CD8+CD62L+T 细胞,纯度> 95%(图 1)。
2.2 CD8+CD62L+T 细胞中 TCM亚群比例
通过 CD62L 磁珠纯化,排除了 CD8+T 细胞中 CD62L 阴性表达的活化 T 细胞和 TEM。以 CD45RO 和 CD44 为表面标记,实验进一步检测了 CD8+CD62L+T 细胞中 TCM(表型为 CD45RO+CD44high)及初始 T 细胞(CD45RO-CD44-)比例。如图 2 结果所示,来源于肝癌患者腹水的 TIL 和健康人 PBMC 的CD8+CD62L+T 细胞都存在一定比例的 TCM。其中 TIL 来源 CD8+CD62L+T 细胞中的 TCM比例较高,但尚需要完成更多样本的检测以得出明确结论。
2.3 肿瘤相关抗原肽刺激后CD137+T细胞比例
以 TAP 缺陷性 T2 细胞株(仅递呈外源性抗原肽)负载 AFP218-226表位 9 肽,刺激来源于肝癌患者腹水 TIL 和健康人 PBMC 的 CD8+CD62L+T 细胞(各完成 3 例)。如图 3 结果所示,抗原肽刺激后,腹水 TIL 来源 CD8+CD62L+T 细胞有较高的 CD137+T 细胞比例(介于 7% ~ 25%)(图 3A ~ C)。与之相比,健康人 PBMC 来源 CD8+CD62L+T 细胞经抗原刺激后 CD137+T 细胞比例较低(小于 4%)(图 3D ~ F)。
2.4 CD137+T 细胞纯化
以 CD137 磁珠对上述各 3 例经 AFP 抗原刺激的肝癌患者腹水 TIL 和健康人 PBMC 来源 CD8+CD62L+T 细胞完成纯化。从其中两例肝癌患者腹水 TIL 来源CD8+CD62L+T 细胞中纯化获得了 CD137+T 细胞,纯度大于 95%(图 4)。数量级约在 105。而健康人 PBMC 来源 CD8+CD62L+T 细胞由于比例较低,几乎难以通过磁珠纯化获得 CD137+T 细胞。
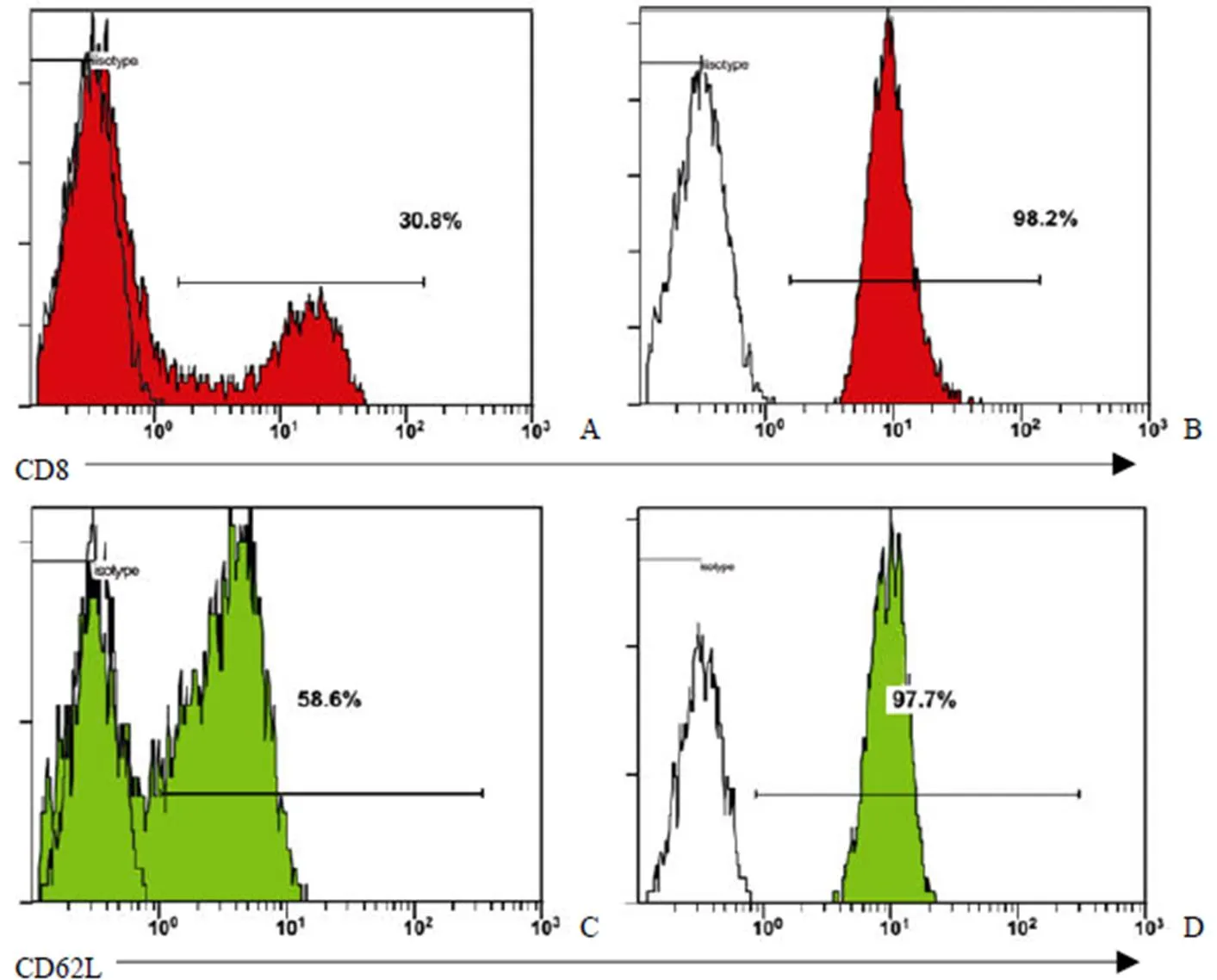
A:TIL 中 CD8+T 细胞比例;B:磁珠纯化后 CD8+T 细胞比例;C:CD8+T 细胞中 CD62L+ 细胞比例;D:磁珠纯化后 CD62L+T 细胞比例

A ~ C:肝癌患者TIL 样本1 ~ 3;D ~ F:健康人 PBMC 样本 1 ~ 3
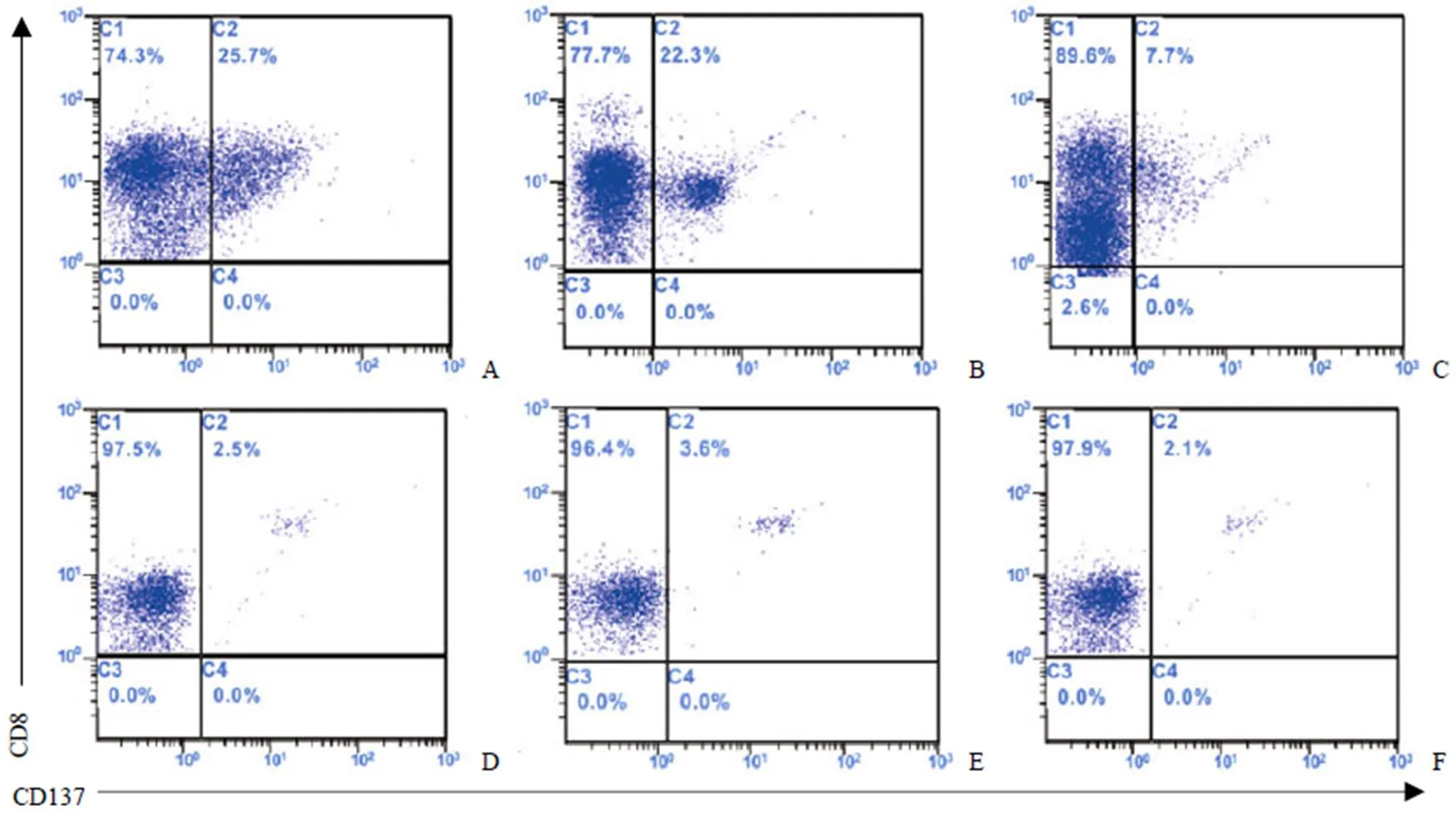
A ~ C:肝癌患者TIL 样本 1 ~ 3;D ~ F:健康人 PBMC 样本 1 ~ 3
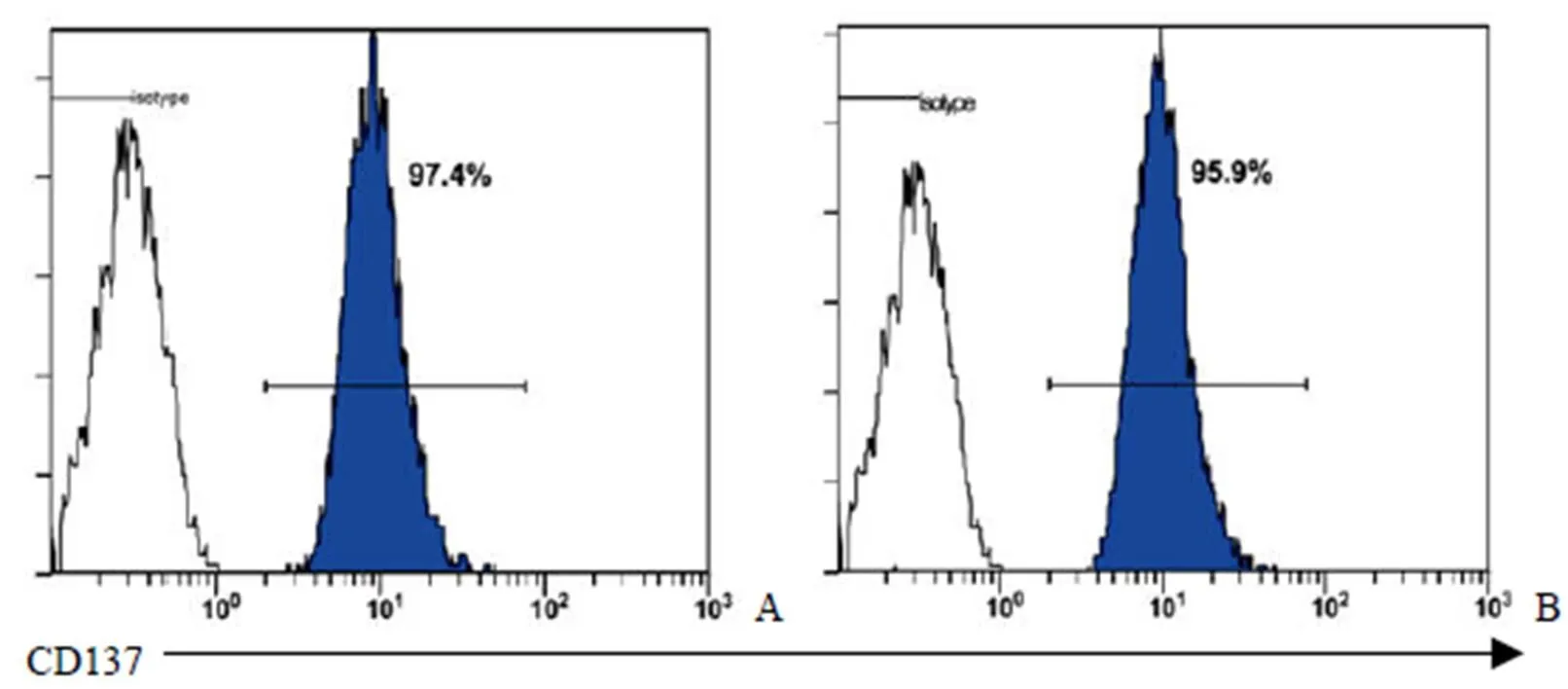
A:肝癌患者 TIL 样本 1;B:肝癌患者 TIL 样本 2
3 讨论
分离获得可以高亲和力与肿瘤抗原结合的特异性 CD8+T 细胞是提高肿瘤免疫治疗效果的重要基础[1]。然而由于外周血中的成熟 T 细胞在发育过程中经历了胸腺的阴性选择,使能够和肿瘤抗原(由于肿瘤免疫编辑,其成分接近正常组织细胞表达的分化抗原)高亲和力结合的 T 细胞被清除[8]。因此从肿瘤患者体内获得足够数量的抗原特异性 T 细胞难度较大。
研究者早就发现,与缺乏肿瘤抗原识别功能的外周血T 细胞不同,肿瘤局部浸润的 TIL 提示了宿主对肿瘤的免疫反应[9]。特别是 TIL 中的 CD8+T 细胞可能与肿瘤良好预后直接相关[10]。而关于肿瘤局部浸润记忆性 T 细胞的研究更是为解决肿瘤抗原特异性T 细胞来源的问题提供了一条可能的思路。由于肿瘤局部浸润高水平的 CD45RO+记忆性 T 细胞提示了更少的早期恶性侵袭标志,更慢的病理进展进程和更长的生存期[5]。提示肿瘤患者体内部分记忆性 T 细胞可在局部提供较长期的抗肿瘤免疫保护。通过选择免疫功能相对较为确定的肿瘤浸润记忆性 T 细胞作为筛选来源,可望有效提高肿瘤抗原特异性 T 细胞的筛选效率。
本实验收集 HLA-A2 阳性 AFP 抗原表达阳性的肝癌患者腹水,从中分离出 TIL。随后进行 CD8+及 CD62L+两步磁珠纯化,获得 CD8+CD62L+T 细胞。完成磁珠纯化后,以 CD45RO 和 CD44 为标志分子[11],实验进一步检测了 CD8+CD62L+T 细胞中初始 T 细胞和 TCM的亚群比例。结果证实,来源于肿瘤患者 TIL 的 CD8+CD62L+T 细胞存在着一定比例的 CD45RO+CD44highTCM。
实验随后以肿瘤相关抗原 AFP 抗原肽刺激了肝癌患者TIL 来源及健康人 PBMC 来源的CD8+CD62L+T细胞。以上抗原 9 肽已被证实可在体外有效刺激 T 细胞活化并产生 CTL 效应(HLA-A2 限制性)[12]。结果显示,肝癌患者TIL 来源CD8+CD62L+T 细胞经抗原刺激后,可以观察到较为明显的CD8+CD137+细胞亚群。而健康人PBMC 来源 CD8+CD62L+T 细胞经抗原刺激后 CD137+细胞比例较低。由于肿瘤患者初始 T 细胞难以有效识别肿瘤抗原,最终接触肿瘤抗原肽刺激被有效活化的抗原特异性 T细胞可能主要来源于 CD8+CD62L+T 细胞中的 CD45RO+CD44highTCM。
以上结果提示,与正常人 PBMC 相比,肿瘤患者 TIL来源 CD8+CD62L+细胞中存在着可识别肿瘤抗原的 TCM,并在肿瘤抗原刺激后活化产生抗原特异性 T 细胞,从而在肿瘤局部提供有效的免疫保护。在肿瘤相关抗原肽刺激并明确 CD137+T 细胞活化比例后,实验最终通过磁珠分选,从两例肝癌患者 TIL 中纯化获得了一定数量可识别 AFP 抗原肽的 CD137+抗原特异性 T 细胞。通过本实验所建立的方法,为进一步大量扩增抗原特异性 T 细胞,并通过分子生物学方法从抗原特异性 T 细胞中鉴定肿瘤抗原特异性 TCR 基因奠定了必要的实验基础。
[1] Wolfl M, Kuball J, Ho WY, et al. Activation-induced expression of CD137 permits detection, isolation and expansion of the full repertoire of CD8+ T cells responding to antigen without requiring knowledge of epitope specificities. Blood, 2007, 110(1):201-210.
[2] Watts TH. TNF/TNFR family members in costimulation of T cell responses. Annu Rev Immunol, 2005, 23:23-68.
[3] Dawicki W, Watts TH. Expression and function of 4-1BB during CD4 versus CD8 T cell responsesin vivo. Eur J Immunol, 2004, 34(3):743- 751.
[4] Buhrman JD, Slansky JE. Improving T cell responses to modified peptides in tumor vaccines. Immunol Res, 2013, 55(1-3):34-47.
[5] Pagès F, Berger A, Camus M, et al. Effector memory T cells, early metastasis, and survival in colorectal cancer. N Engl J Med, 2005, 353(25):2654-2666.
[6] Berger C, Jensen MC, Lansdorp PM, et al. Adoptivetransfer of effector CD8+ T cells derived from central memory cells establishes persistent T cell memory in primates. J Clin Invest, 2008, 118(1):294- 305.
[7] Boyman O, Létourneau S, Krieg C, et al. Homeostatic proliferation and survival of naïve and memory T cells. Eur J Immunol, 2009, 39(8):2088-2094.
[8] Rabinovich GA, Gabrilovich D, Sotomayor EM. Immunosuppressive strategies that are mediated by tumor cells. Annu Rev Immunol, 2007, 25:267-296.
[9] Naito Y, Saito K, Shiiba K, et al. CD8+ T cells infiltrated within cancer cell nests as a prognostic factor in human colorectal cancer. Cancer Res, 1998, 58(16):3491-3494.
[10] Sato E, Olson SH, Ahn J, et al. Intraepithelial CD8+ tumor-infiltrating lymphocytes and a high CD8+/regulatory T cell ratio are associated with favorable prognosis in ovarian cancer. Proc Natl Acad Sci U S A, 2005, 102(51):18538-18543.
[11] Wu F, Zhang W, Shao H, et al. Human effector T cells derived from central memory cells rather than CD8(+)T cells modified by tumor-specific TCR gene transfer possess superior traits for adoptive immunotherapy. Cancer Lett, 2013, 339(2):195-207.
[12] Liu Y, Daley S, Evdokimova VN, et al. Hierarchy of alpha fetoprotein (AFP)-specific T cell responses in subjects with AFP-positive hepatocellular cancer. J Immunol, 2006, 177(1):712-721.
国家自然科学基金(31100664);广东省自然科学基金(10151022401000024);东莞市科技计划项目(2011105102027)
黄树林,Email:shulhuang@sina.com
2014-05-22
10.3969/cmba.j.issn.1673-713X.2014.06.012

