羧胺三唑抑制肿瘤细胞诱导的巨噬细胞中肿瘤坏死因子-α的释放
鞠瑞,陈晨,郭磊,李娟,叶菜英,张德昌
羧胺三唑抑制肿瘤细胞诱导的巨噬细胞中肿瘤坏死因子-α的释放
鞠瑞,陈晨,郭磊,李娟,叶菜英,张德昌
100005 北京,中国医学科学院北京协和医学院基础医学研究所药理学系
观察体外培养的肿瘤细胞对巨噬细胞炎症因子——肿瘤坏死因子-α(TNF-α)的诱导作用;初步探索羧胺三唑(CAI)对肿瘤诱导的巨噬细胞中 TNF-α 释放的影响。
利用 transwell 装置,建立 Lewis 肺癌细胞(LLC)与 RAW264.7 巨噬细胞共培养体系,采用荧光定量 PCR 方法和 ELISA 方法分别分析 RAW264.7 中 TNF-α 的表达和释放;用 LLC 条件培养基(LCM)诱导 RAW264.7,同时给予 CAI 处理,采用 CCK-8 方法分析 LCM 和 CAI 对 RAW264.7 活力的影响,采用 ELISA 方法分析 CAI 对诱导后的 RAW264.7 中 TNF-α 释放的影响。
与 LLC 共培养 24 h 可显著增加RAW264.7 中 TNF-α 相对表达量[单独培养 vs 共培养,(1.00 ± 0.12)vs(2.23 ± 0.17),< 0.01]和释放[单独培养 vs 共培养,(65.21 ± 12.76)vs (143.92 ± 19.22)pg/ml,< 0.05];LCM 和 CAI 在 1 h 和 4 h 对 RAW264.7 活力没有影响,CAI 可以显著抑制 LCM 对RAW264.7 中 TNF-α 释放的诱导(4 h,< 0.01)。
LLC 肿瘤微环境可以诱导 RAW264.7 中 TNF-α 的表达增加;CAI 对这种诱导的抑制使其在肿瘤环境中表现出一定的抗炎作用,可能是其抗肿瘤作用的机制之一。
肿瘤坏死因子 α; 巨噬细胞; 共培养; 羧胺三唑
巨噬细胞是一种易被周围环境所诱导的细胞,大致可以被分为 M1 表型(经典激活的巨噬细胞)和 M2 表型(替代激活的巨噬细胞)。在对肿瘤的影响方面,一般认为 M1 巨噬细胞能够分泌大量促炎介质,具有杀伤肿瘤细胞的功能;而 M2 巨噬细胞则参与组织重塑和创伤修复过程,分泌促炎介质减少,具有促进肿瘤发展的作用[1]。
肿瘤组织中浸润的巨噬细胞,即肿瘤相关巨噬细胞(TAM),其主要细胞因子的释放特征被认为与 M2 巨噬细胞相似。然而,TAM 不能被简单等同于 M2 巨噬细胞,它也有 M1 巨噬细胞的某些特征,也能通过长期释放低浓度的促炎介质在肿瘤微环境中引起“并不剧烈”的炎症反应[2-3]。这些低浓度的促炎介质成为肿瘤细胞的生长信号,在肿瘤细胞的增殖、血管生成、侵袭和转移等各个环节促进肿瘤的发展。在 TAM 释放的多种促炎介质中,肿瘤坏死因子-α(TNF-α)能够调控多种炎症介质和促血管生成因子的合成,扮演关键角色[4]。
羧胺三唑(CAI)是一种非细胞毒类的抗癌药物,对多种肿瘤的增殖和转移有抑制作用[5-7]。除此之外,CAI 还在多种急慢性和免疫性炎症的动物模型中表现出抗炎作用。其抗炎作用主要归因于对炎症组织和致炎动物腹腔巨噬细胞中 TNF-α 等炎症介质释放的抑制[8-9]。
在本项实验中,将肿瘤细胞(或其条件培养基)与巨噬细胞进行共培养,观察肿瘤环境对巨噬细胞中 TNF-α 表达和释放的影响,并在此基础上检测 CAI 对该诱导模型中 TNF-α 释放的影响,补充说明其在肿瘤微环境中同样具有抗炎作用。
1 材料与方法
1.1 材料
1.1.1 细胞系 RAW264.7 巨噬细胞购自中国医学科学院基础医学研究所细胞中心。Lewis 肺癌细胞(LLC)购自中国科学院上海生科院细胞资源中心。
1.1.2 试剂 DMEM 高糖培养基、谷氨酰胺、青霉素和链霉素购自中国医学科学院基础医学研究所细胞中心;胎牛血清购自美国 Gibco 公司;CAI 由中国医学科学院药物研究所提供;CCK-8 试剂购自日本同仁化学研究所;TNF-α ELISA 试剂盒购自上海依科赛生物制品有限公司;mRNA 提取试剂盒购自北京百泰克试剂公司;Oligo(dT)18和 M-MLV 反转录酶购自美国 Promega 公司;SYBR Green I 荧光定量 PCR 试剂盒购自杭州博日科技有限公司;TNF 和 β-actin 引物购自上海基康生物技术有限公司。
1.1.3 装置和仪器 Transwell(0.4 μm)、0.22 μm 滤器购自美国 Millipore 公司;酶标仪 Synergy 4 为美国基因公司产品;荧光定量 PCR 仪 IQ 5 为美国 Bio-Rad 公司产品。
1.2 方法
1.2.1 RAW264.7 细胞和 LLC 细胞培养 RAW264.7 和 LLC 细胞用 DMEM 高糖培养基(加入 10% 胎牛血清、1% 谷氨酰胺、50 mg/ml 青霉素和100 mg/ml 链霉素)在 37 ℃、5% CO2环境中培养。
1.2.2 RAW264.7 细胞和 LLC 细胞共培养 收集处于对数生长期的 LLC 细胞,以 5 × 104个/孔的数量接种至嵌入 24 孔板的 transwell 上室中。收集处于对数生长期的 RAW264.7 细胞,以 6 × 105个/孔的数量接种于 24 孔板中。待 transwell 中 LLC 细胞贴壁后,将 transwell 嵌入至生长有 RAW264.7 细胞的孔中。以 LLC 细胞单独培养、RAW264.7 细胞单独培养作为对照。共培养 24 h。
1.2.3 LLC 细胞条件培养基收集和诱导 收集处于对数生长期的 LLC 细胞,将 5 × 105个细胞接种至 T75 培养瓶中。待细胞生长 5 d 后,收集 T75 中的培养上清,过 0.22 μm 滤器除去上清中的 LLC 细胞,处理后的培养上清为 LLC 条件培养基(LCM)。收集处于对数生长期的 RAW264.7 细胞,以 6 × 105个/孔的数量接种于 24 孔板中。以 50% LCM(50% LCM + 50% 新鲜培养基)培养 RAW264.7 细胞,同时给予 CAI 20 μmol/L 分别处理 1、2 和 4 h。以完全新鲜培养基培养的 RAW264.7 细胞作为对照。
1.2.4 CCK-8 测定 RAW264.7 细胞活力 在 RAW264.7 细胞和 LLC 细胞共培养实验和 LCM 诱导实验中,收集各组上清后,细胞以 PBS 洗2 次,然后向各孔加入 500 μl PBS 和 50 μl CCK-8 试剂,混匀后在 37 ℃、5% CO2环境中继续培养1 h。然后将各孔上清转移至 96 孔板中,测定450 nm 处吸光度。
1.2.5 ELISA 测定 TNF-α 释放 收集RAW264.7细胞和 LLC 细胞共培养实验和 LCM诱导实验中各组的上清,用 ELISA 试剂盒测定上清中 TNF-α 的含量。
1.2.6 RT-PCR 测定 TNF-α 表达 用 mRNA 提取试剂盒提取 RAW264.7 细胞和 LLC 细胞共培养实验中各组RAW264.7 细胞的 mRNA 。经反转录后,用 SYBR Green I 荧光定量 PCR 试剂盒对 TNF-α 进行扩增。TNF-α 正向引物:5' GTCTACTG AACTTCGGGGTGAT 3';TNF-α 反向引物:5' CAC TTGGTGGTTTGCTACGAC 3'。β-actin 正向引物:5' CCTGAGGCTCTTTTCCAGCC 3';β-actin 反向引物:5' TAGAGGTCTTTACGGATGTCAACGT 3'。用 Biorad IQ 5 进行检测和分析。
1.3 统计学处理
2 结果
2.1 与 LLC 细胞共培养后,RAW264.7 细胞中 TNF-α 表达明显增加
提取 RAW264.7 细胞和 LLC 细胞共培养实验中各组 RAW264.7 细胞的 mRNA,进行反转录和荧光定量 PCR。结果显示,与 LLC 共培养 24 h 的 RAW264.7 细胞中 TNF-α 表达显著增加。单独培养的 RAW264.7 细胞中 TNF-α 相对表达量为(1.00 ± 0.12),共培养组 RAW264.7 细胞中 TNF-α 相对表达量为(2.23 ± 0.17),< 0.01(图 1)。

TNF-α 表达倍数Fold expression of TNF-α3.0 2.5 2.0 1.5 1.0 0.5 0 LLC– LLC+
Figure 1 Relative fold expression of TNF-α in RAW264.7 single cultured or co-cultured with LLC for 24 h (**< 0.01)
2.2 与 LLC 细胞共培养后,RAW264.7 细胞中 TNF-α 释放明显增加
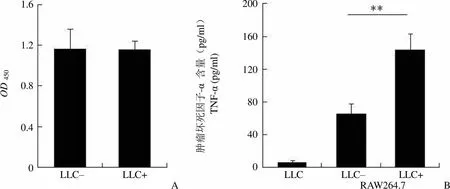
RAW264.7 细胞和 LLC 细胞共培养实验中,单独培养及与 LLC 共培养 24 h 的 RAW264.7 活力无明显差别(图 2A)。培养 24 h 后收集各组上清,进行 ELISA 测定。结果显示,LLC 细胞本身释放的 TNF-α 水平很低,为(5.97 ± 2.35)pg/ml;但是 LLC 能够显著促进 RAW264.7 细胞中 TNF-α 的释放:单独培养和共培养的 RAW264.7 细胞释放的 TNF-α 水平分别为(65.21 ± 12.76)和(143.92 ± 19.22)pg/ml,< 0.05(图 2B)。这两部分结果显示,LLC 细胞使 RAW264.7 细胞中 TNF-α 表达和分泌水平增加幅度相似,表明 LLC 细胞通过某种机制主要在表达水平诱导 RAW264.7 细胞中 TNF-α 增加。
2.3 CAI 显著抑制 LCM 诱导的 RAW264.7 细胞中 TNF-α 的释放
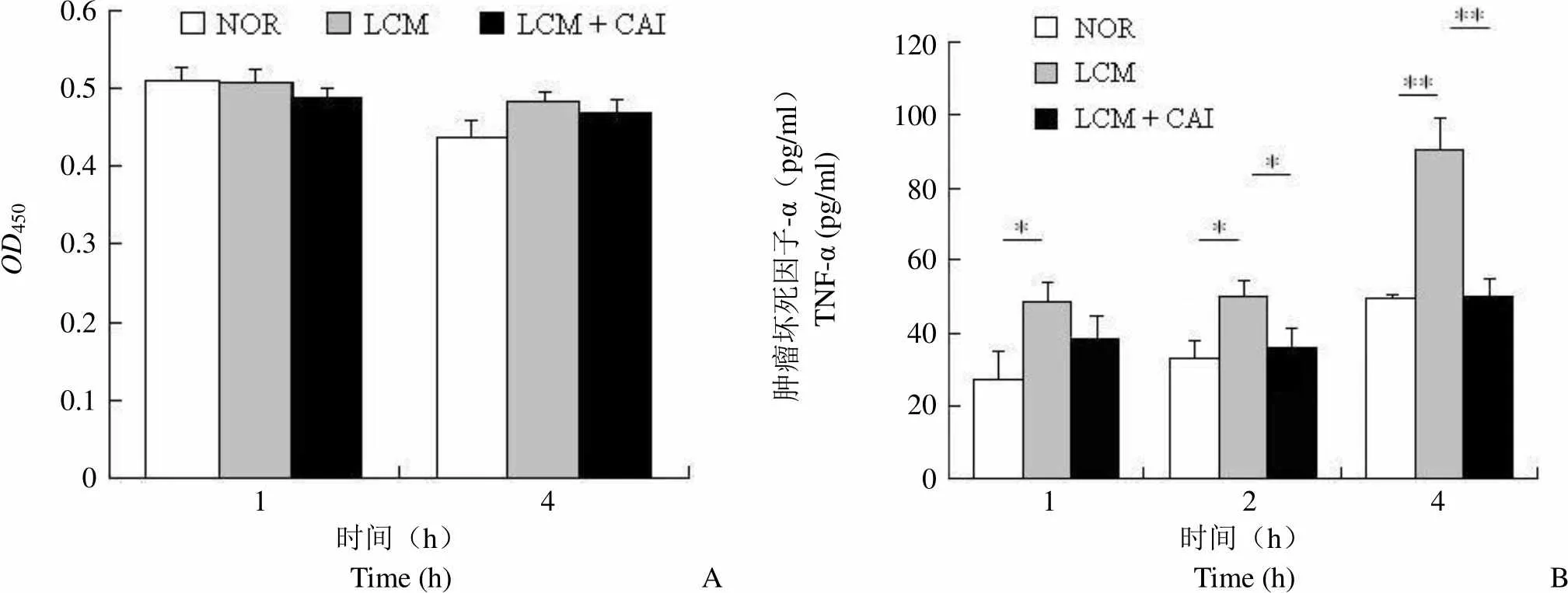
受到肿瘤细胞诱导的炎性细胞,如巨噬细胞,释放 TNF-α 增加。但这种诱导对 TNF-α 的增加程度较低,不但不会杀伤肿瘤细胞,反而成为肿瘤细胞生长的有利因素。上述共培养实验采用 transwell 装置将两种细胞置于一个体系中,两者只有培养基的交流,并不直接接触。因此 LLC 是通过其释放在培养基中的物质对 RAW264.7 进行诱导的。我们接下来使用 LLC 的条件培养基(LCM)对 RAW264.7 进行诱导,在 1 h 和 4 h 时间点,LCM 以及 CAI 对细胞活力没有明显影响(图 3A),LCM 同样可以促进 RAW264.7 中 TNF-α 的释放,并且 CAI 能够有效抑制 LCM 诱导导致的 TNF-α 增加(图 3B)。
OD450 1.6 1.2 0.8 0.4 0 肿瘤坏死因子-α 含量(pg/ml)TNF-α (pg/ml)200 160 120 80 40 0 LLC– LLC+A LLC LLC– LLC+ RAW264.7B
Figure 2 Cell viability (A) and TNF-α secretion (B) of RAW264.7 single cultured or co-cultured with LLC for 24 h (**< 0.01)
OD450 0.6 0.5 0.4 0.3 0.2 0.1 0 肿瘤坏死因子-α(pg/ml)TNF-α (pg/ml) 120 100 80 60 40 20 0 1 4 1 2 4 时间(h)Time (h)A 时间(h)Time (h)B
Figure 3 The effect of LCM and CAI on RAW264.7 viability (A) and TNF-α secretion (B) within 4 hours
3 讨论
TAM 在肿瘤发生发展的过程中发挥重要作用。它兼具 M1 表型和 M2 表型巨噬细胞的标记物,通过调节各种促炎、抗炎介质的平衡扮演肿瘤“帮凶”的角色[2]。在肿瘤发生、增殖、侵袭、转移和血管生成的各个环节中,TAM 释放的 TNF-α 均发挥重要作用[4]。TAM 经肿瘤微环境诱导生成的 TNF-α 水平远低于经典激活(如脂多糖刺激)的巨噬细胞释放的 TNF-α 水平。而正是这种“并不剧烈”的炎症反应,不但不会杀伤肿瘤细胞,反而成为肿瘤细胞的生长信号。目前认为 TNF-α 促进肿瘤发展的机制主要有以下几点:①通过影响活性氧破坏 DNA,并抑制 DNA 的修复;②通过旁分泌方式成为肿瘤细胞生存信号;③通过诱导基质金属蛋白酶诱导组织的重塑;④通过调控趋化因子及其受体控制淋巴细胞的浸润;⑤通过诱导促血管生成因子促进血管的形成;⑥促进肿瘤产生对细胞毒类药物的耐药;⑦促进肿瘤恶液质发生等。
在本项研究中,我们首先建立 LLC 细胞与 RAW264.7 细胞共培养的模型,确定了前者对后者 TNF-α 表达和释放的促进作用和促进的程度。经过与 LLC 共培养,RAW264.7 中 TNF-α 释放显著增加,但是远低于脂多糖的刺激作用,这一点与目前对肿瘤炎性微环境的认识一致。由于已知 CAI 在多种炎症模型中表现出下调 TNF-α 的作用,我们在该模型的基础上检测了 CAI 对肿瘤微环境中 TNF-α 含量的影响,发现 CAI 在所设时间点均显著抑制 LLC 对 TNF-α 的诱导作用。
目前,通过拮抗 TNF-α 进行抗肿瘤治疗已被广泛认可。Infliximab 和 etanercept 治疗肿瘤的I期和II期临床研究发现它们能有效控制晚期患者的病情[10-12]。一些研究也已经证实,能够下调 TNF-α 的沙利度胺对多发性骨髓瘤、肾细胞癌、前列腺癌、黑色素瘤、胶质瘤和 Kaposi 肉瘤有抑制作用[13-15]。
CAI 在多种移植瘤模型中表现出抗癌作用,并且其抗癌治疗已进入临床试验阶段。本项研究结果显示,除直接抑制肿瘤细胞的生长外,CAI 还能抑制 TAM 中炎症介质——TNF-α 的释放,这可能是其抗肿瘤作用的另一个机制。利用这一作用,我们可尝试将 CAI 与其他抗炎药物联合使用,观察其抑制 TNF-α 和肿瘤生长的效果能否得到增强。这将是优化 CAI 抗癌作用的一个比较理想的思路,可能会有可观的应用前景。
[1] Cassetta L, Cassol E, Poli G. Macrophage polarization in health and disease. ScientificWorld Journal, 2011, 11:2391-2402.
[2] Van Ginderachter JA, Movahedi K, Hassanzadeh Ghassabeh G, et al. Classical and alterative activation of mononuclear phagocytes: picking the best of both worlds for tumor promotion. Immunology, 2006, 211(6-8):487-501.
[3] Mantovani A, Allavena P, Sica A, et al. Cancer-related inflammation. Nature, 2008, 454(7203):436-444.
[4] Balkwill F. Tumor necrosis factor or tumor promoting factor? Cytokine Growth Factor Rev, 2002, 13(2):135-141.
[5] Lambert PA, Somers KD, Kohn EC, et al. Antiproliferative and antiinvasive effects of carboxyamido-triazole on breast cancer cell lines. Surgery, 1997, 122(2):372-378.
[6] Perabo FG, Wirger A, Kamp S, et al. Carboxyamido-triazole (CAI), a signal transduction inhibitor induces growth inhibition and apoptosis in bladder cancer cells by modulation of Bcl-2. Anticancer Res, 2004, 24(5A):2869-2877.
[7] Guo L, Li ZS, Wang HL, et al. Carboxyamido-triazole inhibits proliferation of human breast cancer cells via G(2)/M cell cycle arrest and apoptosis. Eur J Pharmacol, 2006, 538(1-3):15-22.
[8] Guo L, Ye C, Chen W, et al. Anti-inflammatory and analgesic potency of carboxyamidotriazole, a tumorostatic agent. J Pharmacol Exp Ther, 2008, 325(1):10-16.
[9] Guo L, Ye C, Hao X, et al. Carboxyamidotriazole ameliorates experimental colitis by inhibition of cytokine production, nuclear factor-κB activation, and colonic fibrosis. J Pharmacol Exp Ther, 2012, 342(2):356-365.
[10] Madhusudan S, Muthuramalingam SR, Braybrooke JP, et al. Study of etanercept, a tumor necrosis factor-alpha inhibitor, in recurrent ovarian cancer. J Clin Oncol, 2005, 23(25):5950-5959.
[11] Harrison ML, Obermueller E, Maisey NR, et al. Tumor necrosis factor alpha as a new target for renal cell carcinoma: two sequential phase Ⅱ trials of infliximab at standard and high dose. J Clin Oncol, 2007, 25(29):4542-4549.
[12] Brown ER, Charles KA, Hoare SA, et al. A clinical study assessing the tolerability and biological effects of infliximab, a TNF-alpha inhibitor, in patients with advanced cancer. Ann Oncol, 2008, 19(7):1340-1346.
[13] Maria de Souza C, Fonseca de Carvalho L, da Silva Vieira T, et al. Thalidomide attenuates mammary cancer associated-inflammation, angiogenesis and tumor growth in mice. Biomed Pharmacother, 2012, 66(7):491-498.
[14] Piura B, Medina L, Rabinovich A, et al. Thalidomide distinctly affected TNF-α, IL-6 and MMP secretion by an ovarian cancer cell line (SKOV-3) and primary ovarian cancer cells. Eur Cytokine Netw, 2013, 24(3):122-129.
[15] Zidi I, Mestiri S, Bartegi A, et al. TNF-alpha and its inhibitors in cancer. Med Oncol, 2010, 27(2):185-198.
Carboxyamidotriazole inhibits the tumor necrosis factor-α secretion from the tumor cells-induced macrophages
JU Rui, CHEN Chen, GUO Lei, LI Juan, YE Cai-ying, ZHANG De-chang
To investigate the tumor necrosis factor-α (TNF-α) expression and secretion enhancement in macrophages induced by tumor cells, as well as the inhibitory effect of carboxyamidotriazole (CAI) on TNF-α induction in tumor-educated macrophages.
The Lewis lung carcinoma (LLC) cells and RAW264.7 macrophages were co-cultured with the transwell inserts, LLC conditioned medium (LCM) was also used to induce RAW264.7 with or without CAI treatment. Real time RT-PCR and ELISA methods were applied to analyze the TNF-α expression and secretion in RAW264.7, respectively. CCK-8 was applied to determine the effect of LLC (LCM) and CAI on the viability of RAW264.7.
TNF-α expression [cultured alone vs co-cultured, (1.00 ± 0.12) vs (2.23 ± 0.17),< 0.01] and secretion [cultured alone vs co-cultured, (65.21 ± 12.76) vs (143.92 ± 19.22) pg/ml,< 0.05] were greatly increased in RAW264.7 after being co-cultured with LLC for 24 hours. LCM and CAI did not influence the viability of RAW264.7 at 1 hour and 4 hour, while CAI inhibited TNF-α secretion in RAW264.7 induced by LCM (4 h,< 0.01).
LLC tumor environment can greatly enhance the TNF-α expression in RAW264.7. CAI inhibits this induction significantly and shows anti-inflammation activity in tumor environment, which may contribute to its anti-cancer effects.
Tumor necrosis factor-alpha; Macrophages; Co-culture; Carboxyamidotriazole
ZHANG De-chang, Email: zhangdechang45@vip.sina.com; YE Cai-ying, Email: caiyingye@126.com
10.3969/cmba.j.issn.1673-713X.2014.02.007
“十二五”国家科技重大专项(2014ZX09507003-003);国家自然科学基金(81201728);高等学校博士学科点专项科研基金新教师类(20121106120019)
张德昌,Email:zhangdechang45@vip.sina.com;叶菜英,Email:caiyingye@126.com
2013-12-26
Author Affiliation: Department of Pharmacology, Institute of Basic Medical Sciences, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100005, China

