TRAIL和EGFR配体寡肽与力达霉素辅基蛋白融合蛋白制备过程的优化
朱大强,陈淑珍
TRAIL和EGFR配体寡肽与力达霉素辅基蛋白融合蛋白制备过程的优化
朱大强,陈淑珍
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所肿瘤室
对以包涵体形式表达的 TRAIL 和 EGFR 配体寡肽与力达霉素辅基蛋白融合蛋白 Ec-LDP-TRAIL 的制备过程进行优化。
对大肠杆菌原核表达 Ec-LDP-TRAIL 目的蛋白的温度、诱导物浓度、起始菌体密度及时间等条件进行优化;在Ni2+亲和层析纯化蛋白过程中对样品预处理以及纯化缓冲液成分进行优化;对纯化后蛋白的分步透析复性过程进行一系列优化,并通过基于 ELISA 的结合活性实验分析 Ec-LDP-TRAIL 与肿瘤细胞的结合能力。
经过工艺优化后,纯化后的融合蛋白 Ec-LDP-TRAIL 纯度达 95% 以上,复性后 LB 培养基活性蛋白收率约为 2.2 mg/L,与初始复性条件相比提高近 2 倍。复性后融合蛋白 Ec-LDP-TRAIL 显示出能够与人表皮癌 A431 和人大细胞肺癌 H460 细胞的结合活性。
融合蛋白 Ec-LDP-TRAIL 制备过程的优化为后续研发和生产奠定了实验基础,同时也为其他以包涵体形式表达的基于 TRAIL 的抗肿瘤蛋白药物的制备提供借鉴。
包涵体; 重组融合蛋白质类; 蛋白质复性; 肿瘤坏死因子相关的凋亡诱导配体
肿瘤坏死因子相关的凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)是机体自身合成的一种细胞因子,主要通过细胞外凋亡途径诱导细胞凋亡[1],但在后期也有线粒体通路的参与。TRAIL 信号传导通路是指以 TRAIL 为配体,通过与死亡受体 DR4/DR5 结合而启动凋亡信号,最终诱导细胞凋亡[2-3]。由于 TRAIL 可选择性诱导多种肿瘤细胞凋亡,而对正常细胞无毒性,是一种很有前景的抗癌药物。表皮生长因子受体(epidermal growth factor receptor,EGFR)是具有酪氨酸激酶活性的细胞膜表面受体,EGFR 高表达与患者的预后不良、易复发及耐药关系密切。目前,针对 EGFR 分子靶向治疗已广泛应用于各类肿瘤的治疗,靶向EGFR 的抗体已经成为有效的抗肿瘤药物。已有研究表明,对 EGFR 通路的抑制能够增强 TRAIL 的促细胞凋亡作用,也在一定程度上克服肿瘤细胞对于 TRAIL 的耐药性[4-6]。因此,可采用 EGFR 配体寡肽(EC)的导向作用拮抗 EGFR 介导的信号传导通路,从而增加肿瘤细胞对 TRAIL 的敏感性。TRAIL 和 EGFR 配体寡肽与力达霉素(lidamycin,LDM)辅基蛋白组成的融合蛋白 Ec-LDP-TRAIL 是我室以 EGFR 和 DR4/DR5 为靶点,以对肿瘤细胞具有选择性凋亡诱导作用的TRAIL 为活性“弹头”,以烯二炔抗肿瘤抗生素力达霉素辅基蛋白 LDP 为辅运载体,通过 DNA 重组技术构建并以包涵体形式表达的一种靶向性抗肿瘤融合蛋白。可在体外与 LDM 的游离发色团 AE 重组,形成具有高效抗肿瘤活性的靶向性蛋白新药 Ec-LDP- TRAIL-AE。Ec-LDP-TRAIL 和 Ec-LDP-TRAIL-AE 均已显示出良好的体内外抗肿瘤作用,具有一定的应用前景,因此,本文对此融合蛋白制备条件进行了优化。
众所周知,包涵体蛋白本身没有活性,以包涵体形式表达的融合蛋白Ec-LDP-TRAIL 需通过纯化、复性等过程才能发挥对 EGFR 和 DR4/DR5 以及多种肿瘤细胞的生物学作用。当前,融合蛋白 Ec-LDP-TRAIL 制备存在问题主要表现为包涵体蛋白表达量低,包涵体溶解性差,在变性条件下提取的融合蛋白 Ec-LDP-TRAIL 纯度不高,复性效率低,复性后产物不均一等[7]。本研究针对实验中存在的难点,优化了融合蛋白 Ec-LDP-TRAIL 制备过程,为其后续研究与开发奠定了坚实基础,也为其他以包涵体形式表达的基于 TRAIL 的靶向抗肿瘤药物制备提供了参考。
1 材料与方法
1.1 材料
1.1.1 试剂 改良型 DMEM、RPMI 1640 培养液为美国 Hyclone 公司产品;胎牛血清(FBS)为美国 Gibco 公司产品;咪唑、十二烷基磺酸钠(SDS)、β-巯基乙醇、氧化型谷胱甘肽(GSSG)、还原型谷胱甘肽(GSH)为美国 Amresco 公司产品;HisTrap 预装柱为美国 GE 公司产品;超滤离心管和 PVDF 膜为美国 Millipore 公司产品;脱脂奶粉为美国 BD 公司产品;Triton X-100、Tween-20 和精氨酸(L-Arg)为美国 Sigma 公司产品;anti-His-tag 小鼠单抗、HRP 标记羊抗小鼠 IgG 购自中杉金桥公司;0.45 μm 滤器购自北京北化黎明公司;其他试剂均为国产分析纯。
1.1.2 菌株 重组菌BL21(DE3)Star™/ pET30A 由本室构建和保存。
1.1.3 细胞株 人表皮癌细胞 A431 和人大细胞肺癌细胞 H460,分别常规培养于含 10% FBS、100 μg/ml链霉素和 100 IU/ml 青霉素的改良型 DMEM 和 RPMI 1640 培养液中。
1.1.4 主要仪器 NBS Innova 43 落地式恒温摇床、Centrifuge 5408R 台式低温离心机购自德国Eppendorf 公司;VC 750 超声破碎仪购自美国Sonics 公司;MiniTrans 蛋白电泳仪购自美国 Bio-Rad 公司;ChemiImager 5500 凝胶成像系统购自美国 Alpha Innotech 公司;DU 800 核酸/蛋白分析仪购自美国Beckman Coulter 公司;Multiscan MK3 酶标仪购自美国Thermo Fisher Scientific 公司。
1.2 方法
1.2.1 融合蛋白 Ec-LDP-TRAIL 表达条件的优化
1.2.1.1 诱导温度的优化 接种含有表达载体 pET-的转化菌,37 ℃摇床振荡培养至600= 1.0,每种培养物都分成四份,分别加入终浓度为 1.0 mmol/L 的 IPTG,将四份培养物分别置于 20、28、30 和 37 ℃条件下,摇床继续振荡培养 8 h 后进行 15% SDS-PAGE 分析。
1.2.1.2 诱导物浓度的优化 接种含有表达载体 pET-的转化菌,37 ℃摇床振荡培养至600= 1.0,以每管 2 ml 培养物分装至7个试管中,加入 IPTG 至终浓度分别为 0.1、0.2、0.4、0.6、0.8、1.0 和 2.0 mmol/L,37 ℃摇床继续振荡培养 8 h 后进行 15% SDS-PAGE 分析。
1.2.1.3 诱导起始菌体密度的优化 接种含有表达载体 pET-的转化菌,37 ℃摇床振荡培养至600分别为0.4、0.6、0.8、1.0、1.5、2.0 和 2.5,加入 IPTG 至终浓度为 1 mmol/L,37 ℃摇床继续振荡培养 8 h 后进行15% SDS- PAGE 分析。
1.2.1.4 诱导时间的优化 接种含有表达载体pET-的转化菌,37 ℃摇床振荡培养至600= 1.0,以每管 2 ml 培养物分装至 7 个试管中,每管均加入 IPTG 至终浓度为 1 mmol/L,37 ℃摇床继续振荡培养1、2、4、6、8、10 和12 h 后进行 15% SDS-PAGE 分析。
1.2.2 融合蛋白 Ec-LDP-TRAIL 包涵体预处理条件的优化 离心收集Ec-LDP-TRAIL 表达菌,每克湿菌加 20 ml 裂解缓冲液(20 mmol/L Tris-HCl、0.5 mmol/L EDTA·2Na、0.1 mol/L NaCl、1% Triton-X 100,pH 8.0),4 ℃充分搅拌均匀;超声波破碎仪破菌,8000 ×离心 15 min。沉淀用 100 ml 包涵体洗涤液 I(20 mmol/L Tris-HCl、0.1 mol/L NaCl、2 mol/L 尿素,pH 8.0)洗涤 2 次,8000 ×离心 15 min。离心后沉淀用 100 ml 包涵体洗涤液II(20 mmol/L Tris-HCl、0.1 mol/L NaCl、0.05% Triton X-100、5% 甘油,pH 8.0)洗涤 1 次,沉淀再用100 ml 包涵体洗涤液III(20 mmol/L Tris-HCl、0.1 mol/L NaCl、2 mol/L 尿素,pH 8.0)洗涤 2 次,蒸馏水洗涤 1 次,均以 10 000 ×离心 15 min。最后所得沉淀用 20 ml 包涵体溶解缓冲液(20 mmol/L Tris-Hcl、8 mol/L 尿素、0.1 mol/L NaCl、20 mmol/L咪唑)重悬,冰浴 1 h 完全溶解蛋白。16 000 ×离心 30 min,以除去不溶物质,0.45 µm 滤膜过滤后用于亲和柱层析纯化。同时,SDS-PAGE 分析各步骤所收集样品。
1.2.3 变性融合蛋白 Ec-LDP-TRAIL 纯化条件筛选 采用固定化 Ni2+螯合层析法纯化变性后 Ec-LDP-TRAIL。将 0.45 μm 滤器过滤后的包涵体上清经用 1 × 结合缓冲液(8 mol/L尿素、20 mmol/L Tris-HCl、0.1 mol/L NaCl)平衡后的 HisTrap 预装柱,依次加入 10 体积分别含 5、10、20、60 和 150 mmol/L 咪唑的 1 × 洗涤缓冲液(8 mol/L 尿素、20 mmol/L Tris-HCl、0.1 mol/L NaCl,pH 8.0),SDS-PAGE 分析各洗脱组分纯度。
1.2.4 融合蛋白 Ec-LDP-TRAIL 复性条件优化 采用分步透析法进行Ec-LDP-TRAIL 复性,初始条件为:纯化后 Ec-LDP-TRAIL 用 1 × 结合缓冲液稀释至 15 μmol/L,加入还原剂 β-巯基乙醇至终浓度 10 mmol/L,室温静置 20 min,用 50 倍体积透析复性液 I(20 mmol/L Tris-HCl、1 mmol/L EDTA、0.1 mol/L NaCl、6 mol/L 尿素,pH 8.0)透析过夜;再用尿素浓度递减(顺序依次为:3、1.5、1、0.5 和0 mol/L),其他组分与透析液I 相同的复性液透析过夜,并在尿素浓度为 1.5 mol/L 时加入 750 μmol/L GSSG 和 400 mmol/L L-Arg;最后得到的复性蛋白用 PBS(pH 7.4)透析 2 次,每次12 h,4 ℃、16 000 ×离心 30 min,收集上清进行还原和非还原 SDS-PAGE 分析。复性过程优化以提高活性 Ec-LDP-TRAIL 含量为目标,在初始条件基础上进行,所涉及因素包括在 1.5 mol/L 尿素透析阶段时需添加的 GSSG、GSH 和 L-Arg 浓度。
1.2.5 采用 Western blot 法对融合蛋白 Ec-LDP- TRAIL 的鉴定 取 5 μg 经过亲和层析纯化的融合蛋白,采用湿转法将其转移至 PVDF 膜上,5% 脱脂奶粉/Tris 盐吐温缓冲液(TBST,20 mmol/L Tris-HCl、137 mmol/L NaCl、0.1% Tween-20,pH 7.5)封闭过夜;用 1:1000 稀释的抗 His-tag 小鼠单克隆抗体室温孵育 2 h;TBST 洗 3 次,用1:1000 稀释的 HRP 标记羊抗小鼠 IgG 室温孵育 2 h;TBST 洗 3 次,按照 ImmobilonTMWestern Chemiluminescent HRP 底物试剂盒说明书显色,ChemiImager 5500 凝胶成像系统拍照保存结果。
1.2.6 融合蛋白 Ec-LDP-TRAIL 活性测定 采用基于 ELISA 结合实验测定Ec-LDP-TRAIL 与肿瘤细胞的结合活性。人表皮癌细胞 A431 和人大细胞肺癌细胞 H460 分别以 1 × 104个/孔的密度接种于 96 孔板,37 ℃培养 24 h 后用 PBS 洗3 次,每次 3 min,加入 4 ℃预冷的 0.05% 戊二醛 50 μl/孔,于 4 ℃固定细胞 15 min;固定好的细胞用 PBS 洗 3 次后,用 1% BSA/PBS 溶液以 200 μl/孔于 4 ℃封闭过夜;用 PBST 缓冲液(含有 0.05% 的 Tween-20)洗 3次;将融合蛋白倍比稀释加入到 96 孔板中,50 μl/孔,每个浓度设 3 个平行孔,37 ℃温育 2 h;用 PBST 洗3 次后,加入抗 His-tag 单克隆抗体(1:2000 稀释),50 μl/孔,37 ℃温育 2 h;用 PBST 洗板 3 次,加入辣根过氧化物酶标记的羊抗鼠 IgG 抗体(1:2500 稀释),50 μl/孔,37 ℃温育 2 h;用PBST 洗板 5 次,加入辣根过氧化物的底物反应液(邻苯二胺: 0.1 mol/L柠檬酸:H2O2= 4 mg:10 ml:15 μl),100 μl/孔,室温避光反应 10 min。以 2 mol/L 的硫酸 100 μl/孔终止反应,立即在酶标仪上测定492 nm 处的吸光值。根据酶标仪测定结果,扣除阴性对照值,然后以吸光值为纵坐标,以抗体浓度为横坐标作剂量反应曲线。
2 结果
2.1 表达条件的优化
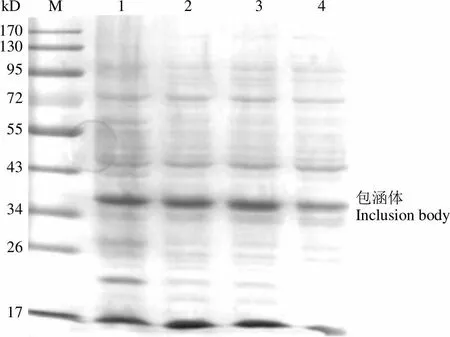
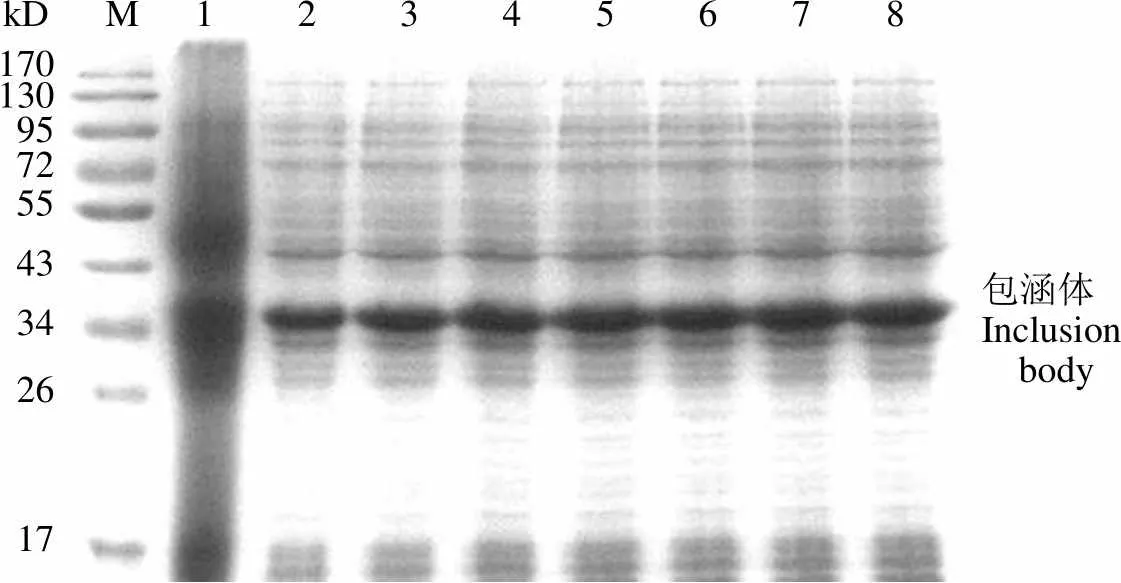
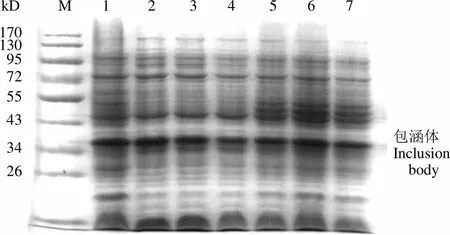
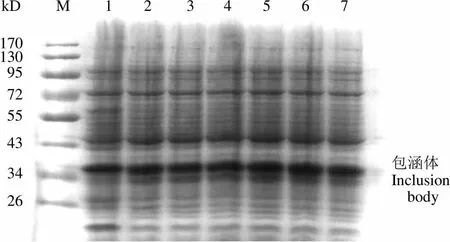
如图 1 所示,在 28、30和 37 ℃条件下诱导表达的目的蛋白量相当。由于大肠杆菌在较高温度条件下生长速度更快,因此选择诱导温度为37 ℃,并且只检测大肠杆菌包涵体中的目的蛋白。如图 2 所示,在 0.4 mmol/L 的 IPTG 诱导条件下蛋白表达较多,因此选择的诱导物为0.4 mmol/L 的 IPTG。从图 3 可以看出,当600达到 0.6 时,Ec-LDP-TRAIL 蛋白的表达量较多,因此对于 Ec-LDP-TRAIL 蛋白选择诱导起始菌体密度600= 0.6。当诱导超过2 h,大量表达包涵体蛋白且杂蛋白较少,因此选择诱导时间为 2 h(图 4)。综上所述,Ec-LDP-TRAIL 蛋白的最优诱导条件为诱导起始菌体密度600= 0.6,诱导物 IPTG 浓度为 0.4 mmol/L,37 ℃摇床振荡培养 2 h。
kD M 1 2 3 4 170130957255 43 34 26 17 包涵体Inclusion body
Figure 1 SDS-PAGE analysis of inclusion body expression at different temperature
kD M 1 2 3 4 5 6 7 8 170130957255433426 17 包涵体Inclusionbody
M:蛋白分子量标准品;1:未加 IPTG 诱导的大肠杆菌包涵体组分;
2 ~ 8:分别添加 0.1、0.2、0.4、0.6、0.8、1.0 和 2.0 mmol/L IPTG 诱导条件下的包涵体组分
M: Protein marker; 1: Inclusion body fraction ofcarrying the plasmid pET-before IPTG induction; 2 - 8: Inclusion body fraction ofcarrying the plasmid pET-after induction at 37 ℃ with 0.1, 0.2, 0.4, 0.6, 0.8, 1.0 and 2.0 mmol/L IPTG, respectively
图 2 以不同 IPTG 浓度诱导含有表达载体pET-的大肠杆菌包涵体组分的 SDS-PAGE 分析
Figure 2 SDS-PAGE analysis of inclusion body expression with different concentrations of IPTG
kD M 1 2 3 4 5 6 7 170130957255433426 包涵体Inclusionbody
Figure 3 SDS-PAGE analysis of inclusion body expression under different cell density
2.2 包涵体制备工艺与溶解缓冲液的确定
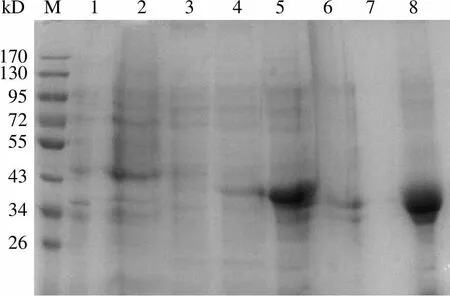
图 5 表明,包涵体洗涤各步骤均能不同程度地去除一部分菌体杂蛋白,提示它们是包涵体制备工艺的重要组成部分。以往有报道用 6 mol/L 盐酸胍作为包涵体溶解的变性剂,但考虑到盐酸胍成本远高于尿素,不利于科学研究和工业生产中的大规模应用,因此选择含有 8 mol/L 尿素的包涵体溶解液,融合蛋白 Ec-LDP-TRAIL 包涵体同样能够在较短时间内溶解并达到较高纯度。
2.3 变性融合蛋白 Ec-LDP-TRAIL 纯化条件确定
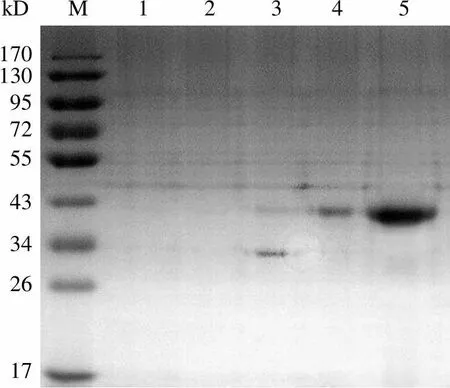
图 6 显示,在 8 mol/L 尿素变性条件下,含5 和 10 mmol/L 咪唑的缓冲液并不能将目的蛋白 Ec-LDP-TRAIL 洗脱下来;含 20 mmol/L 咪唑的缓冲液洗脱下的组分除含有微量杂蛋白外,还含有少量 Ec-LDP-TRAIL,考虑到结合缓冲液中咪唑的含量应能够最大限度洗脱下杂蛋白而最小限度洗脱目的蛋白的原则,因此在结合缓冲液中的咪唑浓度为 20 mmol/L;含60 mmol/L 咪唑的1 × 洗涤缓冲液洗脱下的组分主要为 Ec-LDP-TRAIL,但所得 Ec-LDP-TRAIL 较少;含 150 mmol/L 咪唑的缓冲液洗脱下的组分为 Ec-LDP-TRAIL,无杂蛋白,因此,在 1 × 洗涤缓冲液中使用的咪唑浓度为 60 mmol/L,在 1 × 洗脱缓冲液中使用的咪唑浓度为 150 mmol/L。通过上述优化后条件纯化 Ec- LDP-TRAIL,可使其纯度达 95% 以上。
kD M 1 2 3 4 5 6 7 170130957255433426 包涵体Inclusionbody
Figure 4 SDS-PAGE analysis of inclusion body expression at different induction time
kD M 1 2 3 4 5 6 7 8 170130957255433426
Figure 5 SDS-PAGE results of the preparation process of inclusion body
kD M 1 2 3 4 5 170130957255433426 17
Figure 6 SDS-PAGE results of the immobilized Ni2+affinity chromatography for the purification of fusion protein Ec-LDP- TRAIL
2.4 采用 Western blot 法对融合蛋白 Ec-LDP- TRAIL 的鉴定
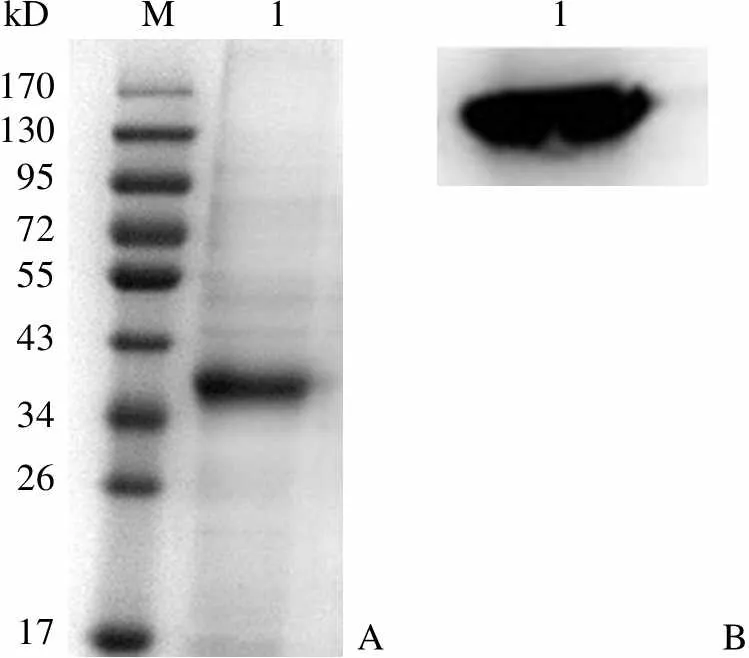
图 7 表明,复性 Ec-LDP-TRAIL 在非还原 SDS-PAGE 中分析时显示为单一条带,提示 Ec-LDP-TRAIL 为其单体形式;另外,本研究根据 Ec-LDP-TRAIL 在 C-末端有 6 个组氨酸序列的特点,对其进行了 Western blot 验证,结果表明其能够与抗 His-tag 单抗起免疫反应,说明它们均具有完整 C-末端组氨酸结构。
kD M 1 1 170130957255433426 17AB
Figure 7 Monomeric fusion protein Ec-LDP-TRAIL assayed by non-reduced SDS-PAGE (A) and Western blot (B)
2.5 融合蛋白 Ec-LDP-TRAIL 复性条件优化
为提高复性后 Ec-LDP-TRAIL 含量,本研究对其透析复性条件进行了一系列优化。表 1 结果显示,当 GSH 浓度为 6 mmol/L、GSSG 浓度为 0.75 mmol/L、L-Arg 浓度为 0.4 mol/L 时,更有利于 Ec-LDP-TRAIL 复性,每升 LB 培养基可获得 2.2 mg 复性后的活性蛋白,比对照组(0.7 mg/L)提高 2 倍;因此,优化后的 Ec-LDP-TRAIL 分步透析复性条件为:在初始透析复性基础上,GSH 浓度为 6 mmol/L,GSSG 浓度为 0.75 mmol/L,L-Arg 浓度为 0.4 mol/L。
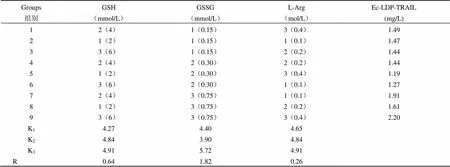
表 1 复性液中添加GSH、GSSG 以及L-Arg 的正交设计优化结果
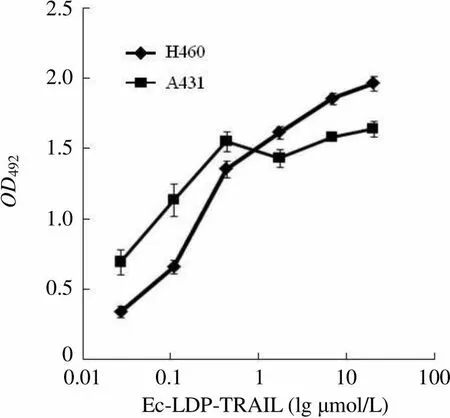
OD4922.5 2.0 1.5 1.0 0.5 0 0.01 0.1 1 10 100 Ec-LDP-TRAIL (lg μmol/L)
Figure 8 The binding activity of fusion protein Ec-LDP- TRAIL to tumor cells A431 and H460 measured by ELISA assay
2.6 融合蛋白 Ec-LDP-TRAIL 对肿瘤细胞的结合活性
从图 8 可知,随着 Ec-LDP-TRAIL 浓度增加,人表皮癌细胞 A431 和人大细胞肺癌细胞H460 的值也逐渐增强,表明 Ec-LDP-TRAIL 对这两种细胞均有结合活性。
3 讨论
TRAIL 因其能够选择性诱导肿瘤细胞发生凋亡,而对正常细胞没有毒性,从而成为当前抗肿瘤治疗研究的热点。目前国内外众多学者都在积极研究 TRAIL 重组蛋白在肿瘤治疗领域中的应用,已有大量研究已经表明,TRAIL 能诱导各种肿瘤细胞凋亡,如肺癌、乳腺癌、结肠癌、前列腺癌、胰腺癌、肾癌、中枢神经系统肿瘤、胸腺肿瘤、白血病、多发性骨髓瘤、黑色素瘤、骨肉瘤等,而系统毒性非常小[8]。与天然 TRAIL 相同,重组 TRAIL 可选择性诱导多种肿瘤细胞凋亡,对正常细胞无毒性,是一种很有前景的抗癌药物[9-10]。
本研究所构建的融合蛋白 Ec-LDP-TRAIL 利用 EGFR 配体寡肽的导向作用和 TRAIL 对肿瘤细胞的选择性凋亡诱导作用,并以力达霉素辅基蛋白 LDP 为辅助运载体,经基因重组技术构建。此外,利用力达霉素可在体外进行发色团 AE 和辅基蛋白 LDP 拆分和组装的特点,将游离发色团 AE 通过分子重建方法装配进融合蛋白 Ec-LDP- TRAIL 中。因此,融合蛋白 Ec-LDP-TRAIL 通过靶向 EGFR 以及死亡受体 DR4/DR5发挥 TRAIL 的选择性凋亡诱导作用和力达霉素高效抑瘤作用,从而提高肿瘤细胞对 TRAIL 敏感性以及降低力达霉素的副作用。这种双重靶向和“弹头”作用体现了肿瘤靶向治疗的新策略。
重组蛋白在大肠杆菌中表达易形成包涵体是科研和生产中经常遇到而且亟需解决的重点和难点问题。因此,为获得高纯度且有活性的融合蛋白 Ec-LDP-TRAIL,需要从包涵体表达、样品处理、纯化和复性四个方面对其制备过程进行优化[11]。本研究发现,在包涵体蛋白表达过程中,表达条件——包括诱导温度,诱导剂 IPTG 的浓度,初始菌体浓度以及表达时间,对外源蛋白表达量的高低都有一定的影响。因此对上述四种常见影响因素进行一系列优化,最终确定 Ec-LDP-TRAIL 蛋白的最优诱导条件为诱导起始菌体密度600= 0.6,诱导物 IPTG 浓度为 0.4 mmol/L,37 ℃摇床振荡培养2 h,这为表达外源蛋白 Ec-LDP-TRAIL 提供了高效节能的发酵方案。另外,在包涵体制备过程中,用多种盐溶液对包涵体分步洗涤,可有效去除包裹在包涵体周围的大部分杂蛋白,而无菌水清洗不仅可溶解一部分杂蛋白,还能去除大量盐离子和变性剂,为下一步变性包涵体蛋白的固定——Ni2+亲和层析奠定基础。确定了包涵体制备工艺后,本研究对固定化 Ni2+亲和层析缓冲液中的咪唑浓度进行了优化。结果发现,在变性条件下,添加20 mmol/L 咪唑的结合缓冲液恰好可以将目的蛋白 Ec-LDP- TRAIL 洗脱下来的同时,还可以洗脱下大量的杂蛋白;添加60 mmol/L 咪唑于1 × 洗涤缓冲液中,能够尽可能地将结合于层析介质上的杂蛋白洗脱下来;而在1 × 洗脱缓冲液中加入150 mmol/L 咪唑,就足以洗脱下绝大部分的融合蛋白 Ec-LDP- TRAIL,提示咪唑浓度优化也是变性包涵体蛋白纯化不可忽略的一个重要步骤,尤其是在确定结合缓冲液中咪唑浓度时,不经优化就使用含咪唑浓度过高或者过低的缓冲液,均不利于最大限度得到纯化的目的蛋白。
以包涵体形式存在的外源表达蛋白的复性是蛋白制备工艺的瓶颈所在[12]。本研究以活性融合蛋白 Ec-LDP-TRAIL 含量为指标,对透析复性液中的关键成分 GSH、GSSG 和 L-Arg 进行了优化,结果发现,这些因素均能不同程度地影响融合蛋白 Ec-LDP-TRAIL 复性效率,且每一步优化均可使活性蛋白含量提高 13% ~ 20%,提示融合蛋白Ec- LDP-TRAIL 复性是多因素共同作用的结果。
本研究通过对融合蛋白Ec-LDP-TRAIL 制备过程中所涉及的包涵体表达、样品预处理、固定化 Ni2+螯合层析、透析复性等过程的优化,使融合蛋白 Ec-LDP-TRAIL 含量达到 95%,并检测到了一定的靶抗原结合能力。综上,本研究为融合蛋白 Ec-LDP-TRAIL 生产制备及后续研究工作奠定了良好的条件和基础,也为其他基于 TRAIL 的以包涵体形式表达的靶向蛋白药物制备提供了相关实验依据。
[1] Holland PM. Targeting Apo2L/TRAIL receptors by soluble Apo2L/TRAIL. Cancer Lett, 2013, 332(2):156-162.
[2] Li SS, Tang QL, Wang SH, et al. Simultaneously targeting Bcl-2 and Akt pathways reverses resistance of nasopharyngeal carcinoma to TRAIL synergistically. Tumori, 2011, 97(6):762-770.
[3] Cretney E, Takeda K, Smyth MJ. Cancer: novel therapeutic strategies that exploit the TNF-related apoptosis-inducing ligand (TRAIL)/TRAIL receptor pathway. Int J Biochem Cell Biol, 2007, 39(2):280- 286.
[4] Teraishi F1, Kagawa S, Watanabe T, et al. ZD1839 (Gefitinib, 'Iressa'), an epidermal growth factor receptor-tyrosine kinase inhibitor, enhances the anti-cancer effects of TRAIL in human esophageal squamous cell carcinoma. FEBS Lett, 2005, 579(19):4069-4075.
[5] Horita H, Thorburn J, Frankel AE, et al. EGFR-targeted diphtheria toxin stimulates TRAIL killing of glioblastoma cells by depleting anti-apoptotic proteins. J Neurooncol, 2009, 95(2):175-184.
[6] Bremer E, Samplonius DF, van Genne L, et al. Simultaneous inhibition of epidermal growth factor receptor (EGFR) signaling and enhanced activation of tumor necrosis factor-related apoptosis- inducing ligand (TRAIL) receptor-mediated apoptosis induction by an scFv:sTRAIL fusion protein with specificity for human EGFR. J Biol Chem, 2005, 280(11):10025-10033.
[7] Singh SM, Panda AK. Solubilization and refolding of bacterial inclusion body proteins. J Biosci Bioeng, 2005, 99(4):303-310.
[8] Martinez-Lostao L, Marzo I, Anel A, et al. Targeting the Apo2L/TRAIL system for the therapy of autoimmune diseases and cancer. Biochem Pharmacol, 2012, 83(11):1475-1483.
[9] Herbst RS, Eckhardt SG, Kurzrock R, et al. Phase I dose-escalation study of recombinant human Apo2L/TRAIL, a dual proapoptotic receptor agonist, in patients with advanced cancer. J Clin Oncoly, 2010, 28(17):2839-2846.
[10] Ashkenazi A, Holland P, Eckhardt SG. Ligand-based targeting of apoptosis in cancer: the potential of recombinant human apoptosis ligand 2/Tumor necrosis factor–related apoptosis-inducing ligand (rhApo2L/TRAIL). J Clin Oncoly, 2008, 26(21):3621-3630.
[11] Ventura S, Villaverde A. Protein quality in bacterial inclusion bodies. Trends Biotechnol, 2006, 24(4):179-185.
[12] Mannall GJ, Titchener-Hooker NJ, Dalby PA. Factors affecting protein refolding yields in a fed-batch and batch-refolding system. Biotechnol Bioeng, 2007, 97(6):1523-1534.
Optimization of preparation process for the fusion protein consisting of TRAIL, epidermal growth factor receptor/EGFR peptide ligand and apoprotein of lidamycin
ZHU Da-qiang, CHEN Shu-zhen
To optimize the preparation process of the fusion protein Ec-LDP-TRAIL expressed in the form of inclusion body.
Based on the selective antitumor activity of TRAIL in tumor cells rather than normal cells, and the target of EGFR ligand peptide, we constructed a bi-specific fusion protein consisting of TRAIL, EGFR ligand peptide and lidamycin. Conditions of fermentation of engineering bacteria, preparation and dissolution of inclusion body, Ni2+affinity chromatography of the target protein and refolding through stepwise dialysis were investigated.
After optimization, the purity of fusion protein Ec-LDP-TRAIL was more than 95% by immobilized Ni2+affinity chromatography under denaturing conditions. Besides that, after optimization of the refolding process using orthogonal design, the yield of active fusion protein Ec-LDP-TRAIL was 2.2 mg from 1 L LB medium which was 2-fold higher than that of the initial refolding conditions. The purified fusion protein Ec-LDP-TRAIL could bind to both human epidermoid carcinoma A431 cells and human large cell lung carcinoma H460 cells.
Optimization of preparation process for Ec-LDP-TRAIL expressed as the form of inclusion body provides the experimental basis for the future development and production of the protein. Furthermore, it might serve as a relatively practical system for the preparation of other TRAIL-based proteins expressed in the form of inclusion body.
Inclusion bodies; Recombinant fusion proteins; Protein renaturation; TNF-related apoptosis-inducing ligand
CHEN Shu-zhen, Email: bjcsz@imb.pumc.edu.cn
10.3969/cmba.j.issn.1673-713X.2014.02.004
国家自然基金面上项目(81072664、81373437);“重大新药创制”国家科技重大专项(2012ZX09301-002-001-022)
陈淑珍,Email:bjcsz@imb.pumc.edu.cn
2013-11-15
Author Affiliation:Department of Oncology, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union College, Beijing 100050, China

