以丙氨酸消旋酶为靶点的高通量抗结核药物筛选模型的建立及应用
周爽,蒙建洲,关艳,胡辛欣,司书毅,肖春玲
以丙氨酸消旋酶为靶点的高通量抗结核药物筛选模型的建立及应用
周爽,蒙建洲,关艳,胡辛欣,司书毅,肖春玲
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所国家新药(微生物)筛选实验室
建立以结核分枝杆菌丙氨酸消旋酶为靶点的新型高通量抗结核药物筛选模型,筛选丙氨酸消旋酶的抑制剂,获得以丙氨酸消旋酶为靶点的新型抗结核药物先导物。
以结核分枝杆菌 H37Rv 基因组为模板,pET28a表达质粒为载体,将基因克隆至 pET28a,构建 pET28a::重组表达质粒,表达并纯化得到重组结核分枝杆菌丙氨酸消旋酶;通过测定反应产物 NADH 在 340 nm 处光密度变化速率,检测酶反应活性,构建并优化该酶抑制剂的高通量筛选模型;应用该模型对化合物库进行筛选;测定活性化合物 IC50以及对结核分枝杆菌的 MIC。
成功构建了结核分枝杆菌基因的表达载体;得到了纯度较高的重组丙氨酸消旋酶,测得该酶的比活力为 13.53 kU/mg;所建立的丙氨酸消旋酶高通量筛选模型稳定性高,符合高通量筛选的要求;通过对 70 000 个化合物进行筛选,得到了 5 个活性较高的化合物,其中,IMB-XZ5 对结核分枝杆菌的 MIC 为 4 ~ 8 μg/ml,且对结核分枝杆菌的作用具有较高的特异性。
建立了稳定性好、灵敏度较高的结核分枝杆菌丙氨酸消旋酶抑制剂高通量筛选模型,应用该模型筛选得到了具有较好抗结核活性的丙氨酸消旋酶抑制剂。
丙氨酸消旋酶; 抗结核药; 酶抑制剂; 高通量筛选
近年来结核病感染人数逐年攀升,2012 年全球结核病新增 860 万人,结核病死亡人数约 130 万人[1]。中国是结核病高负担国家,多药耐药结核病以及与 HIV 结合感染情况的增加,使结核病疫情的防控面临着更为严峻的挑战。快速研发新型抗结核药物,解决结核病治疗所面临的难题成为控制结核病疫情的当务之急。
针对已经确认的靶点寻找全新结构抗结核新药是最快捷而有效的途径。丙氨酸消旋酶(alanine racemase,ALR)是已经确认的抗结核药物靶点,该酶可以催化 L-丙氨酸与 D-丙氨酸之间相互转化[2-3]。D-丙氨酸是菌体细胞壁中肽聚糖合成的必需前体物质,而自然界中只存在天然来源的 L-丙氨酸,因此 L-丙氨酸进入菌体后必须通过 ALR 的催化作用生成 D-丙氨酸,用于细胞壁的合成[4]。ALR 广泛存在于原核细胞中,且在不同的生物体中的相似性较高,氨基酸序列覆盖率为 35% ~ 50%,在部分细菌中存在两个编码基因和,而结核分枝杆菌(,MTB)的基因组中只存在一个 ALR 的编码基因[5]。由于人体细胞中不存在 ALR,所以针对 ALR 靶点的抗菌药物在人体中具有高度的选择性。
ALR属于5-磷酸吡哆醛(pyridoxal 5'-phosphate,PLP)依赖型的异构酶家族,其活性构型是由两个 43 kD 的单体组合而成的二聚体结构,每个单体中含有两个活性结合位点:即 PLP 结合位点和丙氨酸结合位点[6],已经发现的 ALR 抑制剂中多数是以 PLP 结合位点为靶点的竞争性抑制剂,由于原核生物中 PLP 依赖型的酶普遍存在[7-8],所以,以ALR 为靶点的药物很可能是多靶点的。目前,作用于 ALR 的抗结核药物 D-环丝氨酸(D-cycloserine,DCS)已应用于临床,但由于其靶点不专一,毒副作用较大,临床使用受到了限制[9],且 DCS 的结构改造也没有明显改善其毒性[10-11]。因此,寻找针对 ALR 靶点的高效低毒的新型抗结核药物具有重要的意义。
本研究通过体外重组表达获得具有天然酶活性的 MTB ALR 蛋白,基于ALR 可以催化 L-丙氨酸和 D-丙氨酸之间互相转化,利用其逆反应生成 L-丙氨酸,加入级联反应酶 L-丙氨酸脱氢酶(L-alanine dehydrogenase,ALD)催化生成丙酮酸,同时将氧化型烟酰胺腺嘌呤二核苷酸(NAD)还原为还原型烟酰胺腺嘌呤二核苷酸(NADH),ALR 活性的变化将导致 NADH 的光密度的变化。我们利用该原理建立并优化了 MTB ALR 抑制剂的高通量筛选(HTS)模型,为针对以 ALR 为靶点的新型高效低毒的抗结核药物的发现提供了一种快速有效的方法。
1 材料与方法
1.1 材料
1.1.1 主要试剂 D-丙氨酸、L-丙氨酸、D-环丝氨酸、ALD、PLP、二甲基亚砜(DMSO)均购自美国 Sigma 公司;NAD 购自瑞士 Roche 公司;异丙基-β-D-硫代吡喃半乳糖苷(IPTG)购自美国 Merck 公司;CellTiter 96 AQuenous 单溶液细胞增殖检测试剂盒(MTS检测试剂盒)购自美国 Promega 公司;表达载体 pET28a 质粒本实验室保存;蛋白质分子量标准购自加拿大 Fermentas 公司;引物合成和质粒测序由上海生工生物工程技术服务有限公司完成;DNA 分子量标准、大肠杆菌 DH5α 和 BL21(DE3)pLysS 菌株均购自北京全式金生物技术有限公司。
1.1.2 仪器 DNA Engine®PCR 仪、PowerPacTM蛋白垂直电泳槽、Gel DOC 凝胶成像系统均为美国 Bio-Rad 公司产品;His trapTMHP 亲和层析柱、AKTA 蛋白纯化仪均为美国 GE 公司产品;EnpireTM酶标仪为美国 Perkin Elmer 公司产品;LegendTMMACH1.6/R 离心机为美国 Thermo 公司产品;Uibra CellTM细胞超声破碎仪为美国 Sonic 公司产品;Orion Model 828 型电子 pH 计为德国 Sartorius 公司产品;MCV-B161Sb 超净工作台为日本 Sanyo 公司产品。
1.2 方法
1.2.1 MTB ALR 表达载体的构建 以 MTB H37Rv 基因组为模板,以ALR-PF:5' CGGATGAAACGGTTCTGGGAGAATGTCGGAAAGC 3'(下划线为R I 酶切位点)和 ALR-PR:5' CATACCACGGTTTTCAGCCTCGCGA TAGGTCCT 3' 为引物(下划线为d III 酶切位点),进行 PCR 扩增,条件为:95 ℃预变性5 min;98 ℃变性 20 s,70 ℃复性 15 s,72 ℃延伸 1.5 min,30 个循环;最后 72 ℃反应 8 min。PCR 产物用R I 和d III 双酶切后与表达载体 pET28a 连接,转化进入DH5α。用含50 mg/L 卡那霉素的 LB 平板筛选阳性克隆,将测序正确的质粒转化进入BL21(DE3)pLysS,在含 50 mg/L 卡那霉素的 LB平板上筛选得到 ALR 蛋白稳定表达的菌株。基本操作参见分子克隆实验指南[12]。
1.2.2 MTB ALR 的表达与纯化 挑取单菌落于 LB 液体培养基中,37 ℃、200 r/min 过夜培养,以 1:100 的比例接种于含 100 mmol/L 山梨醇的 LB 培养基中,培养至600约为0.6。加入 IPTG 至终浓度为 20 μmol/L,加入乳糖至终浓度为 5 mmol/L,16 ℃、200 r/min 诱导过夜。低温离心收集菌体,加入裂解缓冲液(50 mmol/L NaH2PO4、300 mmol/L NaCl、30 mmol/L咪唑,pH 8.0),液氮-冰水反复冻融 5 次,再用细胞超声破碎仪在 70% 能量下,以 3 s/8 s 破碎 100 个循环,8000 ×离心 10 min 后收集上清。利用 Ni+亲和层析柱分离目的蛋白,上样前加入 PLP 至终浓度 0.5 mmol/L,用洗脱缓冲液(50 mmol/L NaH2PO4、300 mmol/L NaCl、500 mmol/L 咪唑,pH 8.0)与裂解缓冲液按比例进行梯度洗脱,得到的纯化产物用 SDS-PAGE 电泳进行检测,纯化的蛋白加入 PLP 至 0.1 mmol/L,置于–80 ℃下保存。
1.2.3 酶活测定及筛选条件的优化 酶活检测为 37 ℃下检测反应体系在 340 nm 下光密度(340)随时间的变化。酶活反应于 96 孔酶标板中进行,体系包括:100 mmol/L Tris-HCl(pH 8.0)、10 mmol/L NAD、0.1 U/ml ALD、10 mmol/L D-丙氨酸、0.3 μg ALR,终体积为 100 μl。分别在 4、25、30、34、37、42、48、52、58、65 ℃下处理30 min 后,进行 ALR 的活性测定。
筛选条件优化的参数包括:反应温度(28、31、34、37、40、45 ℃),反应pH值(2 ~ 11,间隔选取 17 个 pH 值),反应底物 NAD 浓度(20 ~ 0.16 mmol/L,二倍稀释)和 D-丙氨酸浓度(20 ~ 0.16 mmol/L,二倍稀释),级联反应酶 ALD 浓度(0.4、0.3、0.2、0.15、0.1、0.075、0.05、0.025 U/ml),ALR 酶量(16.80 ~ 0.26 U,二倍稀释)及 DMSO 比例(10%、8%、6%、4%、3%、2%、1%)。
Z'因子法是评价高通量筛选模型稳定性的一种重要方法。根据公式计算Z' 因子值:
Z' = 1 – 3(SDn + SDp)/(Vn – Vp)。
其中 Vn 和 SDn 分别为阴性对照孔的酶反应速率平均值和标准差;Vp 和SDp 分别为阳性对照孔的酶反应速率平均值和标准差。
1.2.4 酶抑制剂的高通量筛选 以优化后的反应条件进行筛选,每块 96 孔酶标板上设 88 个待测样品孔及 4 个阳性对照孔和 4 个阴性对照孔,其中阳性对照化合物为 DCS。每孔加入待测样品终浓度为 20 μg/ml,在 37 ℃条件下检测 40 min 内反应体系340的变化,计算酶的反应速率。利用反应速率计算样品对 ALR 的抑制率(IR):
IR(%)=(1 – VS/VN)× 100%
其中 VS代表待测样品孔的酶反应速率;VN代表阴性对照孔的平均酶反应速率。
根据以上条件,我们对本所化合物库中的70 000 余个化合物进行了初筛,选择 IR ≥ 50% 的样品作为活性样品,并按照初筛的反应条件和反应方法进行复筛,根据复筛的结果确定化合物对 ALR 的抑制率。
1.2.5 活性化合物的特异性评价及 IC50测定 该模型的反应体系中存在两步酶促反应,所以对具有抑制活性的化合物进行特异性评价,以排除假阳性样品。反应中直接加入 L-丙氨酸作为反应底物,加入级联反应酶 ALD 与筛选得到的抑制剂进行作用,利用优化后的反应条件进行抑制活性的评价。
采用优化后的反应条件测定抑制剂对 ALR 的 IC50值,化合物浓度为 200、100、50、25、12.5、6.25、3.12、1.56、0 μg/ml,计算出抑制率后使用 origin 8.1 分析各抑制剂的 IC50。
1.2.6 抗结核活性测定 于 96 微孔板中进行,用 7H9 培养基[含10% 的 ADC(白蛋白、葡萄糖、过氧化氢酶)、0.05% 的吐温 80]对抑制剂进行二倍稀释,终浓度分别为 128、64、32、16、8、4、2、1、0.5、0.25、0.12 μg/ml,结核分枝杆菌的接种量约为2 × 105cfu/ml,稀释菌液于 15 min 内接种完毕,于 37 ℃孵育 10 d 观察结果。
1.2.7 活性化合物的细胞毒性及抗菌谱初步评价 选择具有抗结核活性的化合物检测对小鼠巨噬细胞 J774A.1 的细胞毒性。将新鲜传代的J774A.1 细胞接种至 96 孔板中,每孔约 2 × 104个细胞,37 ℃、5% CO2环境下孵育至细胞贴壁,加入活性化合物至终浓度为 100、50、25、12.5、6.25、3.12、1.56、0.78 μg/ml,孵育 24 h,分别加入 10 μl MTS 检测液孵育 2 h,480 nm 条件下检测吸光度,使用 origin 8.1 分析化合物的 TC50。选取 20 株不同的菌株进行抗菌谱测定,同样利用二倍稀释法测定抑制剂对不同菌株的 MIC 值,评价化合物抗菌活性的特异性。
2 结果
2.1 ALR 表达载体的构建
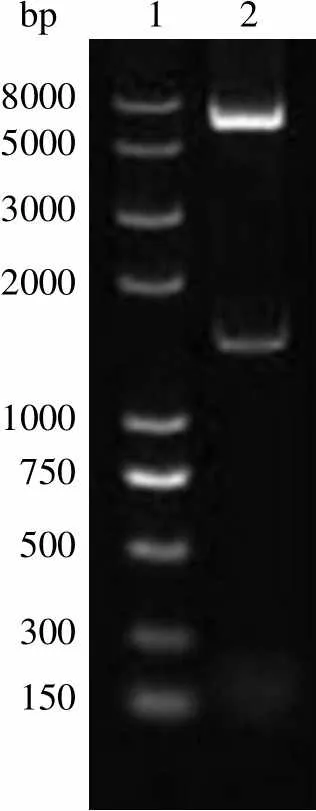
PCR 产物经 1% 的琼脂糖凝胶电泳鉴定,得到了长度为 1227 bp 的基因(图 1)。通过菌落 PCR 选取阳性的转化菌落,提取质粒 pET28a::,用双酶切的方法进一步验证(图 2)。酶切鉴定正确的质粒进行序列测定,测序结果与 Genebank 中 H37Rv 的基因(Rv3423c,NC_000962.3)序列进行比对,比对结果一致。

bp 1 2 8000500030002000 1000750500 300150
Figure 1 PCR product of
bp 1 2 8000500030002000 1000750500 300150
Figure 2 Restriction enzymatic analysis of pET28a::
2.2 ALR 的表达和纯化
对表达纯化得到的重组 MTB ALR 蛋白进行SDS-PAGE 分析,相对分子质量约 48 kD,与理论预期一致。虽然大部分表达的 ALR 蛋白在沉淀当中,但上清经纯化后也可以看到明显的目的条带,并且为单一条带(图 3)。

kD1 2 3 4 5 6 7 8 9 10 957255433426 1710
Figure 3 SDS-PAGE of expressed and purified ALR protein
2.3 酶活测定及酶稳定性测定
ALR 酶活测定原理是应用吸光光度法检测体系中反应产物 NADH 的浓度变化来反映 ALR 的酶活。结果表明,NADH 在低浓度范围内与其340成线性关系(图 4)。ALR 酶活力的定义:37 ℃反应条件下,每分钟催化生成 1 μmol/L NADH 的酶量设定为 1 U。纯化后 ALR 为 62.63 μg/ml,酶比活力为13.53 kU/mg。ALR 在 52 ℃以下处理 30 min 活性基本保持稳定,52和58 ℃处理使酶活有所下降,65 ℃处理酶活下降明显(图 5)。

OD3403.5 3.0 2.5 2.0 1.5 1.0 0.5 0 10 20 30 40 50 60 70 NADH 浓度 (mmol/L)Concentration of NADH (mmol/L)
Figure 4 Relationship between the concentration of NADH and340

反应速度(mmol/L∙min)V0 (mmol/L∙min)0.09 0.08 0.07 0.06 0.05 0.04 0.03 0.02 0 10 20 30 40 50 60 70 温度(℃)Temperature (℃)
Figure 5 Stability of ALR
2.4 筛选条件的优化及高通量筛选模型的评价
酶反应温度在 37 ℃以下时,随着温度的升高,ALR 反应速度增加,40 ℃时反应速度有所下降,可能酶部分失活,45 ℃时反应速度小幅提升,但在 40 ℃和 45 ℃下酶反应速度波动误差较大,可能是温度的升高影响了模型及仪器的稳定性,为保证模型稳定性,选择第一个峰值 37 ℃为筛选温度。体系中 pH 大于 7 时,ALR 表现出酶活力,并随着 pH 的升高酶活力逐渐增加,pH > 9 时,酶活力变化幅度减小,体系碱性过强可能影响筛选化合物的稳定性,故筛选的 pH 确定为 8.5 ~ 9.0。随着底物浓度的增加,酶反应速度逐渐提高达到平台期,最佳D-丙氨酸浓度为10 mmol/L,最佳 NAD 浓度为 10 mmol/L,最佳 ALR 酶量为 4.2 U,最佳级联反应酶 ALD 的浓度为 0.08 U/ml。DMSO 的浓度对 ALR 酶活力影响较小,1% 的 DMSO 对反应体系基本没有影响(图 6)。
目前广泛使用的 HTS 模型的稳定性和可靠性评估参数是 Z'因子,它是一个统计学参数,一般认为,如果 1 > Z' > 0.5,说明该筛选模型是比较理想的,适合于 HTS 的方法。本实验中 HTS 的 Z'因子值为 0.76,且所有评价参数均符合 HTS 模型的标准(表 1)。因此,所建立的筛选方法是一种稳定性和灵敏度都较好的 HTS 方法。
2.5 ALR 抑制剂的筛选及 IC50测定
采用建立的 HTS 筛选模型,对本所化合物库内的 70 000 余个化合物进行筛选,得到 5 个抑制率≥ 50% 的化合物,且对二级酶联反应中 ALD 抑制活性 < 30%,分别测定它们对 ALR 的 IC50,结果见表 2。

反应速度(mmol/L∙min)V0 (mmol/L∙min)0.120.110.100.090.080.070.060.050.04 反应速度(mmol/L∙min)V0 (mmol/L∙min)0.160.140.120.100.080.060.040.020–0.02 25 30 35 40 45 50 2 4 6 8 10 12 温度(℃)Temperature (℃)A pH 值pH valueB

反应速度(mmol/L∙min)V0 (mmol/L∙min)0.080.070.060.050.040.030.020.010–0.01 反应速度(mmol/L∙min)V0 (mmol/L∙min)0.080.070.060.050.040.030.020.010–0.01 5 10 15 20 25 5 10 15 20 25 D-丙氨酸浓度(mmol/L)Concentration of D-alanine (mmol/L) C NAD 浓度(mmol/L)Concentration of NAD (mmol/L)D

反应速度(mmol/L∙min)V0 (mmol/L∙min)0.080.070.060.050.040.030.020.010–0.01 反应速度(mmol/L∙min)V0 (mmol/L∙min)0.140.120.100.080.060.040.020 0.1 0.2 0.3 0.4 0.5 5 10 15 20 LAD 浓度(U/ml)Concentration of LAD (U/ml)E ALR 蛋白的酶活力单位(U)Activity of ALR (U)F

反应速度(mmol/L∙min)V0 (mmol/L∙min)12 10 8 6 4 2 0 2 4 6 8 10 12 DMSO 浓度(%)Concentration of DMSO (%)G
Figure 6 Optimization of screening conditions (A: Optimization of temperature; B: Optimization of pH value; C: Optimization of D-alanine concentration; D: Optimization of NAD concentration; E: Optimization of LAD concentration; F: Optimization of enzyme concentration; G: Effect of DMSO concentration)
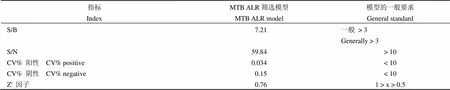
表 1 MTB ALR 高通量筛选体系的评价
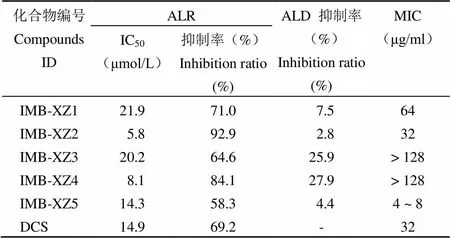
表 2 活性化合物的酶抑制率、IC50及抗结核活性 MIC
2.6 ALR 抑制剂的生物学活性评价
2.6.1 ALR 抑制剂的抗结核活性测定 经过 3次重复试验,测定 ALR 抑制剂对敏感和耐药MTB 的抑菌活性,其中有 3 个化合物表现出了一定的抗结核活性,化合物 IMB-XZ5 的抗结核活性最强,MIC = 4 ~ 8 μg/ml(表 2)。
2.6.2 活性化合物 IMB-XZ5 的细胞毒性评价 化合物 IMB-XZ5 的细胞毒性较低,100 μg/ml 浓度下仍未达到 50% 的细胞致死率,所以该化合物对 J774A.1 的 TC50大于 100 μg/ml。
2.6.3 活性化合物 IMB-XZ5 的抗菌谱测定 选取抗结核活性较好的化合物IMB-XZ5 进行抗菌谱测定,其对不同菌株的 MIC 如表 3 所示,该化合物对 MTB 的抗菌活性表现出了很好的特异性。
3 讨论
ALR 是结核分枝杆菌自然状态下生存所必需的,ALR 的缺失会使 MTB 在巨噬细胞及小鼠体内无法生存[13],且人体中不需要 ALR 的功能存在,所以 ALR 一直是抗结核药物开发的重要靶点,而 DCS 的临床应用也进一步确证了 ALR 作为抗结核药物靶点的可行性。但是临床中以 ALR为靶点的抗结核药物只有 DCS,且由于其毒性较大,在临床使用中受到限制,只能作为二线药物用于结核病的治疗[9]。DCS 以及近年来发现的新型 ALR 抑制剂大多是 PLP 的拮抗剂,由于 PLP 依赖型的酶广泛存在,所以抑制剂在作用过程中也并没有很好的选择性[6]。因此,寻找具有新型作用机制的 MTB ALR 抑制剂成为本研究的重点。

表 3 活性化合物 IMB-XZ5 对不同菌株的 MIC
为了建立 MTB ALR 抑制剂的 HTS 模型,我们构建了 MTB ALR 的重组表达载体,并纯化得到了 ALR 可溶性蛋白。在蛋白纯化过程中,我们发现在常规的诱导条件下,ALR 蛋白多数形成包涵体,可溶性差。为此我们优化了蛋白表达条件,在培养基中加入山梨醇及乳糖,同时降低 IPTG 浓度,使诱导条件更加温和。另外,优化裂解液的 pH 值,加强菌体的破碎力度,使蛋白更好地释放溶解。最终,我们得到了纯度较高的可溶性 ALR。经过酶活测定,ALR 可用于模型的高通量筛选。
本实验依据 ALR 可以催化 L-丙氨酸消旋生成 D-丙氨酸的逆反应,级联L-丙氨酸在 LAD 的作用下生成丙酮酸,同时催化 NAD 还原生成 NADH,从而利用 NADH 的吸收特性对 ALR 蛋白的活性进行测定。通过对反应体系的温度、pH、底物浓度、反应酶量、DMSO 等条件的优化,建立了 ALR 抑制剂的 HTS 筛选模型,其 Z'因子值约为 0.76。通过对本所化合物库中 70 000 个化合物的筛选,表明该模型具有快速、灵敏、稳定等特点,为寻找和发现 MTB ALR 的抑制剂提供了一种新的技术和方法。利用该模型,我们也发现了 5 个具有 ALR 抑制活性的化合物(抑制率 > 50%)。其中抑制活性最强的化合物 IC50值为 5.8 μmol/L。随后我们对这 5 个抑制剂的抗结核活性进行了测定,发现其中有 3 个化合物表现出了一定的抗结核活性,抑制剂 IMB-XZ1、IMB-XZ2 和 IMB-XZ5 的抗结核 MIC 分别为 64、32 和 4 ~ 8 μg/ml。其中化合物 IMB-XZ5 的抗结核活性高于 DCS(MIC = 32 μg/ml),具有进一步研究的意义,而 IMB-XZ2 的酶抑制活性最高,但是抗结核活性较弱,可能与化合物的细胞通透性有关。对于酶抑制活性较强而抗结核活性不明显的化合物,我们将对其进行一系列的结构改造,以改善其细胞通透性及抗菌活性。我们又进一步测定了 IMB-XZ5 对小鼠巨噬细胞的毒性及对其他菌株的抗菌谱特性,发现该化合物细胞毒性低,且对 MTB 具有很好的选择性。鉴于已发现的多数 ALR 抑制剂,包括二线抗结核药物 DCS 均缺乏对 MTB 的选择性,而我们得到的 IMB-XZ5 的抗结核活性强于 DCS,且毒性较低、特异性较强,所以,IMB-XZ5 具有很好的发展前景及研究意义。但是,由于该化合物对 MTB ALR 的酶抑制活性偏低,所以我们怀疑该化合物的作用靶点可能不专一,对于该化合物的作用机制和作用靶点的研究仍在进行中,同时其体内抗结核活性及药代动力学性质也有待进一步研究。
[1] World Health Organization. Global tuberculosis report 2013. (2014- 01-03). http://www.who.int/tb/publications/global_report/en/.
[2] Ondrechen MJ, Briggs JM, McCammon JA. A model for enzyme-substrate interaction in alanine racemase. J Am Chem Soc, 2001, 123(12):2830-2834.
[3] Lambert MP, Neuhaus FC. Mechanism of D-cycloserine action: alanine racemase from Escherichia coli W. J Bacteriol, 1972, 110(3): 978-987.
[4] Milligan DL, Tran SL, Strych U, et al. The alanine racemase of Mycobacterium smegmatis is essential for growth in the absence of D-alanine. J Bacteriol, 2007, 189(22):8381-8386.
[5] Strych U, Penland RL, Jimenez M, et al. Characterization of the alanine racemases from two mycobacteria. FEMS Microbiol Lett, 2001, 196(2):93-98.
[6] Anthony KG, Strych U, Yeung KR, et al. New classes of alanine racemase inhibitors identified by high-throughput screening show antimicrobial activity against Mycobacterium tuberculosis. PLoS One, 2011, 6(5):e20374.
[7] Fenn TD, Stamper GF, Morollo AA, et al. A side reaction of alanine racemase: transamination of cycloserine. Biochemistry, 2003, 42(19): 5775-5783.
[8] Toney MD. Reaction specificity in pyridoxal phosphate enzymes. Arch Biochem Biophys, 2005, 433(1):279-287.
[9] Yew WW, Wong CF, Wong PC, et al. Adverse neurological reactions in patients with multidrug-resistant pulmonary tuberculosis after coadministration of cycloserine and ofloxacin. Clin Infect Dis, 1993, 17(2):288-289.
[10] Kim MG, Strych U, Krause K, et al. N(2)-substituted D, L-cycloserine derivatives: synthesis and evaluation as alanine racemase inhibitors.
J Antibiot (Tokyo), 2003, 56(2):160-168.
[11] Kim MG, Strych U, Krause K, et al. Evaluation of amino-substituted heterocyclic derivatives as alanine racemase inhibitors. Med Chem Res, 2003, 12(3):130-138.
[12] Sambrook J, Fritsch EF, Maniatis T. Molecular cloning. Jin DY, Li MF, Translation. 2nd ed. Beijing: Science Press, 1992:34-55. (in Chinese)
萨姆布鲁克, E.F沸里奇,曼尼阿蒂斯. 分子克隆实验指南. 金冬燕, 黎孟枫, 译. 2版. 北京: 科学出版社, 1992:34-55.
[13] Awasthy D, Bharath S, Subbulakshmi V, et al. Alanine racemase mutants of Mycobacterium tuberculosis require D-alanine for growth and are defective for survival in macrophages and mice. Microbiology, 2012, 158(Pt 2):319-327.
Establishment and application of a novel high throughput screening model targeting alanine racemase fromH37Rv
ZHOU Shuang, MENG Jian-zhou, GUAN Yan, HU Xin-xin, SI Shu-yi, XIAO Chun-ling
To establish a high throughput screening (HTS) model targeting(MTB) alanine racemase (ALR) for the discovery of novel antitubercular drugs and to determine inhibitory activities against MTB of the inhibitors.
The H37Rv ALR coding genewas amplified and cloned into pET28a expression vector. The recombinant ALR was expressed inBL21(DE3)pLysS and its activity was measured by detecting the absorption at 340 nm wavelength. HTS model was established based on the activity of ALR and Z' factor was used to evaluate the quality of HTS model. About 70 000 compounds were screened using this model and the IC50of inhibitors were determined. Inhibitory activities against H37Rv and some other bacteria strains of the inhibitors were also evaluated.
Recombinant H37Rvvector was successfully constructed and expressed, with the optimal enzymatic activity of ALR being 13.53 kU/mg. The parameters suggested that this HTS model was highly stable and feasible for HTS drug screening. Of the 70 000 compounds, 5 compounds appeared inhibitory activities to ALR in this HTS model. The inhibitor IMB-XZ5 was determined active against H37Rv with the MIC 4 - 8 μg/ml and the specificity was obvious.
A steady and sensitive HTS model for MTB ALR inhibitors was established. One of the ALR inhibitors was evaluated and has potential to become an active and specific anti-TB lead compounds.
Alanine racemase; Antitubercular agents; Enzyme inhibitors; High throughput screening
XIAO Chun-ling, Email: xiaocl318@163.com
10.3969/cmba.j.issn.1673-713X.2014.02.006
“重大新药创制”国家科技重大专项(2012ZX09301002- 003/001 014)
肖春玲,Email:xiaocl318@163.com
2013-12-16
Author Affiliation: The National Laboratory for Screening New Microbial Drugs, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China

