人脱细胞软骨细胞外基质对异种软骨种子细胞的影响
高钺,刘舒云,黄靖香,郭维民,陈继凤,张莉,赵斌,彭江,汪爱媛,王玉,许文静,卢世璧,郭全义
人脱细胞软骨细胞外基质对异种软骨种子细胞的影响
高钺,刘舒云,黄靖香,郭维民,陈继凤,张莉,赵斌,彭江,汪爱媛,王玉,许文静,卢世璧,郭全义
100853 北京,中国人民解放军总医院骨科研究所
观察人脱细胞软骨细胞外基质(hACAM)对异种兔软骨种子细胞增殖和表型的影响。
将差速梯度离心法制作的人脱细胞软骨细胞外基质,配制成 0.5% 的浆料,分别铺于 6 孔细胞培养板和 96 孔细胞培养板,形成 1 mm 厚的薄膜,以此培养板为实验组。空白对照组培养板仅使用单纯培养液培养。在培养板上培养兔关节软骨细胞。通过 hochest33258 染色验证人软骨细胞外基质脱细胞完全与否;分别在第 5、15 天两个时间点,通过倒置显微镜、甲苯胺蓝染色观察两种培养方法的兔软骨细胞的生长形态、细胞表型和增殖情况,用 CCK-8 细胞增殖实验比较两种培养方法在第1、3、7、10 天的增殖情况。
通过 hochest33258 染色发现差速梯度离心的人软骨细胞外基质脱细胞完全。通过倒置显微镜观察第 5 和15 天的实验组细胞增殖情况优于空白对照组,甲苯胺蓝染色的结果也证明这个观点;CCK-8 细胞增殖试验显示第 7 天 hACAM 组在细胞增殖方面明显地优于单纯培养液的对照组(= 0.0298),hACAM 组的软骨细胞与空白组的软骨细胞在第 10 天的增殖情况相比没有统计学差异。
hACAM 免疫原性低,无细胞毒性,能够很好地促进异种软骨细胞的增殖。
细胞外基质; 软骨; 软骨细胞; 组织工程; 细胞增殖
关节软骨损伤是临床上常见的疾病,由于关节软骨自我修复能力有限,目前的一些传统方法尚无法获得满意的治疗效果[1-2]。通过构建组织工程软骨或骨软骨复合体来修复软骨缺损被认为是目前较有前景的治疗手段。在组织工程研究领域,种子细胞、可降解的支架材料以及信号因子并称为组织工程的三大基本要素,其中种子细胞在软骨组织工程方法修复过程中起着至关重要的作用。软骨细胞是软骨组织工程最常用的种子细胞,但软骨细胞增殖数量有限、体外培养易出现去分化等缺陷,是目前软骨组织工程大量应用的瓶颈[1]。目前软骨组织最常用的细胞外支架材料为人工合成材料:如聚羟基乙酸(polyglycolic acid,PGA)、聚乳酸(polylactic acid、PLA)等。但由于人工合成材料本身为异物,有可能导致过敏、感染等问题[2]。比起人工合成的支架材料,人脱细胞软骨细胞外基质(human articular cartilage acellular matrix,hACAM)用优选的方法脱去了具有免疫原性的细胞,保留了大量对细胞黏附、增殖有利的蛋白多糖和 II 型胶原等,该基质在经过处理做成支架以后的力学性质与天然的软骨也很相近[3],而且还具有能提供对细胞黏附有益的信号分子[4]。有实验研究证实脱细胞耳软骨基质可以促进同种耳软骨种子细胞增殖,而且可以修复耳软骨缺损[5-6],因此,我们认为人关节软骨的 hACAM 也能对兔软骨种子细胞增殖和表型维持起到一定的作用,本实验的目的在于探索 hACAM 对异种软骨种子细胞的影响[7]。
1 材料与方法
1.1 材料
1.1.1 试剂和仪器 小鼠抗人II型胶原蛋白抗体购自北京世安科兴科技公司;BCPCAS 4800 型扫描电子显微镜、低温高速离心机为美国贝克曼公司产品;IX70-121 型荧光显微镜为日本 Olympus 公司产品;H-DMEM 培养基分别为美国 Hyclone 和 Gibco 公司产品;胰蛋白酶、胎牛血清(FBS)为美国 Gibco 公司产品,0.2% 的II型胶原酶为美国 Sigma 公司产品;II型胶原抗体(SC-28887)、“三抗体”(青霉素、链霉素、两性霉素)购自上海碧云天生物技术研究所;Gen5 酶标仪为美国BioTek 公司产品;CCK-8 为美国 Sigma-Aldrich 公司产品。
1.1.2 实验动物 雄性新西兰白兔,4 月龄,2.5 kg,解放军总医院实验动物中心提供。所有动物实验方案均经解放军总医院伦理委员会批准。
1.1.3 软骨组织 人软骨取自关节置换的正常软骨部分。
1.2 方法
1.2.1 hACAM 的制备及培养板的包被 采用改良脱细胞方法[8-9],双氧水漂洗软骨组织,将其切成片状后以无菌 PBS 溶液漂洗,用匀浆机制成悬浮的浆料,分离大颗粒的悬浮微粒,将悬浮微粒多次、不同转速离心,获得 hACAM。将 hACAM 稀释至 0.5%(W/V)铺于试验组细胞培养板上,酒精固定后,用 PBS 清洗,风干,于 4 ℃保存。实验组和空白对照组的细胞培养板分别有两种,一种底部没有铺盖玻片,另一种底部铺有盖玻片,方便以后的染色。hACAM 包被的培养板在使用前用 PBS 洗涤 2 次[10]。
1.2.2 软骨细胞分离培养 无菌打开 4 月龄新西兰兔软骨的膝关节和肩关节,用尖刀削下关节软骨,置于培养皿中,PBS 洗涤 2 次,每次 2 min,弃去上清液。用眼科剪将软骨块剪至极小块之后加入II型胶原酶,用吸管充分吹打混匀后,置于37 ℃、5% CO2、饱和湿度的培养箱中消化 2 h(隔 30 min 用移液器吹打 1 次,每次持续 1 min);加入 8 ml 含10% FBS 的 H-DMEM 培养液终止消化,充分吹打混匀后收集至 15 ml 的离心管中,以599 ×离心 5 min,弃上清,加入 7 ml 培养液,充分吹打混匀,取混悬液分至培养瓶中,置培养箱培养[11-12]。24 h 后进行首次换液,此后隔日换液。显微镜下观察细胞生长情况,当细胞生长面积达到培养瓶底部的 70% ~ 80% 后,用胰蛋白酶消化细胞,进行传代培养。用第二代(P2)的兔关节软骨细胞接种到实验组和空白对照组的培养板上。
1.2.3 形态学和组织学染色
⑴甲苯胺蓝染色:将分离出来的 P2 兔关节软骨细胞和分别在 hACAM 组和空白对照组的兔关节软骨细胞用 PBS 洗 2 次,每次 5 min,10% 甲醛固定 15 min,然后用 PBS 洗涤 2 次,每次5 min,室温下加 1% 甲苯胺蓝染色,37 ℃孵育2 h;去除多余的染料,PBS 洗 2 次,每次 5 min。倒置荧光显微镜下观察并拍照。
⑵番红 O 染色:将脱细胞后的 hACAM 涂在载玻片上,酒精固定,三蒸水清洗后,Weigert 苏木精染色 3 min,自来水冲洗,在酸性酒精(加入 1%盐酸的 70%酒精)中使之分化 15 s,自来水冲洗 3 min,在 0.02%碱性孔雀绿水溶液中染色3 min,在 1%的醋酸中快速漂洗,载玻片引流,在 0.1% 的番红 O 水溶液中染色 3 min,95%酒精冲洗,脱水,清理,封片观察。
⑶II型胶原免疫组化染色:将兔关节软骨上分离出来的软骨细胞用多聚甲醛固定漂洗后晾干,3% 的双氧水室温孵育 10 min,以消除内源性过氧化物酶活性,PBS 漂洗 3 次,每次 5 min,弃封闭液,滴加 1:100 的II型胶原抗体,4 ℃过夜,PBS 漂洗 3 次,每次 5 min,然后加入生物标记的二抗,37 ℃孵育30 min,PBS 漂洗 3 次,每次 5 min,DAB/双氧水显色,苏木素复染,常规封片照相。
1.2.4 扫描电镜观察 将种植有兔软骨种子细胞的细胞外基质(extracellular matrix,ECM),用缓冲液漂洗,3% 戊二醛固定 2 h 以上,0.1 mol/L 磷酸缓冲液漂洗 3 次,每次 15 min,1% 锇酸固定2 h,采用 50%、70%、80%、90%、95% 的酒精各 15 min 梯度脱水,然后换醋酸异戊酯脱水 15 min,冷冻干燥,镀膜,把标本置于扫描电镜下面观察。
1.2.5 CCK-8 细胞增殖试验 将兔软骨细胞接种到 hACAM 铺板的 96 孔平板上(2 × 103个/孔),每个时间点每个样品 7 个孔,用软骨细胞培养液培养,并于第 1、3、7、10 天进行检测。每孔加入 10 μl CCK-8,37 ℃孵育 2 h,使用空白培养板作对照,测量在 492 nm 处的值,进行统计学分析[13-14]。
1.3 统计学处理

2 结果
2.1 细胞形态及活性检测
对差速梯度离心脱细胞前后的 hACAM 进行hochest33258 染色,结果显示脱细胞完全(图1)。组织学染色发现 hACAM 中含大量糖胺多糖、透明质酸,证明在差速梯度离心脱细胞中去除免疫原性的同时保留了多种软骨细胞外基质的成分(图 2)。通过电镜观察(图 3),铺在 6 孔板的 hACAM 质地均一,胶原含量丰富。分离的兔关节软骨原代细胞刚接种时呈球形,悬浮于培养液中,12 h 后大多数细胞开始贴壁,细胞逐渐呈短梭状,或多角形、星形,体积小,生长缓慢。第 7 天,细胞有 90% 融合,呈多角形,形态均一[15]。P2 代兔软骨细胞的甲苯胺蓝染色和免疫组化染色为阳性,证实其增殖和生长情况良好,并能很好地分泌软骨细胞基质(图 4)。

图 1 hACAM 的 hochest33258 染色(A:脱细胞前;B:脱细胞后)
Figure 1 Hochest33258 staining of hACAM (A: Before the decellularization; B: After the decellularization)
光镜观察脱细胞软骨膜基质呈均质的细颗粒状,脱细胞软骨细胞外基质呈不规则、边缘略模糊的蜂巢样结构。P2 代软骨细胞种植后,其形态为轮廓清晰的圆形,核明亮而清楚,可偏向细胞的一侧,有较强的折光性[6]。光镜下可见,在第 5、15 天时,hACAM 组生长的兔软骨细胞的增殖情况明显优于空白对照组的兔软骨细胞(图 5),甲苯胺蓝染色结果可见软骨细胞增殖有明显差异(< 0.05)(图 6)。
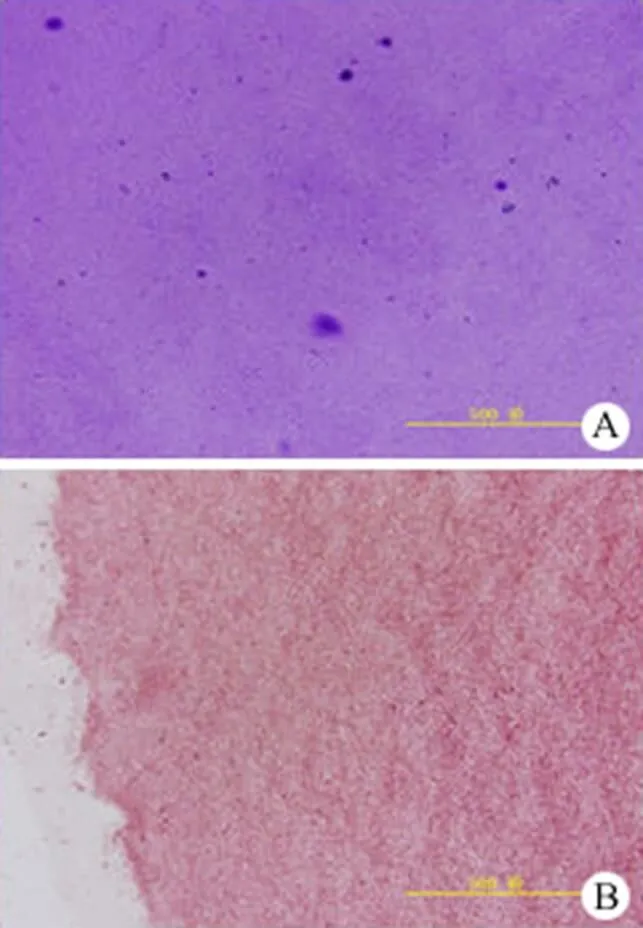
图 2 hACAM 的组织学染色(A:甲苯胺蓝染色;B:番红 O 染色)
Figure 2 Histological stainings of hACAM (A: Toluidine blue staining; B: Saffron O staining)

图 3 铺膜后未接种细胞的 hACAM 电镜图
Figure 3 The SEM image of hACAM-plated not seeding chondrocytes
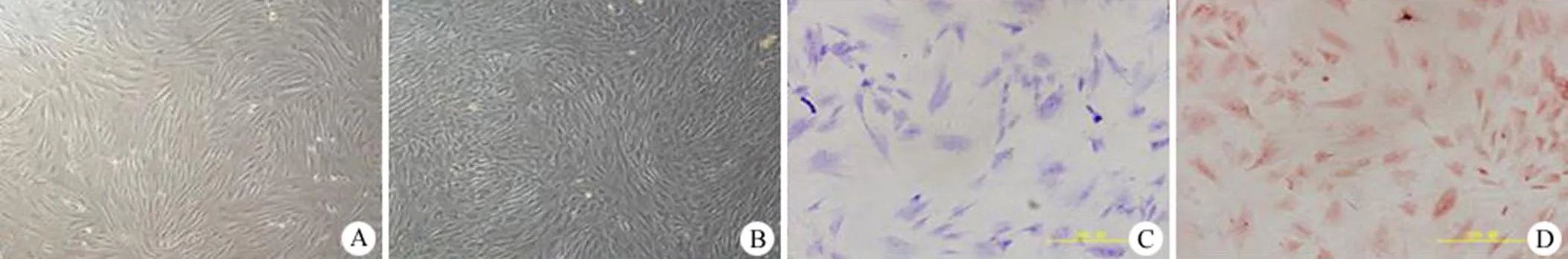
图 4 兔关节软骨细胞的光镜观察和组织化学染色(A:第1 天的 P2 代兔软骨细胞;B:第3 天的 P2 代兔软骨细胞;C:P2 代兔软骨细胞甲苯胺蓝染色;D:P2 代兔软骨细胞II型胶原免疫组织化学染色)
Figure 5 Light microscope images and histological staining of the rabbit cartilage chondrocytes (A: Passage 2 of rabbit cartilage chondrocytes after 1d; B: Passage 2 of rabbit cartilage chondrocytes after 3d; C: Toluidine blue staining of P2 chondrocytes; D: Collagen II immunohistochemistrical staining of the P2 rabbit chondrocytes)
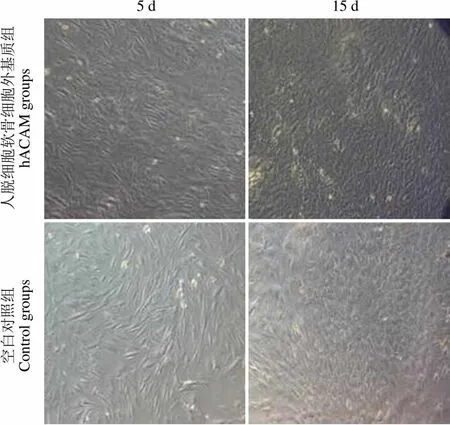
5 d 15 d 人脱细胞软骨细胞外基质组hACAM groups 空白对照组Control groups
Figure 5 Rabbit chondrocytes of hACAM-plated groups and control groups
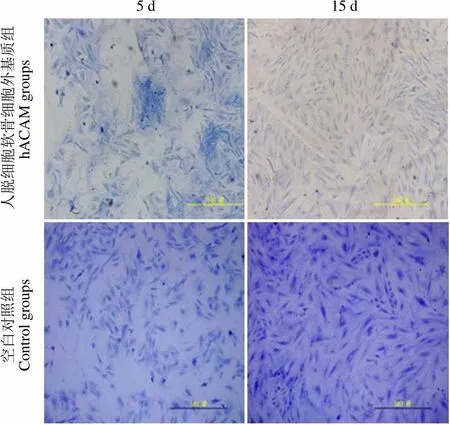
5 d 15 d 人脱细胞软骨细胞外基质组hACAM groups 空白对照组Control groups
Figure 6 Toluidine blue staining of the rabbit chondrocytes of the hACAM-plated groups and control groups
2.2 CCK-8 细胞增殖试验
从 CCK-8 的增殖柱状图(图 7)可以看出,随着时间的推移,hACAM 组的软骨细胞增殖优于空白对照组,在第 7 天,hACAM 组的软骨细胞的增殖情况明显地优于空白对照组(= 0.0298);在第 10 天,hACAM 组的软骨细胞与空白对照组的软骨细胞的增殖情况相比没有统计学差异。
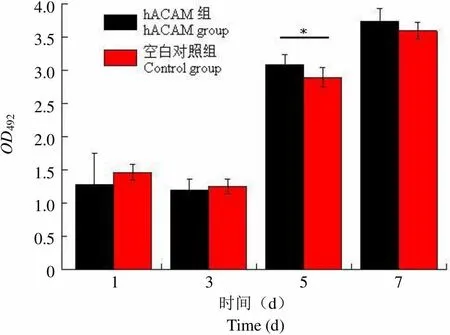
OD4924.03.53.02.52.01.51.00.50 1 3 5 7 时间(d)Time (d)
Figure 7 Rabbit chondrocytes proliferation experiment of the CCK-8 (*< 0.05)
3 讨论
软骨病变是骨科较为常见的疾患,同时由于关节软骨自我修复能力有限,而目前的多种治疗方法,如微骨折术、自体或异体组织(骨膜、软骨膜、骨软骨块)移植等,又存在种种缺陷,限制了其临床应用[16-17],并且不能获得满意的治疗效果。组织工程方法的发展和应用为关节软骨的修复提供了新的思路和途径。应用组织工程技术构建组织工程软骨被认为是目前最有可能解决此难题的技术手段[18-23]。
软骨组织由单一的软骨细胞和细胞外基质组成,细胞只占软骨组织体积的 3%,其余均为细胞外基质。软骨无血管,故以糖酵解为主,但是成熟软骨细胞本身的代谢非常活跃,软骨细胞合成和分泌各种细胞外基质的同时,也合成和分泌多种基质降解酶,因此软骨细胞对基质的形成和维持起着重要的调节作用,另一方面基质成分反过来也调节着软骨细胞的功能[15]。有研究表明,灭活的软骨组织可作为细胞生长的支架[24]。因此,我们认为脱细胞的 hACAM 也很有可能成为软骨种子细胞很好的生长场所。况且 hACAM 富含透明质酸、糖胺多糖及胶原等,还包括很多生长因子,诸如胰岛素生长因子(insulin-like growth factor I,IGF-1)、碱性成纤维生长因子(basic fibroblast growth factor,bFGF)、转化生长因子 β(transforming growth factor β,TGF-β)、血小板生长因子(platelet-derived growth factor,P-DGF)、表皮生长因子(epidermal growth factor,EGF)和其他细胞外基质蛋白[4]。这些生长因子和 ECM 结构蛋白构成了一种微环境,不仅能提供结构支持,还能保持细胞的表型[25-26]。本实验的目的在于观察 hACAM 对软骨种子细胞的增殖及表型维持的影响,探索使兔软骨种子细胞大量扩增及维持表型的方法。
组织脱细胞的研究出现在 20 世纪 90 年代,它的原理是通过去除组织的移植免疫原性,从而获得一种天然的无免疫排斥反应的组织替代物。脱细胞目的是在去除细胞、可溶性蛋白、核酸等引起免疫反应的物质的同时,尽可能保留 ECM 成分,保持其生物活性和生物力学性能[27]。目前,来源于肌腱、韧带、小肠黏膜下层、膀胱、肝[28-31]等组织和器官的生物支架材料均是经过脱细胞处理得到的。ECM 材料是目前再生医学和组织工程研究的热点,无论是在动物实验还是临床应用上都表现了良好的应用前景。常用的脱细胞方法有离子去垢剂法、双性离子法、酶法、高渗或低渗溶液法、螯合剂法、差速梯度离心法等,非离子的 Triton X-100 脱细胞剂会造成大量的糖胺多糖的流失和层黏连蛋白、纤维连接蛋白含量的降低,甚至有的组织使用 Triton X-100 长达 4 d 还不能完全除去细胞的碎片[30-32];其中差速梯度离心法比起其他脱细胞方法,能够避免其他杂质掺入到材料中,极大地降低细胞毒性,更多地保留 ECM 蛋白和生长因子[27]。脱细胞人软骨细胞外基质是生物新鲜组织经过物理方法处理,脱去组织中的所有细胞、抗原等物质后所得到的产物,主要包括胶原、弹性蛋白、非胶原糖蛋白、蛋白多糖和糖胺多糖,基本保留了细胞外基质的主要成分和结构。脱细胞基质的主要特点是具有良好的生物相容性、柔韧性、低抗原性。脱细胞软骨基质可以作为一种天然支架,在体外培养过程中无降解变形,保留了培养前的结构,与软骨细胞共同培养,软骨细胞能在其表面生长,并产生基质,说明脱细胞软骨基质具有良好的稳定性,对软骨细胞无明显毒性作用,其本身具有软骨细胞生长的原始结构和环境,在体内具有诱导软骨细胞生长的作用[33]。
因此,本实验选择差速梯度离心法[8]制作hACAM,保留了蛋白多糖、糖胺聚糖、胶原和生长因子等有效成分,最大限度去除了材料的免疫原性,改善了细胞的生长环境。组织学结果证实经脱细胞处理后的 hACAM,不但把软骨细胞外基质细胞成分完全脱除,而且保留了蛋白多糖等主要的 ECM 成分。本实验以同等密度种植兔软骨种子细胞于空白培养板上作为空白对照组。两组都以同样的单纯软骨培养基进行培养。通过倒置显微镜和组织学染色发现,随时间的推移,hACAM 组的兔软骨细胞的增殖情况较空白对照组更好。通过扫描电镜可以看到 hACAM 的胶原交叉地排列在培养板的底部,这些胶原蛋白具有张力和剪力特性,固定基质中的蛋白多糖给软骨细胞提供更好的黏附环境,增强软骨细胞增殖的可持续性。甲苯胺蓝组织学染色同样证明 hACAM 上的软骨细胞增殖优于空白对照组。
综上,本实验通过物理方法制备的 hACAM 免疫原性低,无细胞毒性作用,有适合细胞生长需要的糖胺聚糖、胶原和生长因子等成分,能够很好地促进软骨细胞的增殖,能作为组织工程软骨的候选材料。
[1] Kuo CK, Li WJ, Mauck RL, et al. Cartilage tissue engineering: its potential and uses. Curr Opin Rheumatol, 2006, 18(1):64-73.
[2] Vacanti JP, Morse MA, Saltzman WM, et al. Selective cell transplantation using bioabsorbable artificial polymers as matrices.J Pediatr Surg, 1988, 23(1 Pt 2):3-9.
[3] Yao J, Lu SB, Peng J, et al. Preparation of articular cartilage extracellular matrix derived oriented scaffold for cartilage tissue engineering. J Clin Rehabilitative Tissue Eng Res, 2009, 13(3):432- 436. (in Chinese)
姚军, 卢世壁, 彭江, 等. 关节软骨细胞外基质源性软骨组织工程取向支架的制备. 中国组织工程研究与临床康复, 2009, 13(3):432- 436.
[4] Yang Q, Peng J, Guo Q, et al. A cartilage ECM-derived 3-D porous acellular matrix scaffold for in vivo cartilage tissue engineering with PKH26-labeled chondrogenic bone marrow-derived mesenchymal stem cells. Biomaterials, 2008, 29(15):2378-2387.
[5] Zhang C, Jin Z, Gao JH, et al. The regeneration of rabbit ear cartilage with allogenic chondrial ECM: a preliminary experimental report.J Practical Aesthetic Plast Surg,1997, 8(5):228-231. (in Chinese)
张晨, 金铸, 高景恒, 等. 同种异体兔耳软骨ECM复制兔耳软骨的实验研究──软骨组织工程的实验研究预试验报告. 实用美容整形外科杂志, 1997, 8(5):228-231.
[6] Luan J, Cai Z, Yang PY. Culture of chondrocytes using allogenous acellular cartilaginous matrix. Chin J Plast Surg Burns, 1999, 15(3): 178-179. (in Chinese)
栾杰, 蔡哲, 杨佩瑛. 软骨细胞在异体脱细胞软骨基质上的体外培养实验. 中华整形烧伤外科杂志, 1999, 15(3):178-179.
[7] Pei M, Li JT, Shoukry M, et al. A review of decellularized stem cell matrix: a novel cell expansion system for cartilage tissue engineering. Eur Cell Mater, 2011, 22:333-343.
[8] Zhang JD, Lu SB, Yuan M, et al. Preparation of human articular cartilage acellular matrix. Chin J Clin Rehabil, 2005, 9(14):242-243, 282.
[9] Kang HJ, Lu SB, Zhang L, et al. Human adipose derived stem cell-seeded articular cartilage acellular matrix in the construction of tissue-engineered cartilage in bioreactor. J Clin Rehabilitative Tissue Eng Res, 2007, 11(10):1801-1804, 1811. (in Chinese)
康红军, 卢世璧, 张莉, 等. 人脂肪干细胞复合脱细胞软骨基质支架在生物反应器中构建组织工程软骨. 中国组织工程研究与临床康复, 2007, 11(10):1801-1804, 1811.
[10] Hao H, Chen G, Liu J, et al. Culturing on Wharton's jelly extract delays mesenchymal stem cell senescence through p53 and p16INK4a/pRb pathways. PLoS One, 2013, 8(3):e58314.
[11] Xu L, Ye ZY, Zhou Y, et al. Rabbit articular chondrocyte dedifferentiation during in vitro expansion. Chin J Tissue Eng Res, 2013, 17(20):3626-3634. (in Chinese)
徐磊, 叶朝阳, 周燕, 等. 体外传代培养兔关节软骨细胞的去分化现象. 中国组织工程研究, 2013, 17(20):3626-3634.
[12] Klagsbrun M. Large-scale preparation of chondrocytes. Methods Enzymol, 1979, 58:560-564.
[13] Kirimoto A, Takagi Y, Ohya K, et al. Effects of retinoic acid on the differentiation of chondrogenic progenitor cells, ATDC5. J Med Dent Sci, 2005, 52(3):153-162.
[14] Li B, Wu ZH, Xiao J, et al. Effect of recombination human Ieptin on the proliferation of cultured chondrocyte. Chin Bone Joint Surg, 2008, 1(4-5):312-316. (in Chinese)
李兵, 吴志宏, 肖军, 等. 瘦素对于体外培养人类软骨细胞增殖的影响. 中国骨与关节外科, 2008, 1(4-5):312-316.
[15] Yu L, Li FT, Wang ZY. Effects of extracellular matrix on the proliferation and matrix metabolism of rabbit article chondrocytes in vitro. J Jinan Univ (Med Ed), 2006, 27(6):807-811, 816. (in Chinese)
宇丽, 李发涛, 汪卓赟. 细胞外基质对体外培养兔关节软骨细胞增殖及基质代谢的影响. 暨南大学学报(医学版), 2006, 27(6):807-811, 816.
[16] Minas T, Nehrer S. Current concepts in the treatment of articular cartilage defects. Orthopedics, 1997, 20(6):525-538.
[17] Newman AP. Articular cartilage repair. Am J Sports Med, 1998, 26(2): 309-324.
[18] Yan J, Qi N, Zhang Q. Rabbit articular chondrocytes seeded on collagen-chitosan-GAG scaffold for cartilage tissue engineering in vivo. Artif Cells Blood Substit Immobil Biotechnol, 2007, 35(4):333- 344.
[19] Oliveira JM, Rodrigues MT, Silva SS, et al. Novel hydroxyapatite/ chitosan bilayered scaffold for osteochondral tissue-engineering applications: Scaffold design and its performance when seeded with goat bone marrow stromal cells. Biomaterials, 2006, 27(36):6123- 6137.
[20] Li X, Jin L, Balian G, et al. Demineralized bone matrix gelatin as scaffold for osteochondral tissue engineering. Biomaterials, 2006, 27(11):2426-2433.
[21] Kandel RA, Grynpas M, Pilliar R, et al. Repair of osteochondral defects with biphasic cartilage-calcium polyphosphate constructs in a sheep model. Biomaterials, 2006, 27(22):4120-4131.
[22] Swieszkowski W, Tuan BH, Kurzydlowski KJ, et al. Repair and regeneration of osteochondral defects in the articular joints. Biomol Eng, 2007, 24(5):489-495.
[23] Chang CH, Kuo TF, Lin CC, et al. Tissue engineering-based cartilage repair with allogenous chondrocytes and gelatin-chondroitin- hyaluronan tri-copolymer scaffold: a porcine model assessed at 18, 24, and 36 weeks. Biomaterials, 2006, 27(9):1876-1888.
[24] Kelley TF, Sutton FM, Wallace VP, et al. Chondrocyte repopulation of allograft cartilage: a preliminary investigation and strategy for developing cartilage matrices for reconstruction. Otolaryngol Head Neck Surg, 2002, 127(4):265-270.
[25] Forbes K, Westwood M. Maternal growth factor regulation of human placental development and fetal growth. J Endocrinol, 2010, 207(1):1- 16.
[26] Kuhn NZ, Tuan RS. Regulation of stemness and stem cell niche of mesenchymal stem cells: implications in tumorigenesis and metastasis. J Cell Physiol, 2010, 222(2):268-277.
[27] Gilbert TW, Sellaro TL, Badylak SF. Decellularization of tissues and organs. Biomaterials, 2006, 27(19):3675-3683.
[28] Lin P, Chan WC, Badylak SF, et al. Assessing porcine liver-derived biomatrix for hepatic tissue engineering. Tissue Eng, 2004, 10(7-8): 1046-1053.
[29] Bolland F, Korossis S, Wilshaw SP, et al. Development and characterisation of a full-thickness acellular porcine bladder matrix for tissue engineering. Biomaterials, 2007, 28(6):1061-1070.
[30] Woods T, Gratzer PF. Effectiveness of three extraction techniques in the development of a decellularized bone-anterior cruciate ligament-bone graft. Biomaterials, 2005, 26(35):7339-7349.
[31] Cartmell JS, Dunn MG. Effect of chemical treatments on tendon cellularity and mechanical properties. J Biomed Mater Res, 2000, 49(1):134-140.
[32] Grauss RW, Hazekamp MG, Oppenhuizen F, et al. Histological evaluation of decellularised porcine aortic valves: matrix changes due to different decellularisation methods. Eur J Cardiothorac Surg, 2005, 27(4):566-571.
[33] Zhang C, Jing SB, Yang K, et al. Cartilage tissue engineering with acellular cartilage matrix as scaffold in rabbit model. Chin J Reparative Reconstr Surg, 2008, 22(7):846-850. (in Chinese)
张晨, 景士兵, 杨琨, 等. 软骨脱细胞基质支架材料的软骨组织工程实验研究. 中国修复重建外科杂志, 2008, 22(7):846-850.
The effect of human articular cartilage acellular matrix on rabbit chondrocytes
GAO Yue, LIU Shu-yun, HUANG Jing-xiang, GUO Wei-min, CHEN Ji-feng, ZHANG Li, ZHAO Bin, PENG Jiang, WANG Ai-yuan, WANG Yu, XU Wen-jing, LU Shi-bi, GUO Quan-yi
To observe the proliferation of rabbit chondrocytes on human articular cartilage acellular matrix (hACAM) duringexpansion.
hACAM was prepared with the differential centrifugation as 0.5 % slurry, and then coated the 6-well and 96-well plate to form 1 mm thick film as the experimental group. There was no any process for the control group. Chondrocytes were isolated from articular cartilage of New Zealand white rabbits and cultured on hACAM-coated plates hochest33258 staining was used to verify no cell in the hACAM. The cell proliferation and morphology were analyzed with an inverted microscope, toluidine blue staining, and Cell Counting Kit-8 (CCK-8) assay.
The cells of hACAM groups grew faster than that of the control groups under the inverted microscope in d5, d15, which was also proved by the results of toluidine blue staining. The cells of hACAM groups proliferated significantly faster than that of the control groups (= 0.0298 < 0.05) in d7. The experiment groups and the control groups were not statistically significant difference in proliferation (= 0.1322 > 0.05) by CCK-8 cell proliferation assay in d10.
hACAM promotes the proliferation of chondrocytes at low immunogenicity and no cytotoxic effects, and then it is used as an ideal biological material.
Extracellular matrix; Cartilage; Chondrocytes; Tissue engineering; Cell proliferation
GUO Quan-yi, Email: doctorguo@163.com
10.3969/cmba.j.issn.1673-713X.2014.02.001
国家自然科学基金(81071458、81000810);国家高技术发展研究计划(863计划)(2012AA020502)
郭全义,Email:doctorguo@163.com
2014-02-10
Author Affiliation: Institute of Orthopedics, Chinese PLA General Hospital, Beijing 100853, China

