人载脂蛋白A-I表达上调剂的发现与活性研究
杜郁,贾晓健,王丽,王丽非,姜华军,杨帆,司书毅,杨媛,洪斌
人载脂蛋白A-I表达上调剂的发现与活性研究
杜郁,贾晓健,王丽,王丽非,姜华军,杨帆,司书毅,杨媛,洪斌
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所卫生部抗生素生物工程重点实验室(杜郁、贾晓健、王丽、王丽非、姜华军、杨帆、杨媛、洪斌),国家新药(微生物)筛选实验室(司书毅)
筛选上调人载脂蛋白 A-I(ApoA-I)基因表达的新型活性化合物,并在表达和功能水平对其作用进行研究。
利用人 ApoA-I 基因表达上调剂筛选模型对化合物库进行筛选;对发现的活性化合物在 ApoA-I 启动子水平进行量效关系研究;利用实时荧光定量 RT-PCR 检测 ApoA-I mRNA 的表达水平;利用 Western blot、ELISA 和流式细胞技术检测 ApoA-I 的蛋白表达;利用胆固醇流出试验检测 ApoA-I 介导的巨噬细胞胆固醇外流的情况。
从 20000 样次化合物筛选中得到活性化合物 5238B-69,在一定浓度范围内存在转录调控活性的量-效关系,当化合物浓度为 0.30 μg/ml 时,上调 ApoA-I 表达活性达到最高值(408%),EC50为 0.01 μg/ml。5238B-69 能显著上调 HepG2 细胞中 ApoA-I mRNA 的水平;同时,Western blot 结果显示 5238B-69 能增加 HepG2 细胞 ApoA-I 蛋白的表达。ELISA 结果显示,与对照相比,5238B-69 作用 48 h 时,胞外 ApoA-I 水平增加了 48%,流式细胞检测表明,5238B-69 作用 24 h 后,胞内 ApoA-I 蛋白水平增加了 21.4%。功能分析试验显示,5238B-69 作用 HepG2 细胞上调生成的 ApoA-I,能促进巨噬细胞RAW 264.7 内 [3H] 标记的胆固醇的流出。
得到一个具有上调 ApoA-I 表达的活性化合物,在提高 ApoA-I 表达水平和生物学功能方面均有明显的效果。
载脂蛋白 A-I; 基因表达调控; 动脉粥样硬化; 转录水平
血浆高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)水平偏低是心血管病的独立危险因素,在过去的三十年中,国内外的研究人员一直寻求通过升高血浆中高密度脂蛋白胆固醇的水平来降低动脉粥样硬化性心血管病的发生。随着对 HDL 生物学特性认识的不断深入,人们发现 HDL 是包括了一系列大小、形态、密度及结构极不均一的脂蛋白颗粒,根据结构组成上的异质性,HDL 可分为多种亚型并表现有代谢和功能上的差异[1]。2006 年和 2012 年,两个旨在升高血浆 HDL-C 水平的胆固醇酯转运蛋白(cholesteryl ester transfer protein,CETP)抑制剂 torcetrapib 和 dalcetrapib(JTT-705)临床试验分别遭遇失败[2-3],引发了研究人员对 HDL 复杂性与心血管病收益的一系列争论,研究关注的焦点逐渐从升高 HDL-C的水平转向提升 HDL-C 的功能。
载脂蛋白 A-I(apolipoprotein A-I,ApoA-I)约占 HDL 蛋白组成的 70%,因而血浆ApoA-I 的浓度与 HDL-C 水平密切相关。同时,ApoA-I 作为 ATP 结合盒式转运子(ATP-binding cassette-A1,ABCA1)的配体,能够介导巨噬细胞中游离胆固醇的外流,从而起始 HDL 的生物合成,同时启动胆固醇逆转运过程,在肝外组织清除过多胆固醇的过程中发挥了重要作用。动物体内的研究表明,过表达人 ApoA-I 基因能显著抑制小鼠体内动脉粥样硬化早期损伤——脂纹的形成[4],更重要的是,在动脉粥样硬化易感小鼠中,过表达 ApoA-I 通过增强巨噬细胞 RCT 增加了粪便中胆固醇的排出,这有可能是其消退动脉粥样斑块的潜在机制[5-6]。所以,ApoA-I 不仅是 HDL 的主要结构蛋白,还是 HDL 发挥心血管保护功能的重要组成单位。因此,以 ApoA-I 为靶点的药物被认为是基于 HDL 的抗动脉粥样硬化药物中极具应用前景的治疗策略[7]。为寻找能够提高 ApoA-I 表达水平的活性化合物,作者在前期工作中构建了 ApoA-I 基因表达上调剂筛选模型[8]。本研究在此模型的基础上,对国家新药(微生物)筛选实验室化合物库进行了20 000 样次筛选,得到了结构新颖的活性化合物 5238B-69,对其生物活性进行了研究。
1 材料与方法
1.1 材料
1.1.1 细胞株 人肝癌细胞株 HepG2 和小鼠的单核-巨噬细胞 RAW 264.7 均为本室保存;ApoP- Luc HepG2 细胞由本实验室构建[8]。
1.1.2 主要试剂 Luciferase assay system 细胞裂解液和荧光素酶检测系统、SV 总 RNA 提取试剂盒、TMB 单相发光底物购自美国 Promega公司;Turbo script 1st-strand cDNA synthesis 反转录试剂盒购自原平皓生物技术有限公司;荧光实时定量 PCR 试剂盒(Faststart universal SYBR green PCR master,ROX)购自瑞士 Roche 公司;兔抗人 ApoA-I 多克隆抗体(178422)购自美国 Calbiochem 公司;增强型 HRP 化学发光液购自美国 Millipore 公司;MEM 细胞培养基为美国 Thermo 公司产品;胎牛血清、丙酮酸钠、非必需氨基酸和G418 抗生素为美国 Gibco 公司产品;二甲基亚砜(DMSO)购自美国 Sigma 公司;牛血清白蛋白购自美国 Sigma Aldrich 公司。筛选所用的化合物来自国家新药(微生物)筛选实验室,纯度 > 95%,可商业购买。
1.1.3 仪器 EnVision 多功能微孔板检测仪和 MicroBeta2液体闪烁计数仪为美国 Perkin Elmer 公司产品;iQ5 Multicolor real time PCR 仪为美国 Bio-Rad 公司产品;TE-70PWR 半干式转膜仪和 ImageQuant 300 凝胶成像仪为美国 GE Healthcare 公司产品;EPICS XL 流式细胞仪为美国 Coulter 公司产品。
1.2 方法
1.2.1 细胞培养 人肝癌细胞株 HepG2 培养于含 10% 胎牛血清的 MEM 培养基中;ApoP-Luc HepG2 细胞培养于含 700 μg/ml G418 和 10% 胎牛血清的 MEM 培养基中;小鼠的单核-巨噬细胞 RAW 264.7 用含 10% 胎牛血清的 DMEM 高糖培养液培养。所有细胞都在 5% CO2培养箱中37 ℃贴壁培养。
1.2.2 化合物高通量筛选 在前期工作中,构建了含有人 ApoA-I 基因启动子序列的荧光素酶报告基因重组质粒,并获得了稳定转染细胞株——ApoP-Luc HepG2 细胞[8],本研究利用该细胞考察化合物上调 ApoA-I 基因表达的作用。将对数生长期的细胞用含 G418 700 μg/ml 的 MEM 选择培养液调节至 5 × 105个/ml,接种于 96 孔细胞培养板,每孔 100 μl。37 ℃、5% CO2培养6 h 后,吸弃含血清的培养液上清,更换无血清 MEM 培养液,并加入待筛化合物样品(初筛样品浓度为 2 μg/ml)及 DMSO(终浓度 0.1%)对照。20 h 后移去细胞培养液上清,PBS 漂洗细胞 2 次,每孔加入 20 μl 细胞裂解液,37 ℃孵育 15 min 以充分裂解,加入 Luciferase assay system 中提供的荧光素酶检测液后,通过微孔板多功能检测仪读取荧光素酶活性数值。以荧光素酶的表达活性来考察化合物对 ApoA-I 基因表达的上调作用。荧光素酶活性的评价采用调节率来定义:
调节率=(样品组细胞荧光素酶活性/DMSO 组细胞荧光素酶活性)× 100%
本研究将化合物样品的调节率大于 150% 视为初筛阳性。
1.2.3 筛选模型量效关系研究 将化合物溶于 DMSO,制成浓度为 10 mg/ml 的母液。在 96 孔板中接种 ApoP-Luc HepG2 细胞,将化合物浓度从0.625 μg/ml 开始行对倍稀释,共制备 12 个浓度梯度,并使 DMSO 终浓度保持为 0.1%(W/V)。按照 1.2.2 所述方法检测细胞的荧光素酶活性。利用 SigmaPlot9.0 制图软件计算 EC50。
1.2.4 实时荧光定量 RT-PCR 检测 ApoA-I mRNA 的表达 取人肝癌细胞 HepG2,以细胞数 8 × 105/孔接种于 6 孔细胞培养板,37 ℃、5% CO2培养 24 h,用 PBS 漂洗细胞后,加入含指定浓度化合物的无血清培养液,对照孔加入 0.1% 的 DMSO。37 ℃、5% CO2培养 24 h。450 ×离心5 min,收集细胞,用 SV 总 RNA 提取试剂盒提取细胞总 RNA。ApoA-I 扩增片段长度为 114 bp,正向引物为 5' TGTGTACGTGGATGTGCTCAAAG 3',反向引物为 5' GTCACGCTGTCCCAGTTGTCA 3';内参基因为GAPDH,正向引物 5' AGCCACAT CGCTCAGACAC 3';反向引物 5' GCCCAATACGA CCAAATCC 3'。PCR 条件为 95 ℃预变性 10 min,95 ℃变性 15 s,60 ℃退火 30 s,30 个循环。
1.2.5 Western blot 检测 ApoA-I 蛋白表达 HepG2 细胞接种于 6 孔细胞培养板,加入化合物,作用 24 h后,消化收集细胞,以 RIPA 裂解液处理细胞,抽提细胞总蛋白。细胞蛋白样品经 10% SDS-PAGE 分离,上样量为 50 μg,采用半干电转移系统将蛋白转移至 PVDF 膜上,5% 脱脂奶粉封闭 1 h,加入 ApoA-I 一抗(1:1000)4 ℃孵育过夜,TBST 洗膜 3 次,加入 HRP 标记的二抗(1:3000),室温孵育 1 h,增强化学发光法(ECL)显色。以 β-actin 作为内参,用两者灰度扫描结果的比值进行 ApoA-I 表达变化的统计分析。
1.2.6 ELISA 检测胞外 ApoA-I 蛋白水平 取细胞培养液上清,酶标板每孔加 100 μl 包被过夜。用 3% BSA 封闭,将 ApoA-I 抗体按 1:1000稀释,每孔 100 μl,37 ℃放置 1 h,加入辣根过氧化物酶标记的二抗(1:5000),37 ℃孵育 1 h,加入 TMB 显色底物,室温静置 30 min,加入1 mol/L HCl 终止反应,每步骤之间用 PBST 洗涤 4 次,以酶标仪检测450。
1.2.7 流式细胞技术检测胞内 ApoA-I 蛋白表达 消化收集细胞,经 4%(W/V)多聚甲醛室温固定 40 min,PBS 漂洗,以 0.1% Triton 对细胞进行穿孔处理,含 5% FBS 的 PBS 封闭 15 min,PBS 漂洗后用 ApoA-I 一抗(1:50)4 ℃处理50 min,PBS 漂洗细胞 3 次,FITC 标记二抗(1:100)处理 50 min,利用流式细胞仪检测胞内 ApoA-I 蛋白水平的变化,每组样品平均检测细胞数为 10 000 个,各组细胞的相对荧光强度以对数积分图表示。
1.2.8 胆固醇流出试验 取 RAW 264.7 细胞,按 2 × 104个/孔接种于 24 孔板,于 37 ℃、5% CO2培养 6 h 后,用 0.5 ml 含 1 μCi/ml [3H] 标记胆固醇的 DMEM 培养液(5% FBS、0.2% 牛血清白蛋白)孵育 24 h。弃去含同位素的上清培养基,PBS 漂洗细胞,加入含浓度为 0.3 mmol/L 的 cAMP 的 DMEM 无血清培养液以上调 ABCA1 表达,培养 24 h。PBS 洗涤细胞,加入化合物作用 HepG2 细胞后的培养液上清,孵育 6 h。收集 RAW 264.7 细胞培养液上清,高速离心 3 min,取上清液检测;细胞部分用 500 μl 0.1 mol/L NaOH 裂解,收集裂解液。用闪烁计数法检测培养液和细胞的[3H] 标记胆固醇。胆固醇流出程度用如下公式表示:
胆固醇流出程度(%)= 培养液中 cpm 值/(培养液中cpm 值+ 培养细胞中cpm 值)× 100 %(cpm:每分钟记数)。
1.3 统计学处理
2 结果
2.1 化合物筛选结果
用 ApoP-Luc HepG2 细胞对本所国家新药(微生物)筛选实验室化合物库进行筛选,若相对荧光素酶活性增加 50% 以上,则认为是初筛阳性化合物,进一步进行量效关系复筛。通过对化合物库进行 20 000 样次筛选及复筛,获得活性化合物5238B-69(图 1A)。5238B-69 的化学名称是 2-(1,3- 苯并噻唑-2-巯基)-N-喹啉基-5-乙酰胺,化学式为 C18H13N3OS2,分子量是 351.45。MTT 结果显示在实验所采用的浓度范围内,化合物 5238B-69 对 HepG2 细胞没有明显的细胞毒活性。
2.2 5238B-69 在 ApoA-I 表达上调剂筛选模型中的量效关系曲线
检测不同浓度的化合物作用于ApoP-Luc HepG2 细胞后荧光素酶表达活性的变化,得到化合物在 ApoA-I 表达上调剂筛选模型上的量效关系曲线(图 1B)。结果表明,5238B-69 以剂量依赖的方式增强 ApoP-Luc HepG2 细胞荧光素酶表达活性。5238B-69 在质量浓度为 0.30 μg/ml 时,其上调ApoA-I 表达活性达到最高值408%,EC50为 0.01 μg/ml。
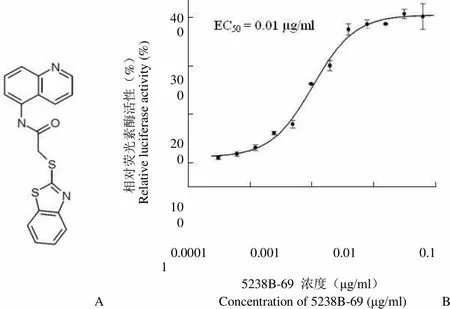
相对荧光素酶活性(%)Relative luciferase activity (%) 400 300 200 100 0.0001 0.001 0.01 0.1 1 A 5238B-69 浓度(μg/ml)Concentration of 5238B-69 (μg/ml)B
Figure 1 Chemical structure of 5238B-69 (A) and dose-response curve in log scale (B)

mRNA 表达相对含量Relative mRNA expression(ApoA-I/GAPDH)1.5 1.0 0.5 0 mRNA 表达相对含量Relative mRNA expression(ApoA-I/GAPDH)1.5 1.0 0.5 0 对照 0.01 0.05 0.1 0.5 1Control 12 24 36 48 5238B-69 浓度(μg/ml)Concentration of 5238B-69 (μg/ml)A 时间(h)Time (h)B
Figure 2 Effect of 5238B-69 on ApoA-I mRNA expression in HepG2 cells in a concentration-dependent (A) and time-dependent manner (B) (*< 0.05,**< 0.01)
2.3 5238B-69 对 HepG2 细胞中 ApoA-I mRNA 水平的影响
HepG2 细胞经化合物 5238B-69 处理 24 h 后,提取细胞总 RNA,反转录成 cDNA 后,采用RT-PCR 反应检测 ApoA-I 的 mRNA 表达。以管家基因 GAPDH(不同样品间表达量基本恒定)作为内参,得到样品待测基因相对于内参基因的含量,再同对照组相比考察 mRNA 的含量变化。结果显示,5238B-69 能增加 HepG2 细胞中 ApoA-I mRNA 的表达,当化合物在浓度为 0.01 ~ 0.1 μg/ml 的范围内时,mRNA 表达上调与对照组相比有显著的差异,在 0.05 μg/ml 时,mRNA 水平上调最高,可以达到(1.33 ± 0.05)倍(图 2A)。进而考察了0.1 μg/ml 的 5238B-69 在不同时间对 ApoA-I mRNA 表达的影响(图 2B),作用 24 h 后,ApoA-I mRNA 水平上调最高。
2.4 5238B-69 对 HepG2 细胞 ApoA-I 蛋白水平的影响
分别以不同浓度的化合物 5238B-69 作用 HepG2 细胞,48 h 后提取培养基上清中和细胞总蛋白,SDS-PAGE 分离后,采用 Western blot 法检测 ApoA-I 蛋白含量。结果显示,在 0.001~0.05 μg/ml 的浓度范围内,5238B-69 能明显增加 HepG2 细胞分泌到上清中的 ApoA-I 蛋白水平,同时对胞内 ApoA-I 的蛋白水平也存在一定程度的上调(图 3)。

上清 Supernatant胞内 Cell lysatesβ-actin 对照 0.05 0.01 0.005 0.001Control 5238B-69 浓度(μg/ml)Concentration of 5238B-69 (μg/ml)
Figure 3 Western blot analysis for the effect of 5238B-69 at different concentrations on ApoA-I protein expression in HepG2 cells
2.5 ELISA 检测 5238B-69 对分泌到 HepG 细胞上清中 ApoA-I 蛋白水平的影响
为进一步明确化合物对上清中 ApoA-I 水平的影响,采用 ELISA 的技术手段分析了0 ~ 72 h 上清中 ApoA-I 蛋白的变化。结果显示,在 48 h,0.1 μg/ml的 5238B-69 处理组的 ApoA-I 分泌至胞外的蛋白水平是对照组的 1.48 倍(< 0.05)(图 4)。

上清中 ApoA-I 蛋白相对含量Relative ApoA-I in media2.0 1.5 1.0 0.5 0 0 24 48 72 时间(h)Time (h)
Figure 4 ELISA anlysis of the effect of 5238B-69 on ApoA-I protein level in media for the indicated time (*< 0.05)
2.6 流式细胞技术检测 5238B-69 对 HepG2 胞内 ApoA-I 蛋白表达的作用
由于流式细胞技术能较敏感地从单个细胞水平定量或半定量检测细胞蛋白,利用该技术分析了化合物对胞内 ApoA-I 表达的影响。结果表明,0.5 μg/ml 的 5238B-69 处理 HepG2 细胞 24 h 后,化合物处理组 ApoA-I 的蛋白含量比对照组增加了 21.4%(图 5),进一步证实了化合物 5238B-69的作用。
2.7 5238B-69 对 RAW 264.7 细胞中[3H] 标记胆固醇流出的影响
0.05 μg/ml 的化合物 5238B-69 作用 HepG2 细胞 24 h 后,吸取培养基上清,与事先荷载有 [3H]-胆固醇的 RAW 264.7 细胞共同孵育。6 h 后,分别收集 RAW 264.7 细胞的培养基上清及细胞裂解液,利用液体闪烁仪检测其中的 [3H] 标记胆固醇,分析 [3H] 标记胆固醇流出的情况。功能水平的初步研究结果显示,对照组、化合物组和 HDL(50 μg/ml)组的胆固醇流出分别是(15.7 ± 3.9)%、(22.5 ± 6.2)% 和(19.9 ± 2.5)%。5238B-69 作用 HepG2 细胞后分泌产生的 ApoA-I,促进巨噬细胞内胆固醇的流出明显高于对照组(= 0.036),从而在生物学功能水平证明该化合物所上调表达的 ApoA-I 是具有接受胆固醇功能的(图 6)。
3 讨论
动脉粥样硬化性心血管疾病是全球范围造成人口死亡的主要病因,尽管他汀类药物能减少 40% 左右的心血管病的发生,但此类疾病的复发和继续发展的可能性依然很高,心血管病的剩留风险依然存在。为此,研究人员一直在积极寻找动脉粥样硬化疾病的新型治疗策略,在降低低密度脂蛋白胆固醇的同时,从逆转动脉粥样硬化进程的新靶点入手,开发具有新作用机制的药物。
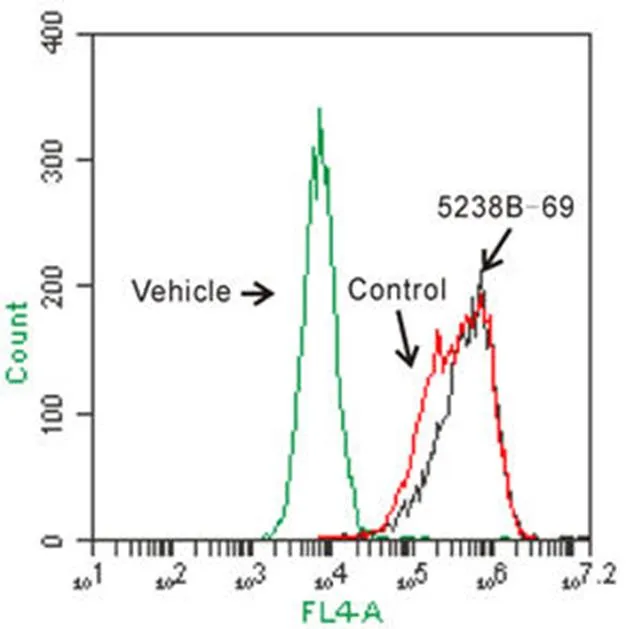
ApoA-I 相对蛋白水平Relative ApoA-I protein levels1.5 1.0 0.5 0 对照 5238B-69Control
Figure 5 Flow cytometry analysis for the effect of 5238B-69 on ApoA-I protein levels in HepG2 cells (*< 0.05)

[3H]标记胆固醇外排(%)[3H]-cholesterol efflux (%)35 30 25 20 15 10 5 0 对照 5238B-69 HDLControl
Figure 6 5238B-69 promoted cholesterol efflux from RAW 264.7 cells (*< 0.05)
HDL 和 ApoA-I 因有促进巨噬细胞胆固醇流出、启动胆固醇逆转运、抗炎、抗氧化、抗血栓、保护内皮细胞等多种功能,可能是其多效性发挥抗动脉粥样硬化的潜在机制。van der Steeg 等[9]在HDL-C、HDL 颗粒、ApoA-I 与心血管病风险的关系研究中发现,尽管极高浓度的 HDL-C 和大颗粒的 HDL 可能存在增加心血管事件发生的风险,但 ApoA-I 始终表现出动脉保护作用,提示 ApoA-I 在抗动脉粥样硬化过程中的关键作用。目前有多项以 ApoA-I 为靶点的药物正处于临床研究阶段。CSL-112 是由血浆中纯化的 ApoA-I 重组成适合于输注的 HDL,能够显著增强人体内胆固醇流出,同时升高pre-β-HDL 的水平,有望减轻动脉粥样硬化在急性冠状动脉综合征发病初期所造成的负担,目前正在进行临床 II 期研究[10-11]。CER-001 是首个模拟 pre-β-HDL 结构及功能的类似物,也是一个基于 ApoA-I 的模拟肽,临床前研究证实,CER-001 能促进胆固醇动员,增强胆固醇逆转运,2011 年开始进行临床 II 期研究[12]。D-4F/L-4F 是根据 ApoA-I 脂质结合区双亲性螺旋的二级结构,设计合成的含有 18 个氨基酸的短肽。动物水平的研究发现,它可促进 ABCA1 及 B 族 I 型清道夫受体(scavenger receptor class B member 1,SR-BI)介导的胆固醇流出,但 D-4F 在人体中生物利用度较低[13]。
和上述以 ApoA-I 为靶点的药物相比,本研究发现的新型化合物 5238B-69 具有潜在的优势。首先,它是一个小分子化合物,结构新颖,成药性好。而上述 CSL-112、CER-001 等药物属于多肽蛋白类,这一属性在很大程度上限制了其在临床上的应用。其次,上文提到的药物大都是通过外源性直接增加 HDL 的数量进而发挥作用,本文的研究结果显示,5238B-69 是内源性上调 ApoA-I 表达的化合物,胆固醇流出试验表明这种基于蛋白表达水平的上调所产生的是具有生理功能的 ApoA-I 及 HDL,可通过增强 ApoA-I/HDL 介导的胆固醇外排来减少细胞中脂质的累积。RVX-208 是第一个能增加 ApoA-I 内源性表达的小分子化合物,临床试验证实,RVX-208 显著增加 ApoA-I 和大颗粒 HDL 的水平,可能在增强胆固醇逆转运的过程中发挥重要作用。刚刚结束的 Assure 研究进一步发现,联用瑞舒伐他汀和 RVX-208 的患者表现出显著的斑块消退,其动脉粥样斑块体积百分比(percent atheroma volume,PAV)变化为 –1.43%,是试验预先设定的 PAV 终点(–0.6%)的两倍多[14-15]。随着结果的陆续公布,必将继续深入地揭示这类药物在抗动脉粥样硬化治疗中的重要作用。
为了验证化合物 5238B-69 对 HepG2 细胞中ApoA-I 蛋白表达的影响,本研究选用了三种方法检测 ApoA-I 的蛋白水平。由于细胞合成 ApoA-I 蛋白后会不断向胞外分泌,所以利用 Western blot 的方法分别检测了胞内和培养基上清中的 ApoA-I。为了进一步明确胞外 ApoA-I 蛋白的变化情况,利用 ELISA 方法进行检测,结果显示在化合物作用 48 h 后,胞外蛋白的水平与对照有显著性差异。进一步用流式细胞技术检测胞内的蛋白表达,发现在 24 h 时,化合物处理组的 ApoA-I 水平较对照组显著地上调。这些结果提示化合物 5238B-69 在 24 h 时即可显著上调 ApoA-I 的表达水平,随着时间的推移,48 h 时分泌到胞外的 ApoA-I 蛋白显著增加。
本研究首先通过启动子报告基因实验,初步证明了化合物对 ApoA-I 转录的激活作用,继而在 mRNA 和蛋白水平验证了化合物增强 ApoA-I 基因转录的作用。我们还利用构建的另一个包含有更长 5'调控序列(–456 ~ 173 bp)的报告基因质粒,检测了 5238B-69 对其表达活性的影响(结果未给出)。研究发现,5238B-69 对这两段调控序列表现出接近的调控活性和 EC50,提示该化合物可能的作用范围应该在–277 ~ 173 bp 之内,这段序列含有重要的转录因子结合位点 Site A(–214 ~ –192 bp)、Site B(–169 ~ –146 bp)和 Site C(–134 ~ –119 bp),负责与核受体,例如过氧化物酶体增殖物激活型受体(PPAR)、视黄醇类物质 X 受体(RXR)、肝细胞核因子 3 或 4(HNF-3/4)和肝 X 受体(LXR)等相识别,参与对 ApoA-I 基因转录的调控。接下来的工作将进一步确定发挥作用的顺式元件及转录因子,以期完善化合物 5238B-69 的分子作用机制。
本研究以前期的工作为基础,利用已建立的 ApoA-I 基因表达上调剂筛选模型,发现化合物 5238B-69 具有诱导 ApoA-I 基因转录激活的作用;通过 mRNA 和蛋白水平的研究,证实了 5238B-69 对 HepG2 细胞内 ApoA-I 的表达上调;以此为基础,在功能水平进一步证明该化合物能够显著促进巨噬细胞中胆固醇的流出。以上结果证明,5238B-69 可以上调 HepG2 细胞中 ApoA-I 的内源性表达,并且能在生物学功能上得到验证。外周细胞内胆固醇积聚是动脉粥样硬化的重要环节,促进胆固醇的清除代谢是预防和治疗动脉粥样硬化的关键步骤,功能试验的结果提示化合物 5238B-69 可能通过作用于胆固醇逆转运的起始环节,增强外周组织中胆固醇的动员,进而起到抗动脉粥样硬化的作用。本研究为化合物 5238B-69 抗动脉粥样硬化机制的深入研究提供了重要的依据,为开发寻找具有自主知识产权的抗动脉粥样硬化新机制药物奠定了基础。
[1] Ng DS, Wong NC, Hegele RA. HDL--is it too big to fail? Nat Rev Endocrinol, 2013, 9(5):308-312.
[2] Tall AR, Yvan-Charvet L, Wang N. The failure of torcetrapib: was it the molecule or the mechanism? Arterioscler Thromb Vasc Biol, 2007, 27(2):257-260.
[3] Schwartz GG, Olsson AG, Abt M, et al. Effects of dalcetrapib in patients with a recent acute coronary syndrome. N Engl J Med, 2012, 367(22):2089-2099.
[4] Rubin EM, Krauss RM, Spangler EA, et al. Inhibition of early atherosclerosis in transgenic mice by human apolipoprotein AI. Nature, 1991, 353(6341):265-267.
[5] Plump AS, Scott CJ, Breslow JL. Human apolipoprotein A-I gene expression increases high density lipoprotein and suppresses atherosclerosis in the apolipoprotein E-deficient mouse. Proc Natl Acad Sci U S A, 1994, 91(20):9607-9611.
[6] Tangirala RK, Tsukamoto K, Chun SH, et al. Regression of atherosclerosis induced by liver-directed gene transfer of apolipoprotein A-I in mice. Circulation, 1999, 100(17):1816-1822.
[7] Shah PK. Atherosclerosis: targeting endogenous apo A-I--a new approach for raising HDL. Nat Rev Cardiol, 2011, 8(4):187-188.
[8] Du Y, Wang L, Wang LF, et al. Establishment of a high-throughput screening model for identifying upregulator of human Apo A-I expression. Chin Med Biotechnol, 2011, 6(3):178-183. (in Chinese)
杜郁, 王丽, 王丽非, 等. 以Apo A-I为靶点的基因表达上调剂筛选模型的建立. 中国医药生物技术, 2011, 6(3):178-183.
[9] van der Steeg WA, Holme I, Boekholdt SM, et al. High-density lipoprotein cholesterol, high-density lipoprotein particle size, and apolipoprotein A-I: significance for cardiovascular risk: the IDEAL and EPIC-Norfolk studies. J Am Coll Cardiol, 2008, 51(6):634-642.
[10] Tardif JC, Grégoire J, L'Allier PL, et al. Effects of reconstituted high-density lipoprotein infusions on coronary atherosclerosis: a randomized controlled trial. JAMA, 2007, 297(15):1675-1682.
[11] Kones R. Reducing residual risk: modern pharmacochemistry meets old-fashioned lifestyle and adherence improvement. Ther Adv Cardiovasc Dis, 2013, 7(3):169-182.
[12] Keyserling CH, Hunt TL, Klepp HM, et al. CER-001, a synthetic HDL-mimetic, safely mobilizes cholesterol in healthy dyslipidemic volunteers. Circulation, 2011, 124:A15525.
[13] Bloedon LT, Dunbar R, Duffy D, et al. Safety, pharmacokinetics, and pharmacodynamics of oral apoA-I mimetic peptide D-4F in high-risk cardiovascular patients. J Lipid Res, 2008, 49(6):1344-1352.
[14] Bailey D, Jahagirdar R, Gordon A, et al. RVX-208: a small molecule that increases apolipoprotein A-I and high-density lipoprotein cholesterol in vitro and in vivo. J Am Coll Cardiol, 2010, 55(23): 2580-2589.
[15] Nicholls SJ, Gordon A, Johannson J, et al. ApoA-I induction as a potential cardioprotective strategy: rationale for the SUSTAIN and ASSURE studies. Cardiovasc Drugs Ther, 2012, 26(2):181-187.
Identification and characterization of novel upregulator of human Apolipoprotein A-I
DU Yu, JIA Xiao-jian, WANG Li, WANG Li-fei, JIANG Hua-jun, YANG Fan, SI Shu-yi, YANG Yuan, HONG Bin
To find potential small molecules that increase endogenous synthesis of apolipoprotein A-I (ApoA-I), and to identify its ability of increasing ApoA-I at expression and functional levels.
Compounds screening was performed with established screening model based on the ApoP-Luc HepG2 cell line. Dose-response relationship of the active compound was achieved in promoter activity. The expression of ApoA-I in HepG2 cells regulated by the compound was detected by real-time quantitative reverse transcription-polymerase chain reaction (RT-PCR), Western blot, ELISA and flow cytometry analysis. The cholesterol efflux assay was applied to investigate the effect of promoted ApoA-I on mediating lipid transfer in RAW 264.7 cells.
In the present study, compound 5238B-69 was found using the screening model. 5238B-69 increased ApoA-I promoter activity in a dose-dependent manner with EC50of 0.01 µg/ml, and maximal activity of 408% at 0.30 μg/ml. 5238B-69 significantly increased ApoA-I mRNA level and protein level in HepG2 cells. ELISA and flow cytometry analysis showed 5238B-69 could increase ApoA-I protein by 48% and 21.4% compared with control in the media and cells, respectively. The functional efflux assay further illustrated the role of ApoA-I induced by 5238B-69 with RAW 264.7 cells.
A potential small molecular upregulator was obtained, which could significantly increase the expression of human ApoA-I in liver cells and promote cholesterol efflux from mice macrophages.
Apolipoprotein A-I; Gene expression regulation; Atherosclerosis; Transcriptional regulation
HONG Bin, Email: binhong69@hotmail.com; YANG Yuan, Email: yangyuan78@hotmail.com
10.3969/cmba.j.issn.1673-713X.2014.02.003
国家自然科学基金(30801401);“重大新药创制”国家科技重大专项(2012ZX09301002-003、2012ZX09301002-001)
洪斌,Email:binhong69@hotmail.com;杨媛,Email:yangyuan78@hotmail.com
2013-11-12
Author Affiliations: Key Laboratory of Biotechnology of Antibiotics of Ministry of Health (DU Yu, JIA Xiao-jian, WANG Li,WANG Li-fei, JIANG Hua-jun, YANG Fan, YANG Yuan, HONG Bin), National Laboratory for Screening New Microbial Drugs (SI Shu-yi), Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China

