结核特异性CD4+ α/β TCR四聚体细胞株筛选技术的建立和应用
姚亚男,黄宇虹,王娟,陈伊,任亮亮,赖小敏
结核特异性CD4+α/β TCR四聚体细胞株筛选技术的建立和应用
姚亚男,黄宇虹,王娟,陈伊,任亮亮,赖小敏
510080 广州,中山大学中山医学院微生物学教研室/热带病防治研究教育部重点实验室/海洋微生物功能分子广东省高校重点实验室/广东省重大传染病预防和控制技术中心
应用不同的 MTB 多肽以及不同的 HLA-DR 基因构建的膜表面表达结核抗原肽/HLA-DR 复合物的 S2 恒定细胞株,即人工 APC 筛选、鉴定结核特异性 CD4+α/β TCR 四聚体。
以 PE 标记的 CD4+α/β TCR 四聚体、FITC 标记的抗 HLA-DR 抗体(L243),分别与未诱导表达或 CuSO4诱导表达后的膜表面表达结核抗原肽/HLA-DR 的果蝇 S2 恒定细胞株,以及与无多肽或结合有结核多肽的、表达 HLA-DR 的 S2 细胞株共孵育,流式细胞技术检测分析 TCR 四聚体与各种细胞株结合率的差异。
TCR 四聚体 6M、6N 均与 2# 细胞株,即 C5/HLA-DRB1*0404(1.73%、5.93%)等具有较高的阳性结合率;结核抗原肽孵育后,一些人工 APC 的四聚体阳性结合率有所提高;所筛选的 9 个 TCR 四聚体均与 2# 细胞株有较高的结合率。
膜表达结核抗原肽/HLA-DR 的 S2 细胞株,可以应用于结核特异性 CD4+α/β TCR 四聚体的筛选、鉴定;构建的 9 个 CD4+α/β TCR 四聚体均为结核特异性。
结核多肽; HLA-DR; 人工抗原递呈细胞; CD4+T 细胞; TCR四聚体
结核病是由结核分枝杆菌(m,MTB)感染引起的以呼吸系统感染为主的慢性传染病,可累及全身多器官系统,最常见的患病部位是肺脏,也可以累及肝、肾、脑、淋巴结等器官。近年来,随着耐药结核、HIV-TB 双重感染等患者的增加,发病率曾一度呈下降趋势的结核病再次成为威胁人类健康的主要疾病之一。
机体感染 MTB 后,抗原递呈细胞(antigen presenting cell,APC)吞噬 MTB,经 APC 处理的结核抗原通过抗原肽/HLA-II 复合物与 T 细胞受体(T cell receptor,TCR)之间的相互作用被递呈给 CD4+T 细胞,所以可以通过 TCR 四聚体染色技术来检测 APC 表面的结核抗原肽/HLA-II 复合物。四聚体技术具有直接、灵敏、迅速的特点,然而首先需筛选、鉴定出高特异性和高亲和力的结核特异性 TCR 四聚体[1-2]。本实验室将 HLA-DRA 与结核抗原肽的融合基因以及 HLA-DRB 基因共转染果蝇 S2 细胞,使用不同的结核抗原肽和不同的 HLA-DRB 等位基因构建多种膜表达结核抗原肽/HLA-DR 复合物的细胞株,即人工 APC,模拟 MHC-抗原肽分子模型。S2 细胞本身不会与 TCR 四聚体发生交叉反应,只是利用其能共转染多个重组质粒并高表达的特点建立表达模型,避免了用人体细胞作为表达系统可能产生的非特异结合反应。人工 APC 上重组的结核抗原肽/HLA-DR 复合物可用作 TCR 的配体,能够被用来检测已制备好的 TCR 四聚体能否与结核抗原肽/HLA-DR 复合物特异性结合、分析与不同的结核多肽以及不同的 HLA-DRB 基因型背景的细胞株是否具有不同的结合力,从而证明 TCR 四聚体是否具有特异性以及 HLA 限制性情况。
1 材料与方法
1.1 材料
果蝇 S2 细胞株购于美国 Invitrogen 公司;膜表面表达不同HLA-DR 等位基因/抗原肽的 S2 细胞株、共表达 CD4+α/β TCR 双链单体、生物素化酶、潮霉素 B 抗性基因的 S2 恒定细胞株由本课题组提供。
1.2 方法
1.2.1 结核特异性 CD4+α/β TCR 单体的复苏、诱导表达及纯化 复苏稳定转染有 pMT-TCRα、pMT-TCRβ、pMT/Bip-BirA 和潮霉素筛选质粒的果蝇 S2 恒定细胞株,在 28 ℃无 CO2培养箱中大量培养至800 ml左右,加 CuSO4(终浓度500 μmol/L)进行诱导表达,同时加入生物素(终浓度为 1 μg/ml)使表达蛋白生物素化。诱导 72 h 后,离心收集培养上清,加入胃蛋白酶抑制剂(终浓度 1 mmol/L)和苯甲基磺酰氟(PMSF)(终浓度1 μg/ml)抑制蛋白降解;以 12% PEG-6000 沉淀蛋白。沉淀以结合缓冲液(10 mmol/L 咪唑-PBS,pH 8.0)重悬后上 Ni-NTA 层析柱,再以洗涤缓冲液(20 mmol/L 咪唑-PBS)洗涤,然后用洗脱缓冲液(250 mmol/L 咪唑-PBS)洗脱,洗脱液用 30 kD 超滤管离心浓缩并以 PBS 交换液体。
1.2.2 斑点印迹实验鉴定 TCR 单体蛋白 将适当大小的 PVDF 膜于甲醇中浸泡 5 min 后,转入去离子水中浸泡 5 min 取出,将膜晾至半干。用加样枪吸取 20 μl 蛋白洗脱液,或 5 μl 蛋白浓缩液用 PBS 稀释至 20 μl 点在膜上,待其吸收完全时,将膜置入 5% 的脱脂奶粉中,4 ℃封闭过夜。PBST 洗后,将膜转入一抗鼠抗人α/β TCR 抗体(1:3000 稀释)中,4 ℃过夜。PBST 洗后,室温孵育碱性磷酸酶(AP)标记的二抗羊抗鼠-IgG(1:3000 稀释)2 h,PBS 洗 3 次,每次5 min。加显色底物 NBT/BCIP 混合液(10 ml 显色液中加入 66 μl NBT 混匀后,再加入 33 μl BCIP),室温孵育约 15 min,以去离子水冲洗终止反应,观察显色结果。
1.2.3 SDS-PAGE 电泳鉴定 CD4+α/β TCR 双链单体蛋白 取蛋白样本(CD4+α/β TCR 双链单体)20 μl 与 5 × 上样缓冲液混匀,100 ℃加热 5 min 使蛋白变性,上样电泳。稳压 100 V,待指示剂到达分离胶底部,停止电泳。取出凝胶,去除浓缩胶,往分离胶中加入考马斯亮蓝染液染色 5 min。倒掉染液,用脱色液浸泡分离胶,间隔换液洗涤至蛋白条带清晰,背景无色,观察记录结果。
1.2.4 CD4+α/β TCR 四聚体的制备 将纯化的 CD4+α/β TCR 双链单体与 PE 标记的链霉亲和素按摩尔比 8:1 混合,室温孵育 30 min(PE 标记的链霉亲和素每隔 5 min,分 8 次加入),制备好后于 4 ℃避光保存。
1.2.5 应用人工 APC 对 CD4+α/β TCR 四聚体 6M、6N 等的染色和流式检测 将每 106个膜表达重组的结核抗原肽/HLA-DR 复合物(未诱导表达和 CuSO4诱导表达后)的人工 APC 和终浓度 5 μg/ml 的亲和素共孵育从而阻断内源性生物素;细胞洗 2 次后加入 PE 标记的 CD4+α/β TCR 四聚体和 FITC 标记的抗人 HLA-DR(L243)染色,4 ℃孵育 20 min;PBS 洗涤 3 次后用 300 μl 2% 多聚甲醛重悬细胞,流式细胞仪检测。为了进一步证实 TCR 四聚体 6M、6N 与人工 APC 之间的结合是特异性结合,将只表达 HLA-DR 而不表达结核抗原肽的 S2 细胞株与结核多肽 E6、E7、C5、C14 在 28 ℃共孵育 2 h,用肿瘤多肽作为对照,然后用 PE 标记的 TCR 四聚体(6M和 6N)以及 FITC 标记的 L243 染色,流式细胞仪检测。该方法建立后同样的处理方式对实验室已构建的 9 个CD4+α/β TCR 四聚体(eu、6M、6N、6j、6p、A、B、C、D)进行筛选、鉴定。
2 结果
2.1 纯化 CD4+ α/β TCR 双链单体的斑点印迹实验鉴定
取 20 μl 蛋白过柱液、洗脱液或蛋白浓缩液点膜,用抗 α/β TCR 抗体作为一抗检测洗脱情况。图 1 结果显示诱导表达后获取的蛋白洗脱液或蛋白浓缩液内均分别含有相应的CD4+α/β TCR 双链复合物单体(6N 和 6M)。

1 2 3 4 5 6
Figure 1 The Dot blot results of CD4+α/β TCR monomers 6M and 6N
2.2 纯化 CD4+ α/β TCR 双链单体的 SDS-PAGE 鉴定
将纯化过程中PEG-6000沉淀后上清,10mmol/L咪唑-PBS 过柱液、20 mmol/L 咪唑-PBS 洗涤液以及 250 mmol/L 咪唑-PBS 洗脱液进行SDS-PAGE。由于分泌表达的 TCR 双链通过末端的 Fos 和 Jun 片段共价连接形成异二聚体,SDS-PAGE 时不解链,为 60 kD 左右。结果显示 PEG 沉淀后上清无蛋白条带,而 10、20、250 mmol/L 咪唑-PBS 的液体中均有 60 kD 目的条带,但前两者的液体中含有大量杂带,而 250 mmol/L 咪唑-PBS 的洗脱液目标条带清晰,杂带少。因此,以 10、20、250 mmol/L 咪唑-PBS 分别作为上样液、洗涤液和洗脱液是合适的。
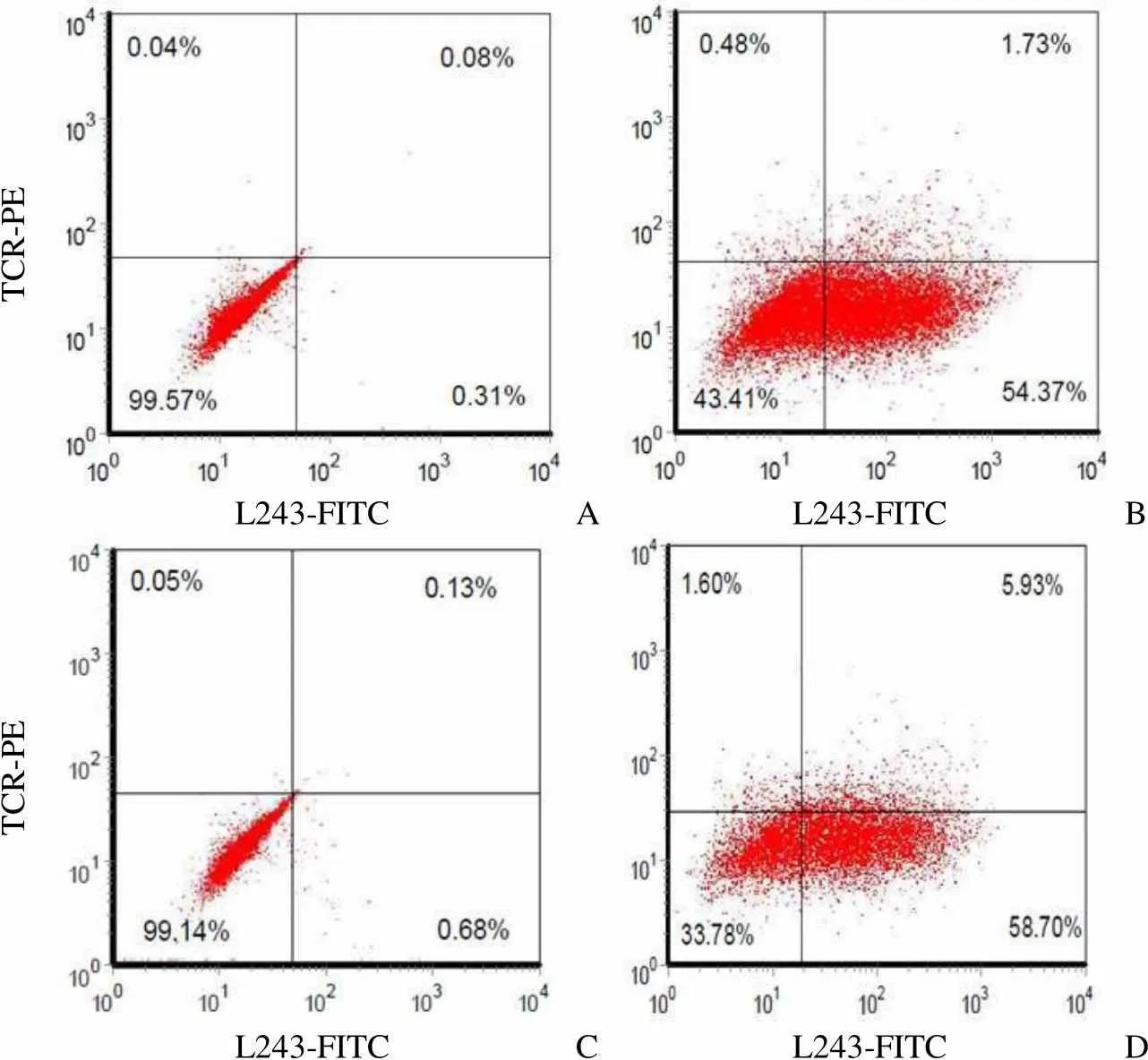
2.3 应用膜表达结核抗原肽/HLA-DR 细胞株对四聚体 6M、6N 的流式检测结果
TCR 与 MHC-肽的识别及结合具有特异性和限制性。将待测 PE 标记的CD4+α/β TCR 四聚体 6M、6N 与细胞膜表面表达重组的结核抗原肽/HLA-DR 复合物的 S2 细胞株共孵育,如果待检 TCR 四聚体为 MTB 特异性 CD4+α/β TCR 四聚体、同时 α 链与 β 链间配对较佳,该 TCR 四聚体将与 S2 细胞膜上结核抗原肽/HLA-DR 复合物结合识别,通过流式细胞术检出其特异性强弱与配对情况;同时配合与 L243-FITC 共孵育,则可以观察结核抗原肽/HLA-DR 复合物表达的强弱。通过未诱导表达和 CuSO4诱导表达后的两组数据比较分析,不同组合表达的特异性结核抗原肽/HLA-DR 复合物 2# 和 5# S2 细胞株 CuSO4诱导表达后 FITC-L243 的阳性率均比未诱导前有所增加,说明结核抗原肽/HLA-DR 复合物诱导后表达增强,同时 PE-TCR 四聚体的阳性结合率也有所提高,表明 TCR 四聚体 6M、6N 均为结核特异性的 CD4+α/β TCR 四聚体。结果如表 1 所示。其中表达结核抗原肽 C5/HLA-DRB1*0404 的 2# S2 细胞株对 6M、6N 同时识别 L243-FITC 和 PE-TCR 四聚体的比例分别达 1.73% 和 5.93%(图 2)。

表 1 膜表达结核抗原肽/HLA DR S2 细胞株对CD4+ α/β TCR 四聚体 6M和 6N 的流式细胞检测结果
TCR-PE L243-FITCAL243-FITCB TCR-PE L243-FITCCL243-FITCD
Figure 2 MTB-specific CD4+α/β TCR tetramers detection with No. 2 cell strain

四聚体 6MTCR tetramer 6M 四聚体 6NTCR tetramer 6N 四聚体阳性细胞百分率(%)Positive rate of TCR tetramers (%) 6.00 3.00 0.00 6.00 3.00 0.00 多肽 PeptideNone肿瘤多肽Tumor peptideC5C14E6E7 DRB1* DRB1* DRB1* DRB1*1504 08032 090102 1503 DRB1* DRB1* DRB1* DRB1* 1504 08032 090102 1503 细胞株 HLA-DRB1 等位基因HLA-DRB1 alleles of S2 cell strains
Figure 3 Results of CD4+α/β TCR tetramers 6M, 6N with S2 cell strains expressed only HLA-DR and MTB peptide together by flow cytometry
2.4 应用无多肽的膜表达细胞株与结核多肽共孵育对 6M、6N 的流式检测结果
将仅表达 HLA-DR 而不表达结核抗原肽的 S2 细胞株与结核多肽 E6、E7、C5、C14 共孵育,用肿瘤多肽作为对照,流式染色后上机检测。流式分析结果显示仅表达 HLA-DR 而不表达结核抗原肽的 S2 细胞株和对照肿瘤多肽组低背景染色,结核抗原肽孵育后,一些人工 APC 的四聚体阳性结合率有所提高。其中,以 TCR 四聚体 6M、6N 分别染色E7/DRB1*1504 和 C5/DRB1*090102 细胞株时,四聚体阳性结合率显著增高(图 3)。
2.5 应用 8 株人工 APC 细胞株对 9 个 CD4+ α/β TCR 四聚体的筛选结果
用 PE 标记已构建的 9 个 CD4+α/β TCR 四聚体(即四聚体 eu、6M、6N、6j、6p、A、B、C、D)、FITC 标记的抗 L243 抗体分别与 8 株膜表面表达结核抗原肽/HLA-DR 的S2 细胞株共孵育,流式细胞技术从中筛选出结核特异性 CD4+α/β 四聚体,8 株膜表达结核抗原肽/HLA-DR S2 恒定细胞株的组成见表 2。
流式分析结果显示 9 个四聚体均与 2# 细胞株(C5/HLA-DRB1*0404)有较高的阳性结合率,且四聚体 6p 与 20# 细胞株(C5/HLA-DRB1* 150101),四聚体 6j 与 5# 细胞株(E7/HLA- DRB1*0404)也有较高的阳性结合率,结果见图 4。由此说明本实验室已构建的9 个四聚体均为结核特异性 CD4+α/β TCR 四聚体。

表 2 8 株膜表达结核抗原肽/HLA-DRS2 细胞株的组成
3 讨论
结核抗原特异性 T 细胞活性的检测是了解机体的免疫状态和疾病转归的重要方法之一。人们致力于体外制备 MHC-肽复合物以及模拟 APC 特异性靶细胞表面 MHC 递呈的多肽复合物,直接检测能与之特异性结合的 T 细胞。但 TCR 与 MHC-肽复合物的特异性结合存在亲和力低、容易解离以及半衰期短等问题[3-4],而不能直接用于检测抗原特异性细胞。研究表明单聚体多聚化能提高作用物的亲和力[5]。目前,肽/MHC Class I 四聚体已被广泛用于分析 CD8+T 细胞在抗病毒[6]、抗肿瘤[7]和自身免疫病[8]中的作用。除本实验室的研究外,只有一篇关于 α/β TCR 四聚体的文献,即 Subbramanian 等[9]构建出对特定的多肽(SIV 多肽)有特异性的 α/β TCR 四聚体。TCR 四聚体是利用 MHC 四聚体技术通过类似的方法制备而成。但是由于 TCR 是细胞膜表面分子,构建有功能的可溶性 TCR 四聚体会有非常多的困难。首先,最主要的技术难题在于缺乏跨膜区的锚定点,仅依赖 TCR α/β 链间的二硫键 TCR 异二聚体难以维持稳定;其次,TCR-MHC/肽天然反应亲和力低,解离迅速;第三,自然条件下,T 细胞上的 TCR 识别 APC 上 MHC 递呈的抗原,需要细胞表面表达的 CD4 或者 CD8 分子等一系列分子的辅助。之前也没有人构建过结核特异性 α/β TCR 四聚体,同时,高特异性和高亲和力的结核特异性 TCR 四聚体筛选、鉴定较困难。本实验室参照科学家们设计的多种解决方案成功构建了结核特异性 CD4+α/β TCR 四聚体。本研究中,我们应用多种膜表达结核抗原肽/HLA-DR 复合物果蝇 S2 细胞株,用于检测已构建好的 α/β TCR 四聚体是否具有结核特异性,从中筛选出高特异性和高亲和力的 CD4+α/β TCR 四聚体用于后续研究。

图 4 应用8 株膜表达结核抗原肽/HLA-DR S2 细胞株对实验室已构建的9 个CD4+ α/β TCR 四聚体的流式分析结果
Figure 4 Screening results of 9 CD4+TCR tetramers with 8 membrane expressing MTB antigen peptide/HLA-DR S2 cell strains by flow cytometry
1992 年,Jackson 等[10]报道了 MHC 基因可以成功转染果蝇细胞并可在昆虫细胞表面表达。在此基础上,Sakita 等[11]在 1996 年研究了用 MHC Class I 类分子转染的昆虫细胞可作为 APCs 的方法。有研究者对这一方法进行了扩展,通过对 T2 和昆虫细胞 S2、Sf9 作为 APC 的比较,提出用昆虫细胞作为APCs 比自身的 APCs 更具敏感性和特异性[12]。本研究采用的果蝇 S2 细胞外源蛋白表达系统,结合了昆虫细胞高水平表达和哺乳动物细胞稳定表达的优点,非常适合低消耗而高水平的表达真核细胞蛋白。
应用膜表达结核抗原肽/HLA-DR 细胞株对结核特异性 CD4+α/β TCR 四聚体的流式检测结果显示,TCR 四聚体能与 MTB 特异性多肽结合,但不同的 TCR 四聚体与不同的特异性多肽和不同的 HLA-DR 结合能力有较大差异。两种四聚体(6M和 6N)均不与尚未诱导的细胞株以及仅表达 HLA-DR 而不表达结核抗原肽的 S2 细胞株结合,但细胞株与结核多肽(E6、E7、C5、C14)共孵育后对 6M、6N 的流式检测结果显示,一些人工 APC 的四聚体阳性结合率得到提高。上述结核抗原肽为我们在前期的研究工作,是针对我国活动性结核患者筛选获得的 CD4+T 细胞反应性多肽,来自于 MTB 蛋白质 ESAT-6 或CFP-10[13-14]。ESAT-6 和 CFP-10 仅存在于致病性结核菌,而不存在于卡介苗(BCG)及其他非结核分枝杆菌(环境分枝杆菌)[15]。这些结果均说明应用膜表达结核抗原肽/HLA-DR 细胞株筛选结核特异性 CD4+α/β TCR 四聚体的方法是可行的。本研究应用此种方法对实验室已构建的 9 个 CD4+α/β TCR 四聚体进行筛选,流式分析结果显示 9 个四聚体均与 2# 细胞株(C5/HLA-DRB1*0404)有较高的阳性结合率,提示 9 个四聚体均为结核特异性 CD4+α/β TCR 四聚体。
在后续的研究中我们以筛选出来的结核特异性较好的 CD4+α/β TCR 四聚体应用于临床标本的检测分析。将 PE 标记的 CD4+α/β TCR 四聚体、抗 CD14-FITC 抗体与结核患者及对照人群(包括非结核患者组、健康对照组及脐带血组)的外周血单个核细胞共孵育,以流式细胞术定量检测 TCR 四聚体及抗 CD14-FITC 染色双阳性的抗原特异性单核-巨噬细胞(APC)百分数。通过比较结核患者组及对照组 APC 的阳性率,进一步证实了筛选出来的四聚体的特异性;这些四聚体可应用于结核患者治疗前与治疗过程中 APC 水平变化的监测等[16]。
TCR 四聚体技术作为一种新的研究细胞免疫的方法,具有特异性结合,可定性、定量进行检测等特点,具有广阔的应用前景。而膜表达重组结核抗原肽/HLA-DR 复合物的细胞株能被用来检测 TCR 四聚体的特异性和亲和力,有助于从中筛选出高特异性和高亲和力的TCR 四聚体,获得的四聚体可为目前结核与潜伏结核临床实验诊断、疗效监测手段等方面存在的局限性提供可能的补充解决方法,也为 T 细胞和抗原递呈细胞间相互作用以及结核细胞免疫方面的研究提供新的研究方法和数据。
[1] Chen Y, Ren LL, Dong T, et al. Construction and application of cell fines screening Mycobacterium tuberculosis-specific tetramers of CD4+α/β T cell receptor. Chin J Microbiol Immunol, 2009, 29(3):271- 275. (in Chinese)
陈伊, 任亮亮, 董涛, 等.结核分枝杆菌特异性CD4+α/β T细胞受体四聚体筛选细胞系的构建及检测. 中华微生物学和免疫学杂志, 2009, 29(3):271-275.
[2] Cooper AM. Cell-mediated immune responses in tuberculosis. Annu Rev Immunol, 2009, 27:393-422.
[3] Corr M, Slanetz AE, Boyd LF, et al. T cell receptor-MHC class I peptide interactions: affinity, kinetics, and specificity. Science, 1994, 265(5174):946-949.
[4] Weber S, Traunecker A, Oliveri F, et al. Specific low-affinity recognition of major histocompatibility complex plus peptide by soluble T cell receptor. Nature, 1992, 356(6372):793-796.
[5] Altman JD, Moss PA, Goulder PJ, et al. Phenotypic analysis of antigen-specific T lymphocytes. Science, 1996, 274(5248):94-96.
[6] Radaelli A, Nacsa J, Tsai WP, et al. Prior DNA immunization enhances immune response to dominant and subdominant viral epitopes induced by a fowlpox-based SIVmac vaccine in long-term slow-progressor macaques infected with SIVmac251. Virology, 2003, 312(1):181-195.
[7] Vonderheide RH, Domchek SM, Schultze JL, et al. Vaccination of cancer patients against telomerase induces functional antitumor CD8+ T lymphocytes. Clin Cancer Res, 2004, 10(3):828-839.
[8] Kosor E, Gagro A, Drazenovic V, et al. MHC tetramers: tracking specific immunity. Acta Med Croatica, 2003, 57(4):255-259.
[9] Subbramanian RA, Moriya C, Martin KL, et al. Engineered T-cell receptor tetramers bind MHC-peptide complexes with high affinity. Nat Biotechnol, 2004, 22(11):1429-1434.
[10] Jackson MR, Song ES, Yang Y, et al. Empty and peptide-containing conformers of class I major histocompatibility complex molecules expressed in Drosophila melanogaster cells. Proc Natl Acad Sci U S A, 1992, 89(24):12117-12121.
[11] Sakita I, Horig H, Sun R, et al. In vivo CTL immunity can be elicited by in vitro reconstituted MHC/peptide complex. Immunol Methods, 1996, 192(1-2):105-115.
[12] Janetzki S, Song P, Gupta V, et al. Insect cells as HLA-restricted antigen-presenting cells for the IFN-gamma elispot assay. J Immunol Methods, 2000, 234(1-2):1-12.
[13] Yang FF, Tu ZQ, Fang YM, et al. Monitoring of peptide-specific and gamma interferon-productive T cells in patients with active and convalescent tuberculosis using an enzyme-linked immunosorbent spot assay. Clin Vaccine Immunol, 2012, 19(3):401-410.
[14] Li Y, Zhu Y, Zhou L, et al. Use of HLA-DR*08032/E7 and HLA-DR*0818/E7 tetramers in tracking of epitope-specific CD4+ T cells in active and convalescent tuberculosis patients compared with control donors. Immunobiology, 2011, 216(8):947-960.
[15] van Pinxteren LA, Ravn P, Agger EM, et al. Diagnosis of tuberculosis based on the two specific antigens ESAT-6 and CFP10. Clin Diagn Lab Immunol, 2000, 7(2):155-160.
[16] Huang Y, Huang Y, Fang Y, et al. Relatively low level of antigen-specific monocytes detected in blood from untreated tuberculosis patients using CD4+ T-cell receptor tetramers. PLoS Pathog, 2012, 8(11):e1003036.
Establishment and application of cell strains to screen specific CD4+α/β TCR tetramers
YAO Ya-nan, HUANG Yu-hong, WANG Juan, CHEN Yi, REN Liang-liang, LAI Xiao-min
To screen and identify MTB antigen-specific CD4+α/β TCR tetramers using different membrane expressing MTB antigen peptide/HLA-DR complex cell strains (artificial APCs).
PE labeled CD4+α/β TCR tetramers and FITC labeled anti-HLA-DR antibody (L243) were incubated with membrane expressing MTB antigen peptide/HLA-DR cell strains (before and after induction) or S2 cell strains expressing only HLA-DR or HLA-DR binding with MTB peptides E6, E7, C5, C14 or tumor peptide respectively, and then different binding capacity of TCR tetramers were detect and analyzed by flow cytometry.
Both TCR tetramers 6M and 6N showed a high positive rate with No. 2 cell strain (C5/HLA-DRB1*0404, 1.73% and 5.93% respectively). After incubation with MTB peptide, the percentage of tetramer positive rate increased in some of the artificial APCs, and high affinity was observed between all of the nine TCR tetramers and No. 2 cell strain respectively.
Membrane expressing MTB antigen peptide/HLA-DR complex cell strains could be used to screen and identify MTB-specific CD4+α/β TCR tetramers, and all of the nine tested TCR tetramers are MTB-specific.
Mycobacterium tuberculosis peptide; HLA-DR; Artificial APCs; CD4+T cell; TCR tetramer
LAI Xiao-min, Email: laixm@mail.sysu.edu.cn
10.3969/cmba.j.issn.1673-713X.2014.02.002
国家自然科学基金面上项目(81271779);“十二五”国家科技重大专项传染病防治专项(2012ZX10004903-004-002)
赖小敏,Email:laixm@mail.sysu.edu.cn
2013-11-13
Author Affiliations: Department of Microbiology, Zhongshan School of Medicine, Sun Yat-sen University, Ministry of Education Key Laboratory of Tropical Disease Control, Guangdong Provincial Department of Education Key Laboratory of Functional Molecules from Marine Microorganisms, Guangdong Provincial Research Center for Severe Infectious Disease Prevention and Control Technology, Guangzhou 510080, China

