PI3K/AKT信号转导通路与人舌鳞癌细胞TCA8113顺铂耐药的相关性研究
齐长娥,李德超,朱杨,姚丛姗,Hussein Helal,赵艳宇
佳木斯大学 附属口腔医院口腔种植科,黑龙江 佳木斯 154004
口腔鳞状细胞癌是口腔常见的恶性肿瘤之一,其主要治疗药物顺铂已广泛应用于临床,但只有10%~15%的患者病情有所缓解[1-3],抗肿瘤药物长期应用的耐药问题是制约其临床疗效的主要原因之一。研究表明,磷脂酰肌醇-3-激酶(phosphati⁃dylinositol-3-kinases,PI3K)信号传导通路在肿瘤细胞发生和发展中起着非常重要的调节作用,肿瘤细胞通过启动PI3K/Akt信号转导通路,诱导其增殖、分化,避免细胞发生凋亡[4],特别是对癌细胞耐药有明显的作用[5-6]。LY294002是PI3K特异性抑制剂,近年研究表明,LY294002可以增强某些化疗药物的疗效,起到化疗增敏的作用[8-10]。在此,我们主要探讨了PI3K特异性抑制剂LY294002逆转顺铂耐药口腔鳞癌细胞TCA8113/CDDP的可行性。
1 材料与方法
1.1 材料
人口腔舌鳞癌细胞系TCA8113(军事医学科学院生物工程研究所馈赠);PI3K/Akt信号传导通路阻滞剂LY294002(Selleck公司);顺铂(CDDP,齐鲁制药厂);DMEM/F12培养基(Hyclone公司);胎牛血清(Gibco公司);四甲基偶氮唑蓝(MTT,Sigma公司);p-Akt单克隆抗体(Ser473)、Akt单克隆抗体、PI3K多克隆抗体(Santa Cruz公司);鼠抗人β-actin鼠抗人多克隆抗体(武汉博士德生物技术有限公司)。
1.2 耐药细胞系TCA8113/CDDP的建立
取对数生长期的TCA8113细胞,在含0.3 μg/mL CDDP的DMEM-F12培养基(10%胎牛血清,青霉素、链霉素各200 U/mL)中,于5%CO2饱和湿度、37℃培养箱中培养2 d,更换正常培养液,待细胞正常传代后重复加药1次,在进入下一个浓度(以起始浓度的1倍间歇性加药)前培养1周[11],诱导耐药产生。
1.3 细胞耐药指数的测定
用0.25%胰酶将耐药细胞消化计数,调整细胞浓度为105/mL,接种于96孔板。加药组的CDDP浓度分别为64、32、16、8、4、2、1和0.5 μg/mL,每个浓度设置6个复孔,培养72 h;每孔加入20 μL MTT(5 mg/mL),培养4 h后加入100 μL/孔DMSO,振荡5 min后在酶联免疫检测仪上测定各孔的D490nm值,重复3次。计算IC50及耐药指数(RI)。
RI=耐药细胞系的IC50/亲代细胞的IC50
细胞存活率=(实验组D490nm值/对照组D490nm值)×100%
1.4 MTT检测药物对细胞的抑制率
取对数生长期的TCA8113和TCA8113/CDDP细胞,调整细胞密度为105/mL,接种于96孔培养板(200 μL/孔),待细胞长到70%~80%后将培养液换成分别含5、10、20、40 μmol/L LY294002的培养基,培养24、48 h(联合抑制组:在LY294002作用4 h后,TCA8113细胞加入0.8 μg/mL CDDP,TCA8113/CDDP细胞加入5.9 μg/mL CDDP,继续作用24 h),每孔加入5 mg/mL的MTT 20 μL,37℃培养箱内继续作用4 h后终止,每孔加入100 μL DMSO,振荡5 min后在全自动酶标仪上测定各孔的D490nm值,并计算不同浓度的LY294002及其联合顺铂对细胞增殖的抑制作用。
1.5 Western印迹检测p-Akt、Akt、PI3K蛋白的表达
不同浓度LY294002作用2种肿瘤细胞4 h后加入CDDP继续作用24 h,然后用预冷的PBS洗细胞3次,将细胞刮下,加入含5%PMSF和1 μmol/L磷酸酶抑制剂的全细胞裂解液75~100 μL,4℃放置1 h,期间不断吹打,15 000 r/min、4℃离心20 min,收集上清液进行定量分析,进行10%的SDS-PAGE,将电泳条带电转移至硝酸纤维素膜上,用5%脱脂奶粉室温封闭1 h,将膜加到用5%BSA稀释的Akt抗体(1∶400)、p-Akt抗体(1∶400)、PI3K抗体(1∶600)中,4℃孵育过夜,用TBST漂洗4次,加入1∶10 000稀释的辣根过氧化物酶标记的二抗,37℃孵育60 min,加入ECL发光液,在暗室中压片、曝光,用Image Lab凝胶成像系统拍照分析。
1.6 统计学分析
用统计学软件SPSS 17.0处理实验数据。多组间比较用单因素方差分析,所有结果均用x±s表示。
2 结果
2.1 耐药细胞系的建立
TCA8113细胞经0.3 μg/mL CDDP作用后,细胞间质增大,细胞内空泡增多,增殖速度减慢,悬浮死亡较多,细胞形态发生明显变化,比其亲代细胞颜色暗,细胞内颗粒堆积,2~3个月后可见细胞集落,正常传代后递增药物浓度,1年半左右时间初步建成TCA8113/CDDP细胞系,其耐CDDP的浓度为2.9 μg/mL,RI为7.7。
2.2 细胞抑制率的测定
LY294002(浓度分别为0、5、10、20、40 μmol/L)联合CDDP(浓度分别为0.8、5.9 μg/mL)作用于细胞24 h,对于 TCA8113 细胞,比单用 CDDP(0.8 μg/mL)抑制率分别提高了2%、13%、21%和32%;对于TCA8113/CDDP 细胞,比单用 CDDP(5.9 μg/mL)的抑制率分别提高了1%、10%、15%和24%)(图1、2)。说明LY294002对于CDDP有化疗协同的作用。
2.3 LY294002联合CDDP对p-Akt、Akt及PI3K表达的影响
在不同浓度LY294002作用下,TCA8113/CDDP细胞和TCA8113细胞中PI3K、AKT、p-AKT蛋白的表达有显著差异(P<0.05)。2组细胞中,在不同浓度LY294002作用下PI3K、AKT、p-AKT蛋白的表达与对照组相比均差异显著(均为P<0.05)。
3 讨论
建立肿瘤耐药细胞株的方法主要有基因转染法[13]和药物筛选法[14]。基因转染法是利用质粒、微脂体或病毒颗粒等作为载体,将特定的耐药基因片端转入肿瘤细胞,使其在新的细胞中表达而形成新的具有化疗耐药性的肿瘤细胞株。药物筛选法是将肿瘤细胞株反复暴露于化疗药物中,并逐渐增加药物的浓度,引起细胞基因谱表达改变,从而使细胞株表现出化疗耐药的特性。我们采用药物筛选法建立耐顺铂的舌磷癌细胞,起始药物浓度为0.3 μg/mL,经过1年半左右的时间初步建立了耐药性为3.2 μg/mL的TCA8113/CDDP细胞,耐药指数为7.7。与以往其他细胞的耐药细胞起始顺铂浓度3.0 μg/mL有所不同,起始药物浓度较低。
顺铂应用于临床多种实体肿瘤如睾丸癌、卵巢癌、食道癌、头颈部癌和小细胞肺癌等的治疗,而非小细胞肺癌和直肠癌在一期治疗后常产生耐药性。临床报道有多种顺铂导致耐药的机制,其中主要包括药物外流增加、药物吸收减少、GST-π被激活解毒功能增强、凋亡受限、DNA损伤修复等[15-16]。研究发现,CDDP可以激活多种信号转导通路,包括ATR、p53及MAPK信号通路,最终通过活化Caspase-3促进细胞抗凋亡[17]。本实验中,当顺铂初期作用于舌鳞癌细胞时,细胞会大量死亡,只有少量存活,但经过1年半时间的培养,细胞会对顺铂产生稳定的耐药性,在顺铂含量为2.86 μg/mL的培养基中可以正常传代。
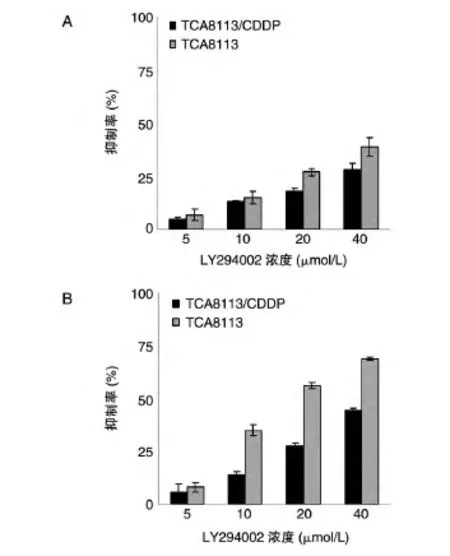
图1 LY294002对TCA8113和TCA8113/CDDP细胞的抑制率
PI3K/AKT细胞转导通路被认为是肿瘤细胞存活的首要通路,与肿瘤的发生、发展密切相关,在肿瘤细胞恶性增殖、转移,以及对放、化疗的拮抗中起重要作用[18]。p-AKT可将Bad磷酸化,失去与Bcl-XL结合的能力,恢复Bcl-2的抗凋亡能力[19]。LY294002能与PI3K竞争性结合ATP位点,通过抑制Akt的激活,能完全特异性地抑制PI3K的活性。本实验中,随着LY294002浓度的增大,耐药和非耐药口腔鳞癌细胞的抑制率都增加。这2种不同的细胞间,耐药细胞中AKT、p-AKT、PI3K的表达要比正常细胞明显增高,在同时用40 μmol/L的LY294002联合CDDP作用于2种细胞时,耐药细胞的PI3K表达比其亲代多39.6%,Akt蛋白多50%,p-AKT蛋白多17%。耐药细胞在CDDP的长期作用下,PI3K/AKT信号通路的表达比其亲代细胞TCA8113活跃,TCA8113/CDDP细胞中信号传导通路被激活,耐药细胞抗凋亡的能力比其亲代细胞要强。如何抑制PI3K/AKT信号转导通路中蛋白的表达,就成为逆转耐药的一条思路。在同一种细胞内,40 μmol/L的LY294002联合顺铂作用于细胞后,细胞的抑制率比空白对照组都高,说明40 μmol/L的LY294002与顺铂有药物协同作用,同时蛋白的表达也比空白和对照组明显降低。本研究结果表明,抑制PI3K/AKT通路可作为抑制顺铂耐药舌鳞癌细胞的一种方法。
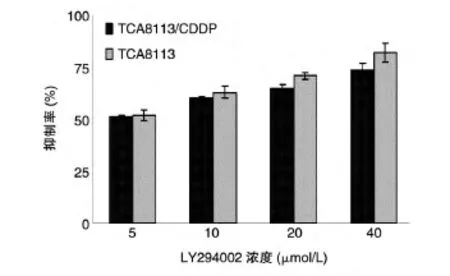
图2 LY294002联合CDDP作用24 h对TCA8113和TCA8113/CDDP细胞的抑制率
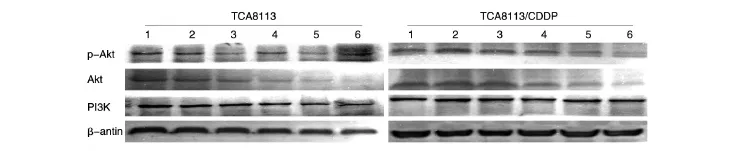
图3 TCA8113和TCA8113/CDDP细胞中p-Akt、Akt、PI3K蛋白的表达
[1]Arriagada R,Bergman B,Dunant A,et al.Cisplatin-based ad⁃juvant chemotherapy in patients with completely resected nonsmall-cell lung cancer[J].N Engl J Med,2004,350:351-360.
[2]Cooper J S,Pajak T F,Forastiere A A,et al.Postoperative concurrent radiotherapy and chemotherapy for high-risk squa⁃mous-cell carcinoma of the head and neck[J].N Engl J Med,2004,350:1937-1944.
[3]Coppin C M,Gospodarowicz M K,James K,et al.Improved local control of invasive bladder cancer by concurrent cisplat⁃in and preoperative or definitive radiation[J].J Clin Oncol,1996,14:2901-2907.
[4]Ho R,Eggert A,Hishiki T,et al.Resistance to chemothera⁃py mediated by TrkB in neuroblastomas[J].Cancer Res,2002,62:6462-6466.
[5]Middlemas D S,Kihl B K,Moody N M.Brain derived neuro⁃trophic factor protects human neuroblastoma cells from DNA damaging agents[J].Neurooncol,1999,45:27-36.
[6]Cantley L C.The phosphoinositicle 3-kinase pathway[J].Sci⁃ence,2002,296(5573):1655-1657.
[7]Liu L Z,Zhou X D,Qian G,et al.AKT1 amplification regu⁃lates cispla-tin resistance in human lung cancer cells through the mammalian tar-get of rapamycin/p70S6K1 pathway[J].Can⁃cer Res,2007,67(13):6325-6332.
[8]王晶宇,王志平,赵俊丽,等.LY294002联合姜黄素对人膀胱癌EJ细胞的体外抑制作用[J].中国临床药理学杂志,2011,27(1):37-41.
[9]Chen L,Han L,Shi Z,et al.LY294002 enhances cytotox-ici⁃tyoftemozolomide in glioma by down-regulation of the PI3K/AKT pathway[J].Mol Med Report,2012,5(2):575-579.
[10]Wu D,Tao J,Xu B,et al.Phosphatidylinositol 3-kinase inhibitor LY294002 suppresses proliferation and sensitizesdoxoru⁃bicin chemtherapy in bladdercancer cells[J].Urol Int,2011,87(1):105-113.
[11]周晓健,陈万涛,李卿,等.Tca8113细胞系耐药性的实验研究[J].上海口腔医学,2001,10(1):1-2.
[12]周晓健,李卿,陈万涛.人舌鳞状细胞癌顺铂耐药细胞系的建立及其耐药基因表达[J].上海口腔医学,2003,12(6):2-3.
[13]Findling-Kagan S,Sivan H,Ostrovsky O,et al.Establish⁃mentand characterization of new cellular lymphomamodel ex⁃pressing transgenic human MDR1[J].Leuk Res,2005,9(4):407-414.
[14]马强,张振书,王群,等.结肠癌细胞多药耐药模型LoVo/Adr的建立及其耐药相关基因的表达[J].中华消化杂志,2002,22(7):412-415.
[15]Coley H M.Mechanisms and consequences of chemotherapy resistance in breast cancer[J].EJC Supplements,2009,7:3-7.
[16]Stewart D J.Mechanisms of resistance to cisplatin and carbo⁃platin[J].Crit Rev Oncol Hematol,2007,63:12-31.
[17]Brozovic A,Osmak M.Activation of mitogen-activatedtrotein kinases by cisplatin and their role in cisplatin-re-sistance[J].Cancer Lett,2007,251(1):1-16.
[18]Morgensztern D,McLeod H L.PI3K/AKT/Mtor path-way as a target for cancer therapy[J].Anti Cancer Drugs,2005,16(8):797-803.
[19]Chong Z Z,Maises K.Targeting WNT,protein kinase B,and mitochondrial membrane integrity to foster cellularsurvival in the nervous system[J].Histol Histopathol,2004,19(2):495-504.

