基于裂解酶与ATP生物发光法特异定量检测炭疽杆菌方法的研究
张博,康怀兴,米志强,安小平,张飞雄,童贻刚
1.首都师范大学 生命科学学院,北京 100048;2.军事医学科学院 微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071
炭疽是严重威胁人类健康的烈性传染病,其病原体为炭疽芽孢杆菌(Bacillus anthracis)。由于其高毒性,炭疽杆菌是一种潜在的生物武器,曾被作为致死战剂之一。目前,皮肤炭疽在我国各地还有散在发生,不应放松警惕。因此,发展快速、灵敏的炭疽杆菌检测方法具有重要意义[1-3]。
噬菌体裂解酶是噬菌体在感染宿主菌末期表达的蛋白质,它通过水解细菌细胞壁的肽聚糖使子代噬菌体释放[4-5]。γ噬菌体裂解酶(γ phage lysin,PlyG)能够特异性地杀死炭疽杆菌,同时也能裂解蜡样芽孢杆菌(B.cereus)RSVF1(ATCC 4342)菌株,且RSVF1是惟一对PlyG敏感的蜡样芽孢杆菌菌株[6]。Yemini等就曾以蜡样芽孢杆菌为模型,研究了基于噬菌体的炭疽杆菌检测方法[7];李曼等也以蜡样杆菌RSVF1芽孢为模型,进行了杀灭试验的相关研究[8]。
ATP普遍存在于所有活的生物体中,当生物体死亡后,在细胞内酶的作用下,ATP很快被分解掉。所以通过测定样品中的ATP浓度,即可推算出活菌数[9]。在Mg2+存在下,萤火虫萤光素酶(luciferase,Luc)以D-萤光素、ATP、O2为底物,将化学能转化为光能,发出荧光。据此,可对微生物细胞内的ATP进行测定,从而定量检测细菌数[10-11]。
国内外多项研究都曾以蜡样芽孢杆菌RSVF1为对象来替代炭疽杆菌,并且Schuch等[6]的研究也充分证明PlyG对于RSVF1和炭疽杆菌具有明显的裂解酶活性,而不能裂解其他菌株。本研究以此为基础,以蜡样芽孢杆菌RSVF1为指示菌,通过结合裂解酶与ATP生物发光法,进行了对炭疽杆菌定性定量检测的模拟实验。
1 材料与方法
1.1 材料
蜡样芽孢杆菌RSVF1购自美国模式培养物集存库(ATCC),其他菌株为本实验室保存;克隆菌株大肠杆菌Trans1-T1、表达菌株大肠杆菌BL21(DE3)购自北京全式金生物技术公司;质粒pUC19-plyG、pLenti-luc为本实验室保存;限制性内切酶NdeⅠ、EcoRⅠ-HF和T4DNA连接酶购自NEB公司;引物由北京诺赛基因组研究中心有限公司合成;2×TransTaq HiFi PCR SuperMixⅡ购自北京全式金生物技术有限公司;胶回收试剂盒购自德国QIAGEN公司;DNA marker、蛋白质marker和质粒提取试剂盒均购自北京博迈德生物技术有限公司;镍柱预装柱购自上海生工生物工程有限公司;萤光素酶检测试剂盒、D-萤光素(甲虫萤光素,钾盐)购自Promega公司;Profile-1 3560(10X)ATP微生物快速检测系统购自北京浩正智信科技有限公司;其它常规试剂由本实验室自备;BHI(brain heart infusion)培养基购自美国BD医疗器械有限公司,LB培养基为自配。
1.2 plyG和luc基因的克隆及表达载体的构建
根据已知的质粒pUC19-plyG和pLenti-luc的序列设计引物[12-13],在2组引物的上游均加入His标签(斜体字母)以方便纯化。引物分别为plyG-F(5'GGAATTCCATATGCATCACCATCACCATCACATG GAAATCCAA3',下划线序列为NdeⅠ酶切位点)、plyG-R(5'CGGAATTCTTATTTAACTTCATACCACC AACCTTT3',下划线序列为EcoRⅠ酶切位点)、luc-F(5'GGAATTCCATATGCATCACCATCACCATCACGGA TCCATGGAA3',下划线序列为NdeⅠ酶切位点)和luc-R(5'CGGAATTCTTACACGGCGATCTTTC3',下划线序列为EcoRⅠ酶切位点)。
分别以pUC19-plyG和pLenti-luc为模板,50 μL体系中使用2×TransTaq HiFi PCR SuperMixⅡ,PCR扩增目的基因序列(plyG:94℃预变性5 min,以94℃ 30 s、55℃ 30 s、72℃ 45 s行35个循环,72℃延伸 7 min,4℃恒温;luc:94℃预变性 5 min,以94℃ 30 s、55℃ 30 s、72℃ 100 s行35个循环,72℃延伸7 min,4℃恒温)。
琼脂糖凝胶电泳检测PCR结果,切胶回收目的基因片段。NdeⅠ、EcoRⅠ双酶切目的基因和表达载体pET22b,连接转化至大肠杆菌Trans1-T1,提取质粒,双酶切鉴定,挑选阳性克隆,质粒分别命名为pET22b-plyG和pET22b-luc。
1.3 重组裂解酶和萤光素酶的表达及纯化
将重组表达载体pET22b-plyG和pET22b-luc转化至大肠杆菌BL21(DE3),涂于含有氨苄西林(终浓度100 μg/mL)的固体LB培养基平板上,倒置平板,37℃过夜培养;挑取单克隆摇菌至对数期,加入IPTG(终浓度1 mmol/L),16℃低温诱导24 h;诱导后的菌液10 000×g离心10 min,弃上清,用PBS重悬菌体,超声波破碎处理后10 000×g离心10 min,收集上清,经0.45 μm滤膜过滤后过镍柱纯化,表达及纯化结果以SDS-PAGE方法检测。用ASP3700紫外光/可见光微量分光光度计测定纯化后酶液的蛋白含量。
1.4 酶活性检测
将蜡样芽孢杆菌RSVF1培养至对数期,取500 μL铺双层BHI平板,室温静置10 min,吸取1.5 μL纯化的PlyG酶液滴于平板上,同时以PBS缓冲液为空白对照,正置于30℃温箱中30 min,待酶液吸收后倒置,培养6 h后观察结果。
将纯化的萤光素酶液进行梯度稀释,取稀释后的酶液各10 μL与50 μL萤光素酶检测试剂盒中的检测底物混合,于Profile-1 3560(10X)ATP微生物快速检测系统中测得相对发光单位(RLU)。做3组重复,以测得数值的平均值来反映萤光素酶的相对活性。
1.5 平板计数法定量检测蜡样芽孢杆菌RSVF1
将培养好的RSVF1菌液按1/10梯度分别稀释至10-1、5×10-2、10-2、5×10-3、10-3、5×10-4、10-4、5×10-5、10-5,分别吸取50 μL涂布于固体LB平板,37℃倒置培养过夜,每个梯度做3个重复,同时做空白对照。次日选取菌落数为30~300的稀释度作为标准计算平均值,为平板计数结果[14]。
1.6 ATP发光法定量检测蜡样芽孢杆菌RSVF1
用PBS缓冲液配置D-萤光素/萤光素酶混合溶液,使得D-萤光素浓度为150 mg/L,萤光素酶浓度为100 mg/L[15]。取如1.5所述的9个稀释度的菌液和细菌原液以及空白对照,按照Profile-1 3560(10X)ATP微生物快速检测系统标准操作进行:分别取50 μL加入专用的过滤比色杯中,比色杯下铺一层滤纸;滴加4滴SRA试剂(非细菌细胞释放液),用压力器对准比色杯顶端,按下压力器把液体压出至滤纸,重复该步骤一次;将比色杯放入3560(10×)微光度计的抽屉中,加入50 μL稀释至1/10的PlyG酶液,等待2 min,使细菌充分被裂解;吸取50 μL D-萤光素/萤光素酶混合溶液加入比色杯,吸排混匀3次,推回抽屉,记录仪器读数。每个浓度梯度的样品做3组重复,计算平均值为最终结果[16-17]。
2 结果
2.1 plyG、luc基因的扩增和重组表达载体pET22bplyG、pET22b-luc的构建
PCR扩增得到的plyG基因片段约740 bp,luc基因片段约1700 bp,电泳检测结果如图1。重组表达载体pET22b-plyG经NdeⅠ、EcoRⅠ双酶切后,电泳检测结果显示释放约5400和740 bp的片段(图2);重组表达载体pET22b-luc经NdeⅠ、EcoRⅠ双酶切后,电泳检测结果显示释放约5400和1700的片段(图2)。
2.2 SDS-PAGE检测PlyG和Luc的表达和纯化
菌体经PBS重悬和超声波破碎处理,上清上样经电泳检测,分别在相对分子质量约27×103和60×103处有特异性条带,大小与所报道的蛋白大小一致,证明目的蛋白均实现了可溶性表达;过镍柱纯化后,2个蛋白的条带较单一,得到了较纯的蛋白。测定蛋白浓度,PlyG为0.9 mg/mL,Luc为0.3 mg/mL(图3)。
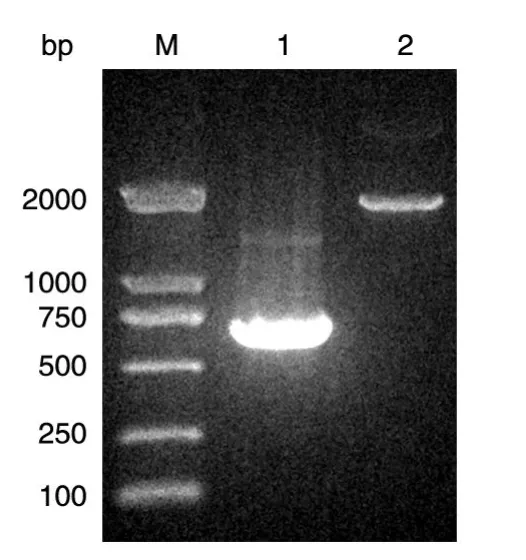
图1 PCR扩增得到的plyG、luc基因片段
2.3 裂解酶和萤光素酶活性检测
点滴法验证PlyG活性结果如图4,在滴有纯化后的PlyG区域出现透亮的圆形裂解斑,直径约5 mm。利用萤光素酶检测试剂盒测得纯化后的萤光素酶比活约为3.3×1010RLU/mg。
2.4 平板计数法与ATP生物发光法定量检测蜡样芽孢杆菌RSVF1
3组稀释度为10-5细菌溶液的平板计数结果分别为118、123和141,平均值为132,并由此计算其他稀释度细菌溶液的平板计数结果。平板计数测得的细菌总数与ATP发光法测得的发光值结果见表1。
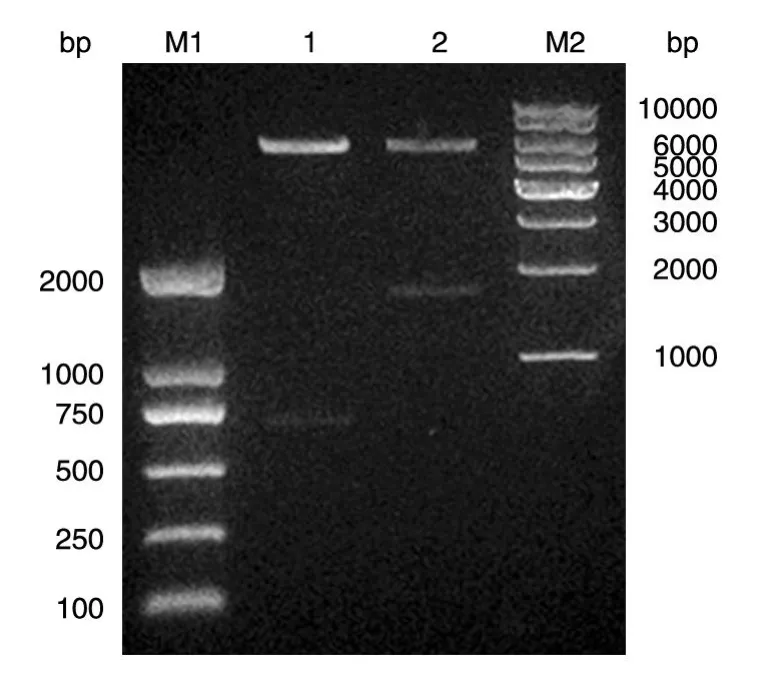
图2 NdeⅠ、EcoRⅠ双酶切重组载体pET22b-plyG和pET-luc
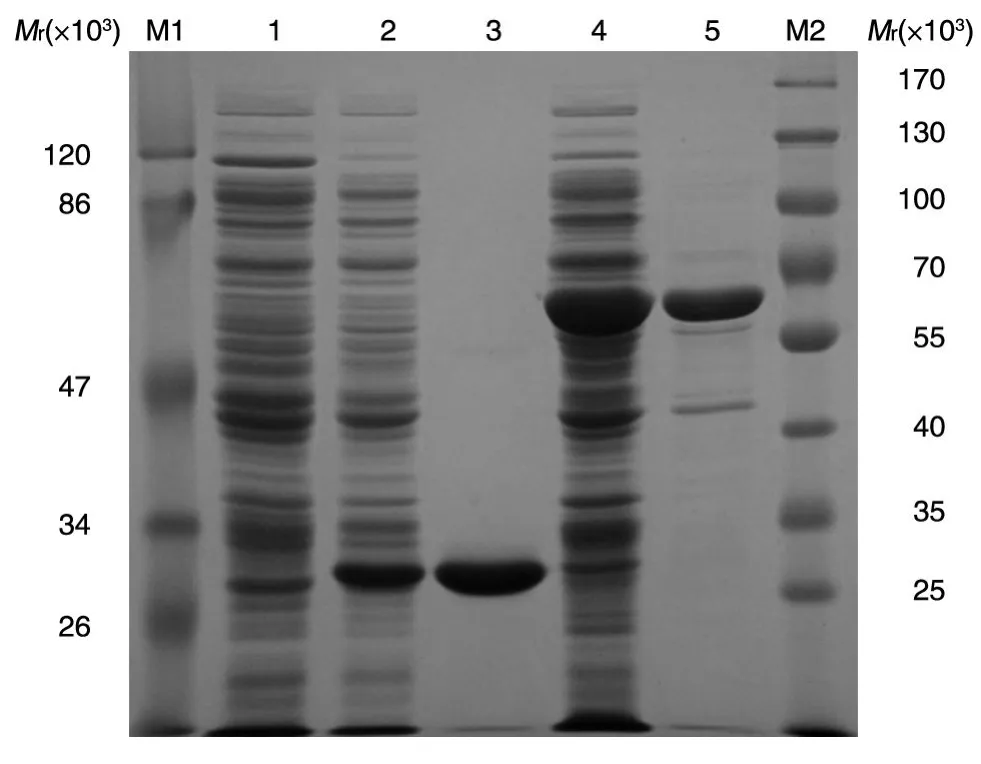
图3 SDS-PAGE检测裂解酶与萤光素酶的表达纯化结果

图4 PlyG点板验证裂解活性
2.5 ATP测定法与平板计数法的相关性
根据表1,采用10-4及以上稀释度各组数据,以平板计数的对数值lg(N/cfu)(N为细菌数)为x轴,以发光值的对数值lg(N/RLU)(N为相对光单位)为y轴,做x、y散点图描绘关系曲线如图5。由图可知,菌落总数与发光值呈显著相关性。由表1和图5可知,该方法最低可检测出50 μL菌液中的约1300个菌落;当细菌数为1300 cfu以上时,荧光发光值与细菌总数呈显著的线性相关。
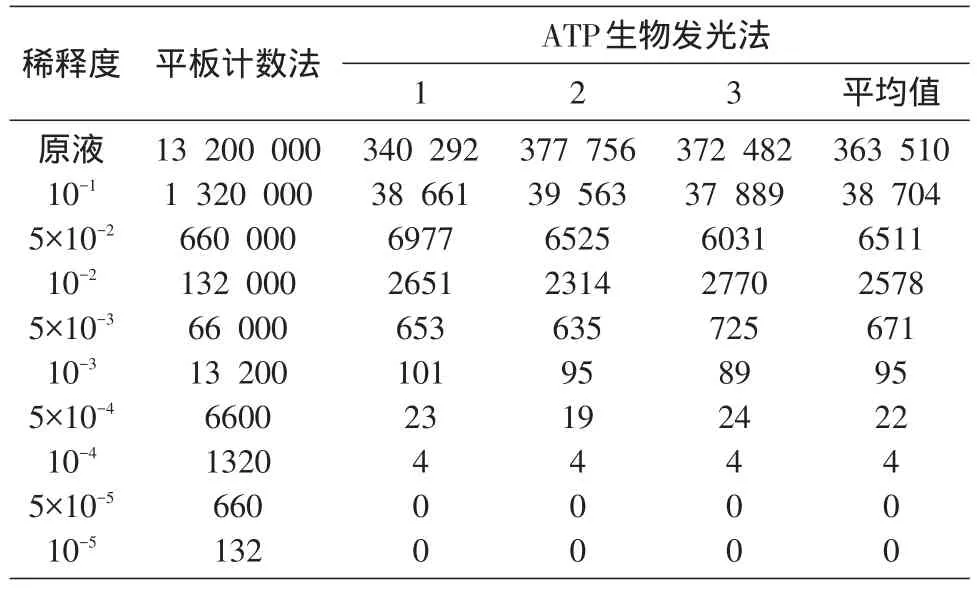
表1 蜡样芽孢杆菌RSVF1平板菌落数与荧光发光值

图5 菌落总数与发光值的标准曲线
3 讨论
近年来,随着生物技术的快速发展,以炭疽杆菌噬菌体裂解酶进行治疗和检测的研究层出不穷[3]。利用ATP生物发光对细菌进行定量检测的方法也已应用于食品工业、临床检测等众多领域[9],Stopa等的研究,对于应用萤光素-萤光素酶检测系统检测细菌数量提供了详细的理论基础与操作方法[16]。
目前以ATP生物发光法定量检测细菌的研究往往采用细胞裂解液来裂解细菌从而释放ATP,大多不具有特异性和专一性。γ噬菌体裂解酶能高效地裂解炭疽杆菌和蜡样芽孢杆菌RSVF1,Schuch等和李晓静等的研究对于PlyG的裂解特异性均提供了充分的实验证明[6,12];萤光素-萤光素酶检测系统因其检测快速灵敏对于定量检测细菌又有着不可比拟的优势。因此,我们采用大肠杆菌原核表达系统高效表达了噬菌体裂解酶和萤光素酶,并且在蛋白前端加入His标签,采用镍柱亲和层析方法纯化目的蛋白,操作简便易于纯化,得到了较纯的酶液。以这2种酶为关键工具,以蜡样芽孢杆菌RSVF1为模型,建立了荧光发光值与细菌数量之间的线性关系且二者相关性显著。该检测方法的检测下限为1300 cfu,可以满足一般检测的需求;当样品所含细菌数量低于1300 cfu时,可采用简便的浓缩富集技术或多次加样的方法,使浓缩后的样品菌落总数在有效检测范围以内,检测后再通过换算得到原样品的细菌数量。
另外,在炭疽应急检测方面,对芽孢的检测尤为重要。Lee等的研究证实,对芽孢加入TSB培养基并进行37℃、15 min的温育处理,可成功地使芽孢发芽,从而实现对芽孢的定量检测[17]。根据该研究结果,对蜡样芽孢杆菌RSVF1的芽孢或炭疽芽孢杆菌的芽孢做同样的处理,同时配合裂解酶与ATP生物发光法,便能够对芽孢进行特异性定量检测。
本研究所建立的方法是以蜡样芽孢杆菌RSVF1为裂解对象,该菌株与炭疽杆菌一样对PlyG敏感,因此将这套方法直接移植到对炭疽杆菌的检测中具有较强的可行性。因该方法具备传统ATP发光法检测技术灵敏快速的优点,在裂解细菌方面又具有特异性,在应用于现场或临床定性定量检测炭疽杆菌方面具有良好的前景和实用价值。
[1]Inglesby T V,Henderson D A,Bartlett J G,et al.Anthrax as a biological weapon:medical and public health manage⁃ment.Working Group on Civilian Biod[J].JAMA,1999,281(18):1735-1745.
[2]Mock M,Fouet A.Anthrax[J].Annu Rev Microbiol,2001,55:647-671.
[3]刘炬,徐俊杰,陈薇.炭疽杆菌检测方法的研究现状与展望[J].微生物学报,2012,52(7):809-815.
[4]陈蔚青,王晓枫,王普,等.噬菌体裂解酶:抗菌作用与药物开发研究[J].中国新药杂志,2009,18(10):891-894.
[5]López R,García E,García P,et al.The pneumococcal cell wall degrading enzymes:a modular design to create new lysins[J].Microb Drug Resist,1997,3(2):199-211.
[6]Schuch R,Nelson D,Fischetti V A.A bacteriolytic agent that detects and kills Bacillus anthracis[J].Nature,2002,418(6900):884-889.
[7]Yemini M,Levi Y,Yagil E,et al.Specific electrochemical phage sensing for Bacillus cereus and Mycobacterium smegma⁃tis[J].Bioelectrochemistry,2007,70:180-184.
[8]李曼,侯利华,曹晓梅,等.乳酸链球菌素对蜡样杆菌芽孢作用的初步研究[J].中国消毒学杂志,2009,26(2):126-128.
[9]唐倩倩,叶尊忠,王剑平,等.ATP生物发光法在微生物检验中的应用[J].食品科学,2008,29(6):460-465.
[10]McElroy W D.Crystalline firefly luciferase:LH2+ATPLH2-AMP+PPLH2-AMP+O2:L-AMP+light+H2O[J].Methods Enzy⁃mol,1963,(6):445-448.
[11]郝巧玲,吕斌,周宜开,等.生物发光法快速检测细胞内三磷酸腺苷[J].华中科技大学学报:医学版,2005,34(1):61-64.
[12]李晓静,张豪,付学奇,等.炭疽杆菌噬菌体裂解酶基因在大肠杆菌中的表达及鉴定[J].生物工程学报,2005,21(2):216-219.
[13]夏蕾,饶志明,沈微,等.荧光素酶编码基因luc在大肠杆菌中的克隆、表达及纯化[J].食品与生物技术学报,2008,27(5):36-66.
[14]马妮,赵虹,张旭,等.ATP发光技术快速检测食品中菌落总数[J].中国卫生工程学,2008,7(5):296-297.
[15]李利霞,伍金娥,常超,等.ATP生物发光检测技术的建立及应用可行性分析[J].食品科技,2012,37(1):275-279.
[16]Stopa P J,Tieman D,Coon P A,et al.Detection of biologi⁃cal aerosols by luminescence techniques[J].Field Anal Chem Technol,1999,3(4-5):283-290.
[17]Lee J,Deininger R A.A rapid screening method for the de⁃tection of viable spores in powder using bioluminescence[J].Luminescence,2004,19(4):209-211.

