HPV16 E6通过阻碍ING4对p53作用而抑制细胞凋亡的研究
郭 毅,赵 楠,李天人,李 慧
(中国医科大学附属第一医院妇产科,辽宁 沈阳 110001)
宫颈癌在世界范围内居女性肿瘤发病率的第二位,高危型人乳头瘤病毒(HPV)的持续感染是宫颈癌发生的最重要致病因子,HPV16的E6和E7是宿主细胞永生化转变的主要致癌蛋白[1]。HPV16 E6通过与一系列细胞因子的结合调控细胞的分化、黏连、极化、增殖、凋亡、基因转录和染色体的稳定。HPV16 E6与这些细胞因子的作用对细胞的癌变及病毒本身的存活都至关重要。ING4是第二类肿瘤生长抑制因子家族中的一员[2]。许多人体肿瘤都有ING家族蛋白的功能失调[3-4],我们之前报道了HPV通过阻碍ING4与p53蛋白的结合而抑制细胞凋亡[5],本实验进一步阐明了该作用机制,并表明HPV16 E6抑制ING4诱导的p53蛋白第382位氨基酸的乙酰化而抑制细胞凋亡,且该作用不依赖p53蛋白的降解。
1 材料与方法
1.1 材料
用于转染的Flag标记的HPV16 E6质粒以HPV16 PCDNA3-E6 cDNAs为模板,PCR扩增后经HindIII和XbaI双酶切后插入于HindIII和XbaI位点插入 pA3F 载体(Sigma,St Louis,MO)。Flag-E6 L50G是不与E6相关蛋白(E6AP)相结合并不引起p53蛋白降解的突变体,是由定点突变获得(QuikChange;Stratagene)[6]。 pCDNA-ING4 及Myc-p53如前所述[4],所有质粒均经测序证实。抗ING4兔多抗和抗HPV16 E6(C1P5)的鼠单抗购于 Santa Cruz公司(Santa Cruz,CA);抗 flag(M2)的鼠单抗购于Sigma-Aldrich公司(St.Louis,MO);抗Myc(9E10)的鼠单抗购于Abcam公司(Cambridge,MA);鼠抗p53单抗 DO-1购自 Santa Cruz生物技术公司(Santa Cruz,CA);Saos-2(p53-/-)为p53阴性的骨肉瘤细胞系。
1.2 方法
1.2.1 转染、免疫蛋白共沉淀和免疫蛋白印迹(Western blot)杂交 采用Bio-Rad Gene Pulser II型电穿孔仪将 Flag-E6、Myc-p53和 PCDNA-ING4三种质粒共转染Saos2细胞,培养24 h后收集细胞,RIPA缓冲液裂解。离心去除细胞碎片后的裂解液中加入鼠血清和30 μL 1∶1蛋白A和蛋白G琼脂糖凝胶珠子4℃旋转1 h预处理,加入1 μg一抗4℃旋转过夜沉淀目的蛋白,然后加入30 μL 1∶1蛋白A和蛋白G琼脂糖凝胶珠子捕获所形成的免疫复合物并沉淀。免疫沉淀得到的蛋白进行Western blot分析。
1.2.2 谷胱苷肽-S转移酶(GST)融合蛋白纯化 用表达相关GST融合蛋白的质粒转化大肠埃希菌BL21,挑选单个菌落接种含有100 μg/mL氨苄青霉素的3 mL LB培养基过夜,次日取其中1 mL接种500 mL同样培养基,当光密度在600 nm达到0.6时,加入 1 mmol/L异丙基-β-D-硫代半乳糖苷(IPTG)30℃诱导12 h。然后沉淀细菌,用STE 缓冲液(100 mmol/L NaCl,10 mmol/L Tris,1 mmol/L EDTA,pH 7.5)洗涤1 次,再用3 mL 加入蛋白酶抑制剂的NETN缓冲液(0.5%NP-40,100 mmol/L NaCl,20 mmol/L Tris,1 mmol/L EDTA,pH 8.0)重新悬浮,冰浴15 min。再加入150 μL 1 mol/L二硫苏糖醇(DTT)和1.8 mL含有10%肌氨酰(Sarkosyl)的STE缓冲液,在冰中超声裂解3 min将蛋白溶解。裂解物离心(12000×g,10 min,4℃)分离未溶解成分,将上清成分转移到新的离心管,加入3 mL含有10%Triton X-100的STE缓冲液及200 μL谷胱甘肽琼脂糖珠,4℃旋转过夜。离心收集与谷胱甘肽琼脂糖珠结合的蛋白(2 min,600×g,4℃)并用加有蛋白酶抑制剂的NETN缓冲液洗涤5次。用SDS聚丙烯酰胺凝胶电泳检测纯化程度并将纯化的蛋白放于4℃保存。
1.2.3 谷胱苷肽-S转移酶共沉淀实验 对于细胞裂解成分的共沉淀分析,首先用RIPA缓冲液(0.5%NP-40、10 mmol/L Tris(pH 7.5)、2 mmol/L EDTA、150 mmol/L NaCl以及蛋白酶抑制剂)处理。裂解物经过预清除然后与谷胱甘肽琼脂糖珠对照或相应的谷胱甘肽琼脂糖珠融合蛋白结合。在体外结合实验中,谷胱甘肽琼脂糖珠对照或相应的谷胱甘肽琼脂糖珠融合蛋白与体外翻译蛋白在结合缓冲液 (1×PBS,0.1%NP-40,0.5 mmol/L DTT、10%甘油以及蛋白酶抑制剂)共培育。体外蛋白翻译采用TNT快速转录/翻译偶联系统 (Promega Inc.、Madison、WI),操作步骤同产品说明。
1.2.4 荧光素酶报告基因检测p53蛋白活性采用电穿孔方法将 p21WAF1/CIP1启动子质粒(2 μg)、myc-p53 质粒 (10 μg)、PCDNA-ING4(10 μg)、Flag-E6(10 μg)及 Flag-E6 L50G(10 μg)的不同组合分别转染12×106Saos2细胞。24 h后,收集细胞,PBS洗涤,用细胞裂解液裂解细胞。用LMAX II384化学发光酶标仪检测细胞裂解物中的荧光强度,即代表了p53蛋白在转录水平的活性。取一部分的细胞裂解物做蛋白免疫印迹检测相应的蛋白表达。所有实验均重复3次,所得结果为其均值。
1.2.5 细胞集落形成实验 将Myc-p53、PCDNAING4、Flag-E6或Flag-E6 L50G转染Saos2细胞,转染的细胞用加入5 mg/mL G418的DMEM培养基选择,经过2周的筛选,细胞用4%福尔马林固定、0.1%结晶紫染色。用Li-Cor Odyssey计数培养皿中的细胞集落数,实验重复2次。
1.2.6 统计方法 采用SPSS11.0软件进行卡方分析。
2 结果与分析
2.1 HPV16 E6抑制ING4诱导的p53蛋白乙酰化
为检测HPV16 E6对ING4介导的p53蛋白乙酰化的影响,将PCDNA-ING4和Myc-p53分别与Flag标记的HPV16 E6或其变异体L50G共转染SaoS2细胞。转染24 h后,收集细胞前加入组蛋白去乙酰化酶抑制剂trichostatin A再培养6 h稳定乙酰化的p53蛋白。转染细胞的裂解液Western blot显示HPV16 E6及其突变体L50G对ING4蛋白的表达无影响,HPV16 E6能抑制p53蛋白的表达,而HPV16 E6 L50G主要是抑制p53蛋白的乙酰化。免疫共沉淀实验表明HPV16 E6 L50G不能与E6AP结合,但HPV16 E6及其突变体L50G均能抑制ING4与p53蛋白的结合,且该作用不依赖于p53蛋白的降解(图1)。
2.2 HPV16 E6减弱ING4与p53相结合
Flag-E6及Myc-p53采用T7-TNT快速偶联转录-翻译系统进行蛋白的体外表达,GST及其标记的ING4经过大肠埃希菌表达蛋白与体外翻译的Flag-E6及Myc-p53蛋白共孵育。在Flag-E6蛋白存在时,GST-ING4蛋白结合珠子沉淀的Myc-p53蛋白明显减少,而作为对照单独GST结合珠子与这2种蛋白均没有结合功能。考马斯蓝染色显示了在结合实验中所用的GST及GST-ING4融合蛋白的表达量。该实验表明HPV16 E6减弱ING4与p53蛋白的结合(图2)。
2.3 HPV16 E6抑制ING4介导的p53基因的转录
将不同组合的 Flag-E6、Flag-E6 L50G、PCDNA-ING4以及Myc-p53基因质粒与p21WAF1/CIP1报告基因质粒共转染Saos-2细胞,36 h后收集、裂解细胞进行荧光素酶报告基因检测。结果显示,p53与p21WAF1/CIP1报告基因共转染能激活荧光素酶的表达;当加入ING4后,p53的下游基因p21WAF1/CIP1启动子的活性明显增高;而Flag-E6和其突变体L50G均能减弱p21WAF1/CIP1启动子的活性(图3)。图中标准误线来自3次实验。因为HPV16 E6 L50G没有降低p53蛋白表达的作用,HPV16 E6抑制ING4对p53蛋白的功能是其发挥作用的机制之一。
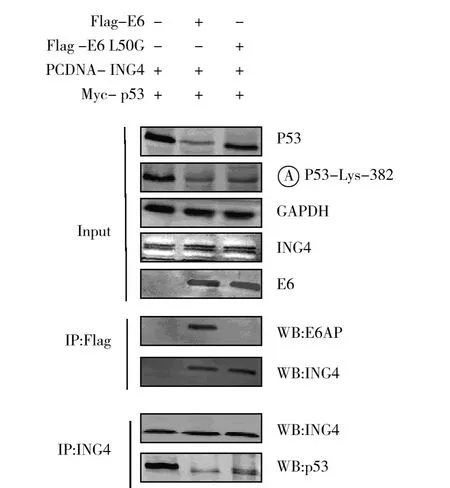
图1 HPV16 E6抑制ING4诱导的p53蛋白乙酰化Fig.1 Human papillomavirus 16 E6 suppresses ING4 Induced p53 acetylation
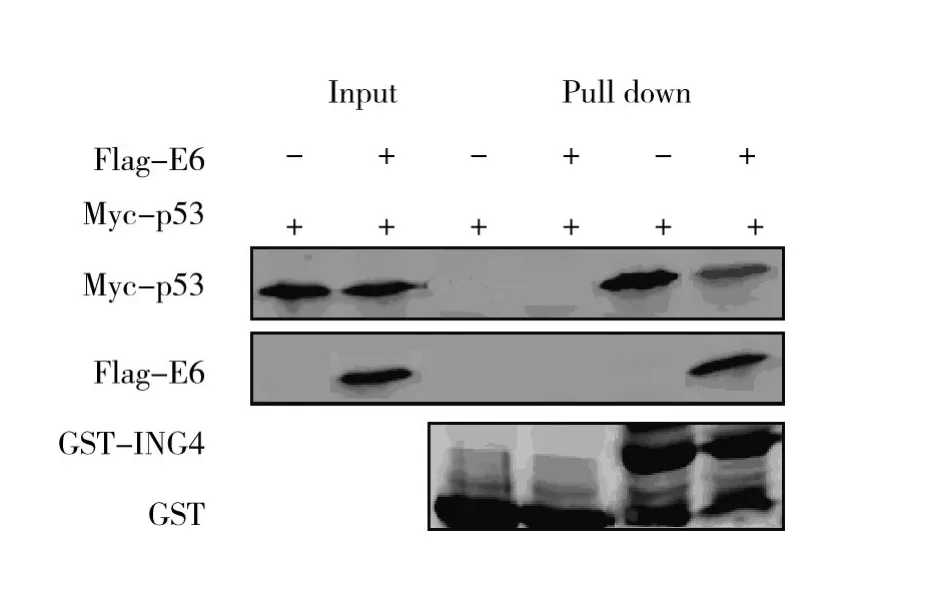
图2 HPV16 E6抑制ING4与p53蛋白的结合Fig.2 HPV16 E6 inhibits ING4 binding with p53

图3 HPV16 E6减弱ING4介导的p53转录活性Fig.3 HPV16 E6 suppresses the ING4 mediated p53 transcriptional activity
2.4 HPV16 E6抑制ING4诱导的p53途径细胞凋亡
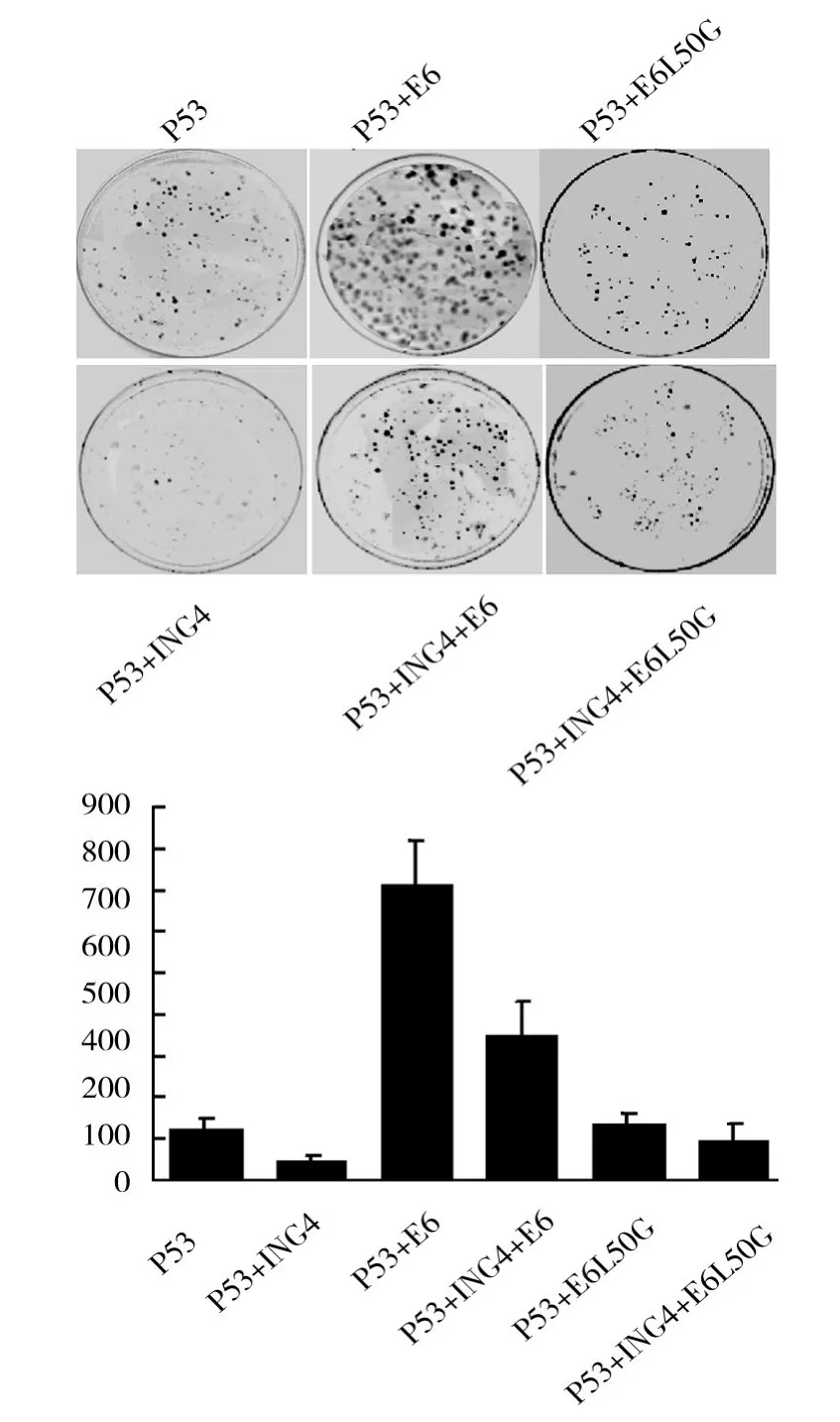
图4 HPV16 E6抑制ING4诱导的p53途径细胞凋亡Fig.4 HPV16 E6 suppresses the ING4 mediated apoptosis by p53 pathway
采用细胞集落形成实验检测了HPV16 E6及其突变体L50G对p53及ING4诱导细胞凋亡的作用。结果表明ING4能加强p53诱导的细胞凋亡,HPV16 E6能抑制细胞凋亡,而HPV16 E6对p53功能的抑制主要表现在ING4存在时(图4)。这些结果证实了HPV16 E6抑制ING4的诱导凋亡功能。
3 讨论
生长抑制因子(ING)家族参与细胞的凋亡、细胞周期变化及DNA的修复。在多种恶性肿瘤中其表达下降,却极少发生突变[8]。ING4,作为ING家族中的一员,与p53结合并调控其转录功能,而人体肿瘤细胞的一个重要遗传特征改变就是p53的肿瘤抑制功能的失活。ING4基因位于12号染色体长臂13区编码由249个氨基酸组成的蛋白,包括高度保守的C端植物同源结构域(PHD)和2个细胞核附着信号区。参与染色体重塑的多种蛋白中含有PHD结构域[9]。ING4通过p53依赖性途径诱导细胞凋亡,其机理包括提高p53基因的甲基化,抑制Mdm2介导的p53基因降解并提高p53下游基因在转录及转录后水平的表达[10]。ING4与组蛋白乙酰转移酶复合物 p300结合而诱导p53蛋白Lys-382的乙酰化[2]。同时ING4还能与p53结合并提高其在Lys382位点的甲基化及转录活性[11]。
HPV16癌蛋白E6是宫颈癌的重要致癌因子。HPV16 E6通过蛋白-蛋白间的相互作用干扰一系列细胞因子的功能而促进细胞恶变。HPV16 E6抑制细胞凋亡的机理之一是破坏p53的功能。E6与E6AP(一种范素化蛋白连接酶)形成复合物作用于肿瘤抑制蛋白p53并通过蛋白酶使之降解[12]。宫颈癌细胞中p53蛋白降解由通过Mdm2途径转变为依靠 HPV16 E6介导途径[13]。由于ING4与HPV16 E6均作用于p53,我们有理由探讨二者之间是否存在相互作用及其生物学意义。
在相关的实验中证实HPV16 E6、ING4及p53三种蛋白形成共同复合物,HPV16 E6减弱ING4与p53蛋白的结合而抑制细胞凋亡[5]。进一步证实了HPV16 E6通过阻碍ING4与p53的结合及其诱导的p53蛋白Lys-382的乙酰化而减弱p53功能;结果表明HPV16 E6抑制 p53下游基因p21WAF1/CIP1的表达及p53介导的凋亡。致癌蛋白HPV16 E6不仅通过直接的p53蛋白降解途径,而且依靠抑制ING4对p53作用而抑制细胞凋亡。作用机理可能因为这3种蛋白之间存在共同的结合区域,因此它们的结合存在竞争关系和抑制关系。p53蛋白C端赖氨酸的乙酰化能增强其DNA结合力、靶基因的选择以及转录的激活[14],抑制ING4诱导的p53蛋白乙酰化可能是HPV及其他肿瘤病毒引起细胞癌变的途径之一。
[1]Zuna RE,Allen RA,Moore WE,et al.Comparison of human papillomavirus genotypes in high-grade squamous intraepithelial lesions and invasive cervical carcinoma:evidence for differences in biologic potential of precursor lesions[J].Mod Pathol,2004,17(11):1314-1322.
[2]Shiseki M,Nagashima M,Pedeux RM,et al.p29ING4 and p28ING5 Bind to p53 and p300,and Enhance p53 Activity[J].Cancer Res,2003,63(10):2373-2378.
[3]Unoki M,K Kumamoto,S Takenoshita,et al.Reviewing the current classification of inhibitor of growth family proteins[J].Cancer Sci,2009,100(7):1173-1179.
[4]Saha A,Bamidele A,Murakami M,et al.EBNA3C Attenuates the Function of p53 through Interaction with Inhibitor of Growth Family Proteins 4 and 5[J].J Virol,2011,85(5):2079-2088.
[5]郭毅,唐艳君,赵楠,等.HPV16 E6通过阻碍ING4与p53的结合抑制子宫颈癌细胞凋亡的实验研究[J].中华妇产科杂志,2012,47(11):861-863.
[6]Zimmermann H,Degenkolbe R,Bernard HU,et al.The humanpapillomavirus type 16 E6 oncoprotein can down-regulate p53 activity by targeting the transcriptional coactivator CBP/p300[J].J Virol,1999,73(8):6209-6219.
[7]Saha A,Bamidele A,Murakami M,et al.EBNA3C Attenuates the Function of p53 through Interaction with Inhibitor of Growth Family Proteins 4 and 5[J].J Virol,2011,85(5):2079-2088.
[8]Li J,Martinka M,Li G.Role of ING4 in human melanoma cell migration,invasion and patient survival[J].Carcinogenesis,2008,29(7):1373-1379.
[9]Doyon Y,Cayrou C,Ullah M,et al.ING tumor suppressor proteins are critical regulators of chromatin acetylation required for genome expression and perpetuation[J].Mol Cell,2006,21(1):51-64.
[10]Russell,M.,P.Berardi,W.Gong,et al.Grow-ING,age-ING and die-ING:ING proteins link cancer,senescence and apoptosis[J].Exp Cell Res,2006,312(7):951-961.
[11]Zhang X,Wang KS,Wang ZQ,et al.Nuclear localization signal of ING4 plays a key role in its binding to p53[J].Biochem Biophys Res Commun,2005,331(4):1032-1038.
[12]Scheffner M,Huibregtse JM,Vierstra RD,et al.The HPV-16 E6 and E6-AP complex functions as a ubiquitin-protein ligase in the ubiquitination of p53[J].Cell,1993,75(3):495-505.
[13]Hengstermann A,Linares LK,Ciechanover A,et al.Complete switch from Mdm2 to human papillomavirus E6-mediated degradation of p53 in cervical cancer cells[J].Proc Natl Acad Sci U S A,2001,98(3):1218-1223.
[14]Tang Y,Zhao W,Chen Y,et al.Acetylation is indispensable for p53 activation[J].Cell,2008,133(4):612-626.

