黑曲霉β-葡萄糖苷酶的酶学特性研究
李晓东,周 明,杨丽娜,夏 伟,王 俊,钱利纯*
(1.安徽农业大学动物科技学院,安徽 合肥 230036;2.浙江大学 动物科学学院,浙江 杭州 310058)
β-葡萄糖苷酶(EC 3.2.1.2;beta-glucosidase)属于水解酶类,是纤维素酶系中的一种,能水解芳基或烃基与糖基原子团之间的糖苷键生成葡萄糖。Liebig等(1837)首次在苦杏仁中发现了β-葡萄糖苷酶,其后发现β-葡萄糖苷酶广泛存在于自然界许多植物中。Bongon[1]、Masaru 等[2]、Elias等[3]、汪大受[4]分别从苦杏仁、葡萄、大豆、玉米、黑樱桃、水稻和大豆中分离纯化了β-葡萄糖苷酶。微生物β-葡萄糖苷酶的研究主要集中在酵母、细菌、真菌等微生物[5]。微生物中以木霉和黑曲霉的产量为最高,植物来源的β-葡萄糖苷酶活性一般比微生物来源的酶活力要低[6]。现有资料表明,不同来源的β-葡萄糖苷酶酶学特性不同,存在着较大差异,叶海梅等[7]发现米曲霉FZ58的β-葡萄糖苷酶的最适作用温度为60℃,最适作用pH 为5.0;朱凤妹等[8]、宋成程等[9]认为,黑曲霉β-葡萄糖苷酶最适作用温度为55℃,最适作用pH 为5.0;而孟宪文等[10]研究发现乳酸菌 β-葡萄糖苷酶最适作用温度和pH为40℃和6.0。β-葡萄糖苷酶在饲料工业中可作为饲料添加剂,用于分解饲料中的结合型大豆异黄酮,提高畜禽的生产性能。经β-葡萄糖苷酶水解,将不具活性的大豆异黄酮糖苷转化为活性苷元才能被吸收,进而在体内发挥作用。由于大豆自身含有的内源性β-葡萄糖苷酶水解活性不强(水解效率只有22%~29%),添加足量的高活性酶(如苦杏仁和酵母中提取β-葡萄糖苷酶)可使水解达到100%[11]。据Y H Pyo等研究发现,豆奶中添加β-葡萄糖苷酶或接种产β-葡萄糖苷酶的微生物,都能够将豆奶及粉豆奶中生物有效性较低的异黄酮糖苷高效转化为高活性的异黄酮苷元[12]。畜禽肠道不同部位的pH存在差异,影响β-葡萄糖苷酶的活性;同时,饲料加工过程中的高温处理也影响酶的活性。因此,研究黑曲霉β-葡萄糖苷酶的酶学特性有助于酶的推广应用,为生产适合养殖业要求的β-葡萄糖苷酶提供理论依据。
1 材料与方法
1.1 材料
β-葡萄糖苷酶 通过黑曲霉zju2发酵制得。
1.2 方法
1.2.1 粗酶液的提取及活性测定 准确称取200 g发酵干曲,溶于1000 mL pH 5.0的缓冲溶液,摇床振荡4~6 h,用4层纱布过滤。将浸出物在4℃、5000 r/min离心5 min,弃固体杂质,得到的上清液即为粗酶液。对粗酶液的酶活和蛋白质含量进行测定。
1.2.2 硫酸铵分级沉淀 准确量取粗酶液的体积后,将其置于盛有冰水混合物的磁力搅拌器中,缓慢加入4℃预冷的(NH4)2SO4,使饱和度达到30%,即每100 mL粗酶液中添加固体(NH4)2SO416.4 g,30 min内加完后,置于4℃过夜,使之完全沉淀。10000×g离心10 min,分离上清液和沉淀,并分别测定上清液和沉淀物中酶活及蛋白质含量。准确量取30%(NH4)2SO4沉淀后的上清液体积,将其置于盛有冰水混合物的磁力搅拌器中,缓慢加入4℃预冷的(NH4)2SO4,使饱和度达到60%,即每100 mL粗酶液中再添加固体(NH4)2SO418.1 g,30 min内加完后,置于4℃过夜使之完全沉淀。10000×g离心10 min,分离上清液和沉淀,并分别测定上清液和沉淀物中酶活及蛋白质含量。
1.2.3 Sephadex G-25脱盐 G-25的粒度为100~200 目之间,滞留水量为(2.5 ±0.25)mL,膨胀体积为4~6 mL。根据凝胶柱的体积,确定G-25的用量。用0.5 mmol/L pH 5.0磷酸缓冲液与G-25混合,凝胶混合液放于4℃过夜,使凝胶颗粒充分吸水。将处理好的凝胶上柱,用磷酸缓冲液平衡12 h,60%硫酸铵沉淀的酶蛋白质溶解在最适pH的磷酸缓冲液中,加样后,调节凝胶柱的流速。用考马斯亮蓝检测到有蛋白洗脱出时,开始收集洗脱液,选择比活力高的收集液,进行透析浓缩。将比活高的酶蛋白收集液放入透析袋(分子截流量14000)中,扎紧透析袋两端,放入平皿中,用蔗糖填充平皿,4℃放置过夜,使酶蛋白液充分浓缩。浓缩后酶蛋白用葡聚糖G-100凝胶层析。
1.2.4 Sephadex G-100凝胶层析 Sephadex G-100凝胶层析其他操作同1.2.3,浓缩后酶蛋白用于酶学特性研究和蛋白凝胶电泳测分子量。
1.2.5 蛋白凝胶电泳法测定分子量 SDS-PAGE测定蛋白质分子量,以5%浓缩胶10%分离胶,90 V恒压电泳3 h,考马斯亮蓝R250充分染色,用ImageMaster VDS成像系统扫描,得到蛋白图谱。
1.2.6 酶的最适反应温度 在试管中加入1.2 mL 0.1 mol/L pH 5.0 的柠檬酸缓冲溶液,0.4 mL 8 mmol/L的p-NPG;然后加入酶液0.4 mL,在30~70℃水浴条件下反应30 min后,加入2 mL 0.5 mol/L的碳酸钠,在400 nm处测定吸光值。以温度为横坐标,OD值为纵坐标,分析酶活随温度的变化曲线。温度范围设定为30~85℃,梯度为5℃,共计12个温度点。
1.2.7 酶的最适反应 pH 配制0.2 mol/L,pH 3.0~7.0的系列磷酸氢二钠-柠檬酸缓冲液,利用这些缓冲溶液配制一系列底物,在最适温度(70℃)下反应30 min,其他操作同 1.2.6,测 OD 值。
1.2.8 酶的热稳定性 酶液在30~90℃水浴中分别保温5、15、30、60 min,立即置于冰浴中,在最适反应 pH 4.5 下,其它操作同1.2.6,测 OD 值。
1.2.9 酶的pH稳定性 酶液分别在pH 3.0~9.0的缓冲液中,在最适温度70℃的水浴锅中放置0、5、20、40、60 min,其他操作同1.2.6,测 OD 值。
1.2.10 米氏常数测定 配制浓度分别为1000、2000、3000、4000、5000、6000 μmol/L 的底物,在pH 4、70℃的条件下加入酶液反应30 min,测定OD值,根据对硝基苯酚含量与OD值的标准曲线,计算反应速度,采用双倒数作图法,求出Km和Vmax。
2 结果与分析
2.1 酶的提取纯化及其分子量
2.1.1 粗提酶液活性 由表1可知,粗提酶液中含有7.26 U/mL的活性,活性较高,适合进行进一步的纯化提取。

表1 粗提酶液活性Table 1 The activity of extract enzyme liquid
2.1.2 硫酸铵分级沉淀后酶活性 由表2可知,经30%硫酸铵沉淀后,上清液和沉淀物中的酶活基本相近,没有达到分离纯化的目的,再经60%硫酸铵沉淀后,沉淀物中酶蛋白含量较多,活性较高,适合用于G-25的脱盐。

表2 硫酸铵分级沉淀后酶活性Table 2 The activity of ammonium sulfate grade sedimentation
2.1.3 硫酸铵盐沉淀后β-葡萄糖苷酶脱盐 对收集的洗脱液进行蛋白含量和活力测定,绘制曲线图(图1)。由图1可知,从第5管开始,收集的洗脱液酶活性和蛋白含量较高,到13管以后,酶活和蛋白含量急剧下降。因此,取5~13管进行洗脱液透析浓缩效果最好。
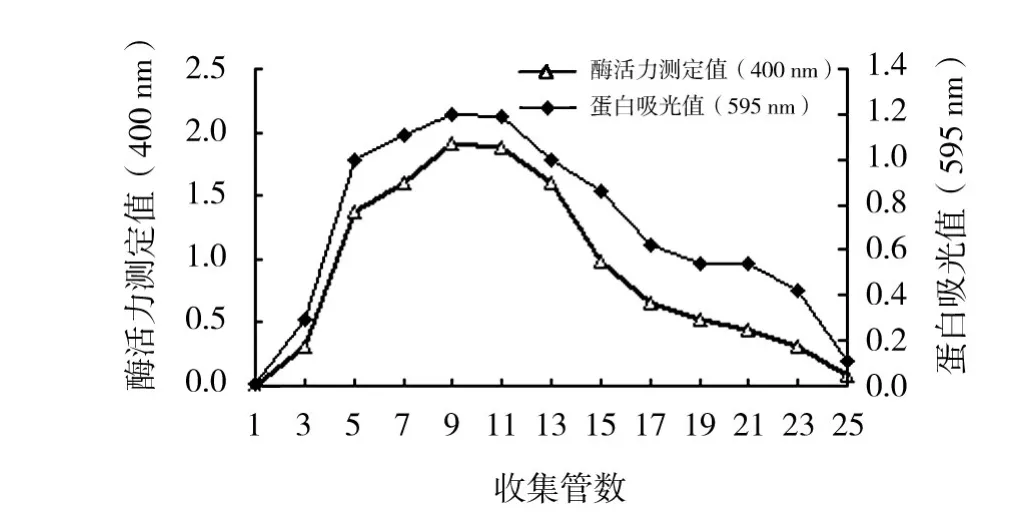
图1 β-葡萄糖苷酶脱盐曲线Fig.1 The curve of enzyme desaliniztion by Sephadex G-25
2.1.4 β-葡萄糖苷酶纯化 采用Sephadex G-100进行纯化,由图2可以看出,从5~11管之间收集的洗脱液酶活性和蛋白含量较高,收集第11管的酶液进行透析浓缩,用于电泳分析。

图2 β-葡萄糖苷酶分离纯化曲线Fig.2 The curve of purification of enzyme by Sephadex G-100
2.1.5 SDS-PAGE凝胶电泳 β-葡萄糖苷酶的SDS-PAGE结果(图3)表明,与标准蛋白相比,在66.2 ku附近有1条明显的特异性蛋白质条带。通过分析标准分子量蛋白质的分子量对数(log M)和相对迁移率(μR)之间的关系(图4),建立回归方程,通过测定和计算β-葡萄糖苷酶条带的相对迁移率(μR),代入回归方程,计算出β-葡萄糖苷酶的分子量为65.20 ku。

图3 纯化产物的SDS-PAGE分析Fig.3 SDS-PAGE analysis of the product from wild-type
2.2 β-葡萄糖苷酶的酶学特性
2.2.1 酶的最适反应温度 研究表明 (图5),黑曲霉β-葡萄糖苷酶的最适反应温度为70℃;高于70℃,酶活性急剧下降,75和80℃时的酶活性仅为最适反应温度时的54.18%和10.74%,85℃以上,β-葡萄糖苷酶完全失去活性;35和40℃ (接近动物消化道温度)时的酶活性分别为最适反应温度的27.09%和30.67%;在30~70℃之间,随温度的提高,酶活接近直线上升。由此可知,在动物消化道中,黑曲霉β-葡萄糖苷酶并不能完全发挥酶解的作用,体外酶解以70℃为最佳温度。
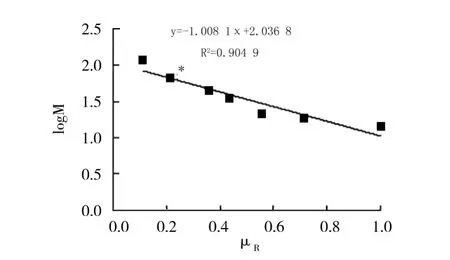
图4 标准分子量蛋白质在相同电泳条件下的分子量对数(logM)和相对迁移率(μR)之间的关系Fig.4 Relationship between logarithm(logM)of standard protein molecular weight and the relative front(μR)
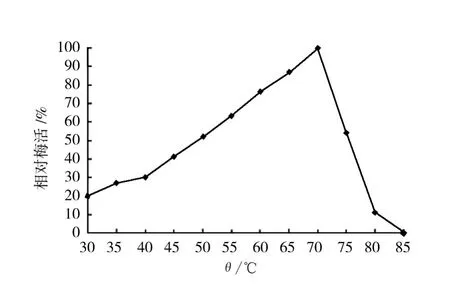
图5 温度对β-葡萄糖苷酶活性的影响Fig.5 Effects of temperatures on β-glucosidase activity
2.2.2 酶的最适反应pH 研究表明(图6),黑曲霉β-葡萄糖苷酶的最适反应pH为4.5~5.0,pH 4.5时酶活性最高;pH低于4.5和高于5.0时,酶活性都急剧下降,pH 4.0和5.5时的酶活性为最适反应 pH 4.5时活性的 27.84%和56.39%,pH高于7.0时β-葡萄糖苷酶完全失去活性,pH低于3.0也几乎失去活性;动物胃液中pH一般较低,β-葡萄糖苷酶活性较低,肠道中pH在4.0~6.0之间,β-葡萄糖苷酶能发挥酶解作用。
2.2.3 酶的热稳定性 β-葡萄糖苷酶在30、40、50、60、70、80和90 ℃条件下分别处理 0 ~60 min发现(图7),处理5 min后活性都不同程度下降,在5 min 时,30、40、50、60 和70 ℃酶活差异不大,但80和90℃条件下酶活很低,90℃时酶已经基本灭活,说明80℃以上高温对酶活性影响很大,短时间就可以使酶失去活性;在30、40、50和60℃条件下,处理15 min后,酶活有所升高,60℃条件下活性最高,70℃条件下酶活比5 min时有所下降,只有60℃条件下酶活的52.55%,80和90℃条件下15 min酶已完全失活;处理30 min后,40、50和60℃条件下酶活有所下降,而30和70℃条件下酶活基本保持15 min时的水平;处理60 min后,30、60和70℃条件下酶活下降,40和50℃条件下反而有所提高,可能与酶的特性有一定关系;由此可见,β-葡萄糖苷酶在40、50和60℃下稳定性较好,而80℃以上不稳定。由于饲料在制粒过程中需高温(80℃左右)处理时间90 s左右,因此可以推测,黑曲霉的β-葡萄糖苷酶在制粒过程中损失可能较大。

图6 pH对β-葡萄糖苷酶活性的影响Fig.6 Effects of pHs on β-glucosidase activity
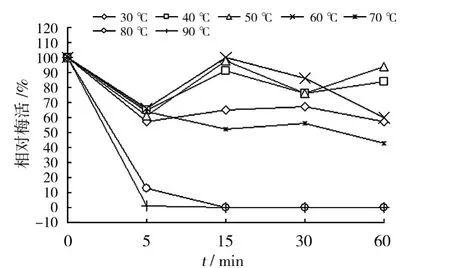
图7 β-葡萄糖苷酶的热稳定性Fig.7 The thermal stability of β-glucosidase
2.2.4 酶的pH稳定性 在最适反应温度70℃条件下,研究不同pH对β-葡萄糖苷酶活性的影响。研究表明(图8),不同pH条件下处理5 min后,酶活都不同程度降低,除pH 9.0缓冲液中酶全部失活外,pH 5.0 酶活性最高,pH 8.0 最低,是最高酶活的50.35%;保温20 min后,pH分别为3.0和9.0的缓冲液中的酶活基本都失活,而pH为 4.0、5.0、6.0、7.0 和 8.0 的缓冲液中的酶活则相反,都维持较高的酶活,分别是5 min时酶活的91.92%、101.96%、113.16%、112.30% 和101.33%;保温40 和 60 min,pH 分别为3.0、7.0、8.0、9.0 的缓冲液中的酶完全失活,而 pH 为 4.0、5.0、6.0的缓冲液中的酶活在保温40 min还维持较高的活性,分别是5 min时酶活的90.70%、95.37%和94.47%,在保温60 min 后,pH 为4.0、5.0、6.0的缓冲液中的酶活有所下降,分别是5 min 时酶活的 80.49%、95.51%和 78.77%。

图8 β-葡萄糖苷酶的pH稳定性Fig.8 The pH stability of β-glucosidase
结果表明,β-葡萄糖苷酶在pH分别为3.0、7.0、8.0、9.0 缓冲液中的稳定性很差,很容易失活,40 min 基本无活性,在 pH 为 4.0、5.0、6.0 的缓冲液中稳定性较好,最低也可维持78.77%的活性,其中在pH为5.0时稳定性最好,保温60 min,酶基本不失活。由于动物的胃中pH较低,一般在3.0左右,β-葡萄糖苷酶基本不发挥降解作用,肠道中 pH 在4.0 ~7.0 之间,β-葡萄糖苷酶能够起酶解效用,由此可知,动物小肠是酶起作用的主要部位。
2.2.5 酶的米氏常数 由图9可知,β-葡萄糖苷酶的 Km=41.67 mmol/L,Vmax=23.81 U/L。

图9 β-葡萄糖苷酶米氏常数双倒数作图法Fig.9 The Lineweaver-Burk(double-reciprocal)plot of β-glucosidase
3 讨论
不同来源的β-葡萄糖苷酶酶学特性不同,特别是最适反应温度存在着较大的差异。本研究表明,黑曲霉zju2产β-葡萄糖苷酶分子量为65.20 ku,最适反应 pH 为 4.5 ~5.0,能够适应肠道中4.0~7.0之间的pH环境,能够充分发挥较好的酶解作用。其最适反应温度为70℃,显著高于文献资料的参考温度,具备有较好的热稳定性能,在30~70℃之间,随温度的提高,酶活直线上升,温度高于70℃时,酶活性急剧下降,85℃时基本失活,该酶耐热性能有待提高。由于饲料在制粒过程中温度较高,因此可以推测,黑曲霉zju2产β-葡萄糖苷酶在制粒过程中损失较大,应用于饲料工业还需要进一步改良。
[1]Bongon JR.β-glucosidase from normal and brittle-stemmut and rice cultivars(Oryzasatival),isolation,purification an characterization[J].College Laguna,Philippines,1994.
[2]Masaru M,Sasaki J,Murao S.Studies on β-glucosidase from soybeans that hydrolyze daidzin and genistin,isolation and characterization of an Isozyme[J].Bioscience Biotechnology Biochemistry,1995,59:1623-1627.
[3]Elias M,Nambisan B,Sudhakaran PR.Characterization of latex and its location in petioles in cassava[J].Archiv.Biochem.Biophysic.,1997,341:222-228.
[4]汪大受.康氏木霉纤维素酶系中β-葡萄糖苷酶的提纯与性质[J].生物化学与生物物理学报,1980,12:193-197.
[5]吴小刚,曾莹,周丽明.β-葡萄糖苷酶高产菌的筛选[J].中国酿造,2005,150(9):14-16.
[6]闫会平,陈士华,吴兴泉.黑曲霉β-葡萄糖苷酶的研究进展[J].纤维素科学与技术,2007,15:59-63.
[7]叶海梅,郑毅,石磊.米曲霉FZ58固体发酵β-葡萄糖苷酶条件优化及酶学特性研究[J].福建轻纺,2008,224(1):1-6.
[8]朱凤妹,李军,杜彬,等.黑曲霉产β-葡萄糖苷酶发酵培养基的优化研究[J].酿酒科技,2008,3:43-46.
[9]宋成程,赵雪淞,杜秀丽,等.毁灭柱孢菌中一种人参皂苷Rb1水解酶的纯化及酶学性质研究[J].微生物学杂志,2011,31(5):20-26.
[10]孟宪文,李长彪,刘长江.乳酸菌β-葡萄糖苷酶的分离纯化及特性研究[J].食品科学,2006,27(11):116-119.
[11]Pandiatan N,Hettiarachchy N,Ju ZY,et al.Enrichment of genistein in soy protein concentrate with β-glucosidase[J].Food Chemsty and Toxicology,2000,65(3):403-407.
[12]Yang JH,Ren DM.Selection of High-yield β-glucosidase Strain and the Optimized of Solid State Fermentation[J].Journal of Anhui Agricultural Sciences,2005,33(8):1566-1568.

