微生物在玉米秸秆还田中的作用研究与分析
李 莉
(辽宁省微生物科学研究院,辽宁 朝阳 122000)
我国的农作物种植总量居世界首位,随着农业的快速发展,各类农作物产量连年创历史新高,同时也产生了大量的秸秆,由于富裕的农民也用上了更加清洁方便的能源而舍弃了作为薪柴的秸秆,使秸秆的消耗量连年下降,导致了大量剩余秸秆产生。据统计,2010年中国的秸秆总量超过9亿吨,居世界首位,其中玉米秸秆2.5亿吨。
秸秆还田是当今世界普遍重视的一项培肥地力的增产措施,即杜绝了秸秆所造成的大气污染,实现了CO2的减量排放,又减少了秸秆资源的浪费,从根本上解决了长期施用化肥导致的土壤生态恶化,农产品质量下降等问题,实现了低碳农业和循环农业[1]。据测定,1000~1500 kg鲜玉米秸秆含纯氮 3.65 kg,五氧化二磷 1.85 kg,玉米秸秆内含氮量为0.6%,含磷量为0.2%,含钾量为2.28%,有机质含量达到3.4%左右,1250 kg鲜玉米秸秆相当于4000 kg土杂肥的有机质含量,氮、磷、钾含量相当于18.75 kg碳铵、10 kg过磷酸钙和7.65 kg 硫酸钾[2-3]。
近年来,随着设施农业的发展,人们更多地使用秸秆还田技术。由于秸秆还田基本上是将秸秆就地还田,秸秆分解不完全,影响下一年的种植。如何促进秸秆的快速分解,不影响下茬作物种植及秸秆还田的推广,是农业生产中亟待解决的一个重大问题。
辽宁省微生物科学研究院国家农业开发项目“利用微生物腐熟技术改善设施蔬菜试验与示范”项目组,经过8年时间,研究了玉米秸秆快速腐熟技术和微生物秸秆腐熟剂,特别是通过微生物秸秆腐熟剂的作用,使秸秆能够在一个作物生长季腐解率达到90%以上。近年来,在日光温室和大田中推广使用了该项技术,推动了秸秆的资源化利用,对提高农产品产量和改善农产品的质量,保障农业可持续发展起到了重要作用。本文对微生物在玉米秸秆还田中的作用研究进行了论述,内容主要包括玉米秸秆直接还田快速腐熟技术、秸秆腐熟剂及在秸秆腐解中的作用研究与分析。
1 玉米秸秆中木质纤维素的基本结构与组成
玉米秸秆主要由C、H、O等元素组成有机物,其中又以3种高分子聚合物为主,分别是纤维素、半纤维素、木质素[4],还含有少量的单宁、果胶质,表面还覆盖有一定量的蜡质成分。纤维素、半纤维素和木质素在细胞壁中相互交织共同形成致密的结构,任何一类成分的降解必然受到其他成分的制约。玉米秸秆中的主要成分是纤维素,占木质纤维素的43%,纤维素分子是由β-D-葡萄糖通过β-1,4-糖苷键(由半缩醛羟基和C4上的醇羟基之间缩水形成糖苷键)结合而成的线性高分子化合物,链两端组成不同,一个是还原端,一个是非还原端[5],纤维素的结构还分为结晶区和非结晶区两部分,只有在非结晶区才有部分游离羟基存在[6],因此,纤维素的非结晶部分比结晶部分容易水解,经水解可以得到葡萄糖,理论上1 kg纤维素水解可以得到1.1 kg葡萄糖。半纤维素在玉米秸秆中占27%,其成分比纤维素复杂一些,主要是由几种不同类型的单糖(五碳糖和六碳糖)构成的异质高聚体,其聚合度比较低,所含糖单元约为60~200个。基本是以非共价键方式与纤维素连接的多聚糖,半纤维素与纤维素分子链的主要区别在于:一是由外结晶状杂多糖组成,二是分子链较短,三是高度分支,四是主链为一种糖单元[5]。木质素在玉米秸秆中占20%,木质素的直接前体是来自对羟基苯丙烯酸的三种醇(木质醇)—松柏醇、芥子醇及香豆醇,木质素的化学结构复杂,许多植物的木质素结构仍不完全清楚。
2 降解木质纤维素的微生物与酶类
微生物降解纤维素是先产生纤维素酶,再利用纤维素酶把纤维素水解成葡萄糖。半纤维素的主要成分是木聚糖,一些细菌和好氧丝状真菌都能分泌不同的木聚糖酶,用于水解木聚糖,但是木质素不含有易水解的重复单元,而且还抵抗酶的水解作用,是目前公认的微生物难降解的芳香族化合物之一。木质素的分解是一个氧化过程,需要多种酶的协同作用,需要由多种诱导酶所组成的复杂酶系,主要包括过氧化物酶、锰过氧化物酶和漆酶。
3 玉米秸秆还田快速腐熟技术与秸秆腐熟剂研究
3.1 玉米秸秆还田快速腐熟技术
玉米秸秆直接还田快速腐熟技术主要是利用微生物分解秸秆中的纤维素、半纤维素、木质素,使其降解为葡萄糖、短链脂肪酸、氨基酸和CO2供农作物生长利用[7]。将秸秆整秆埋入250 mm以下的土壤中,通过加入微生物腐熟剂,使秸秆中的木质纤维素在作物的一个生长季转化为生长所需要的CO2、热量和有机无机养料,可使温室内的CO2浓度提高4~6倍,1 kg秸秆还释放出3037千卡的热量,地温提高2~3℃,有机质含量提高0.1% ~0.23%。大田的玉米秸秆直接还田快速腐熟技术与温室的玉米秸秆直接还田快速腐熟技术相同。
3.2 微生物玉米秸秆腐熟剂
微生物是土壤最活跃的组成,在维持生态系统整体服务功能方面发挥着重要的作用[8-9],常被比拟为土壤碳、氮、磷等养分元素循环的“转化器”,环境污染的“净化器”,陆地生态系统稳定的“调节器”[10],土壤微生物学的研究对象也从单个的功能基因拓展到系统的宏基因组和转录组,从单一的菌种资源发展到整体的微生物群落[11-12]。辽宁省微生物科学研究院在定量描述土壤微生物过程、定向调控土壤微生物的功能方面进行了探索,分析了在微生物菌群作用下木质纤维素的降解过程,利用实时荧光定量PCR技术,探讨了秸秆还田后土壤中硝化细菌、自生固氮菌和纤维素分解菌数量的变化规律,在此基础上利用秸秆生物降解技术研制出了秸秆腐熟剂[13-14]。实现秸秆还田,必须加速秸秆腐熟,由于秸秆中含有约90%的木质纤维素,加速木质纤维素转化便成为秸秆快速腐熟的关键。因此研究以秸秆还田定向快速腐熟关键技术为主,通过高效腐解秸秆微生物菌种筛选及复合微生物菌群构建关键技术研究[15-16]、秸秆腐熟剂生产关键技术研究,形成了具有自主知识产权的有机物料腐熟剂产品。
辽宁省微生物科学研究院研究的玉米秸秆腐熟剂属于好氧型有机物料腐熟剂,因此,在使用过程中必须通过打孔来保障通气,满足微生物对氧气的需求及释放出CO2。为了更好地发挥腐熟剂的作用,配套研究了菌种活化剂,菌种活化剂是一种可以迅速为微生物提供营养,促进微生物快速启动、繁殖、生长的以碳源为主的一类营养物质。活化剂提高了腐熟剂在土壤中的定殖能力和秸秆的腐解速度,简化了腐熟剂的使用方法,降低了腐熟剂的使用成本,只需与活化剂按比例混合,再加入一定比例的水,放置2 h后就可以使用,大田上使用只须与腐熟剂混合后撒入秸秆上即可。
4 秸秆腐熟剂在秸秆腐解中的作用研究
4.1 微生物秸秆腐熟剂定殖能力研究
在秸秆腐熟剂的研究过程中,微生物菌群在秸秆上的定殖能力研究非常重要,添加到秸秆中的微生物由于受土壤抑菌作用的影响而不能萌发,或处于休眠状态,降低了微生物在秸秆腐解过程中的生长和繁殖能力,因此,在菌种选育的时侯就应考虑其定殖能力的问题[17-19]。不同菌种在培养皿的无菌土中定殖能力测试结果见表1,不同菌种在埋入秸秆+腐熟剂的田间的定殖能力测试结果见表2。从表1看出,6种菌在30 d左右达到最大活菌数,到150 d时最低定殖率为0.01%,最高定殖率为26.4%。表1、表2结果表明,上述6个菌种在对照区均未检测到,说明在处理区检测到的上述菌种都是后施入的菌种在秸秆上繁殖的结果,而不同的微生物菌种在土壤中的定殖能力是不同的。
4.2 秸秆腐熟剂在温室土壤中对玉米秸秆腐解率研究
腐解率即微生物对秸秆中木质纤维素的分解能力,进行了秸秆腐熟剂+菌种活化剂对土壤内秸秆腐解率的研究。不同处理区土壤中真菌、细菌总数变化情况见表3,采样时间为秸秆腐熟剂埋入土壤第7天。由表3可知,腐熟剂+秸秆处理区活菌数在10月31日达到最高,基质区活菌数最高峰出现在11月23日,比处理区晚20 d左右;对照区活菌数高峰出现日期与基质区相同。进行了秸秆腐熟剂+菌种活化剂对土壤内秸秆分解程度的研究,结果见表4。从表4可以看出,加腐熟剂的秸秆腐烂快、腐解率明显比不加腐熟剂的秸秆高,残余少,说明秸秆腐熟剂能明显促进秸秆分解转化。
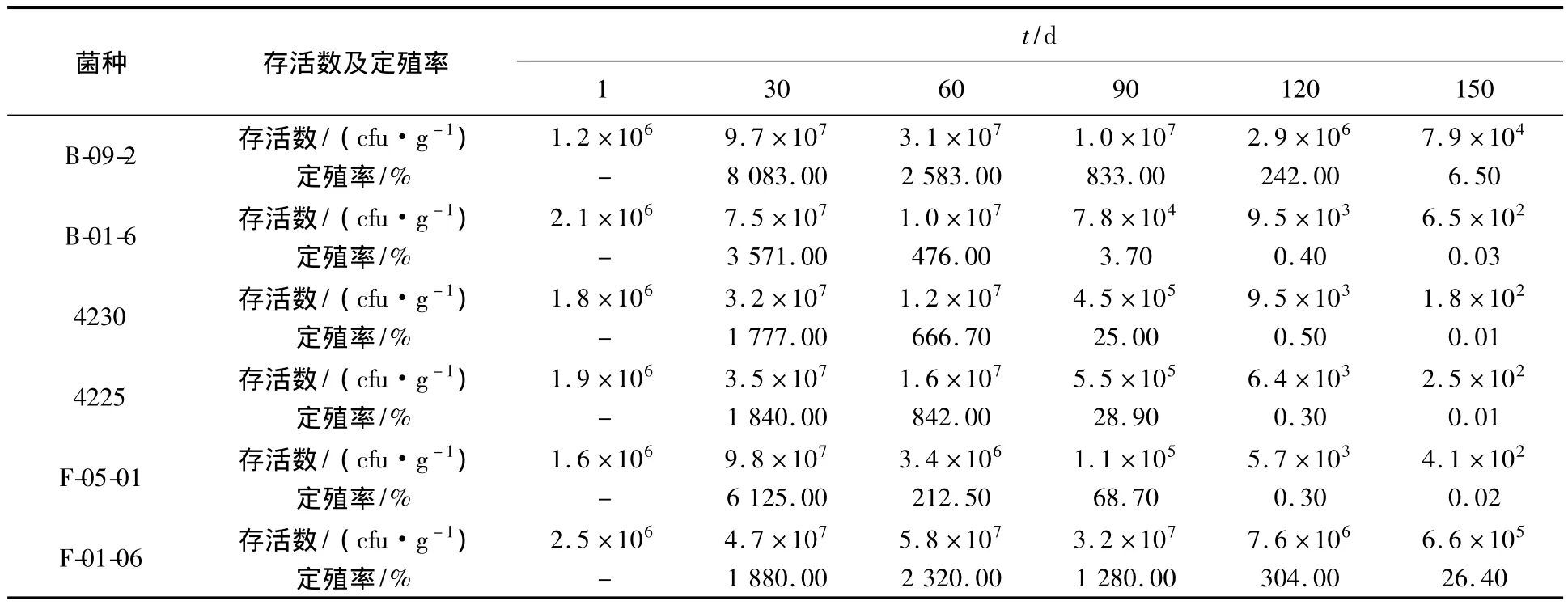
表1 不同菌种在无菌土中定殖能力测试Table 1 The test for different strains in the sterile soil colonization ability

表2 不同菌种在田间定殖能力测试Table 2 The test for different strains in the field soil colonization ability
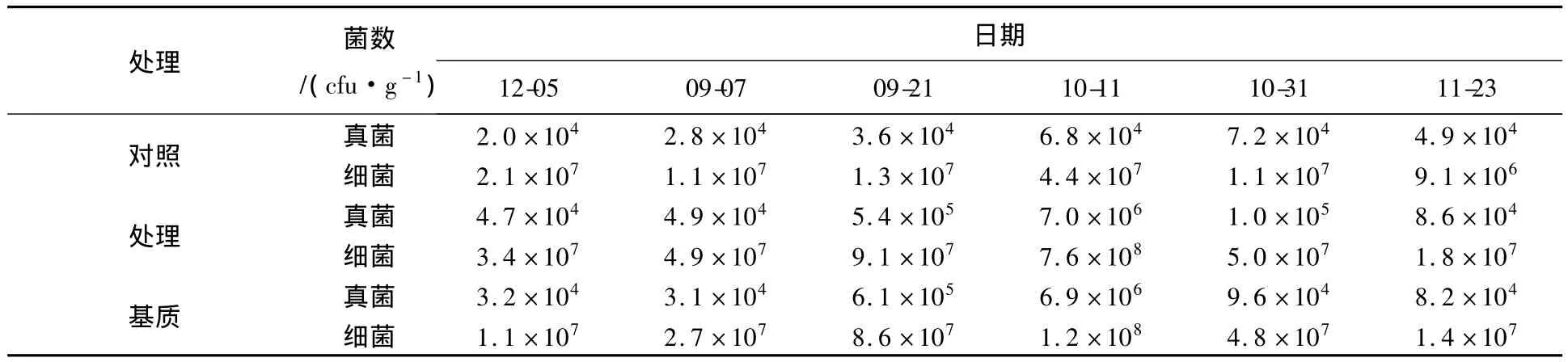
表3 不同处理区土壤中真菌、细菌总数变化(2011年)Table 3 The changes of fungi and bacteria in the different treated soil(2011)

表4 栽培结束时秸秆的腐解率(%)(黄瓜,2010-10~2011-06)Table 4 The straw decomposition rate at the end of the cultivation(%)(Cucumber,2010-10 ~2011-06)
不同处理区纤维素酶活性变化情况见表5。数据表明,处理区秸秆中纤维素酶活始终比基质区高,并且差异明显;土壤中的纤维素酶活性在各区中差异不大,多数时间段处理区的酶活性比基质区和对照区高,在开始阶段和结束阶段,基质区的纤维素酶活略高于处理区。不同处理区土壤中和秸秆中酶活性高峰都出现在10月11~31日左右,基质区酶活性高峰出现的略晚,2个区的酶活性高峰与活菌数高峰期相吻合。

表5 不同处理区土壤及秸秆中纤维素酶活性变化(2011年)(U/g)Table 5 The changes of cellulase activity for soil and straw in different processing zone(2011)(U/g)

表6 不同处理区土壤及秸秆中半纤维素酶活性变化(2011年)(U/g)Table 6 The changes of hemicellulase activity for soil and straw in different processing zone(2011)(U/g)
表6数据表明,秸秆中的半纤维素酶含量明显比土壤中的活性高,高1倍左右。各区的酶活高峰基本在10月31日左右,这段时间也是活菌数最高的时间,酶活性变化趋势与活菌数变化趋势基本一致。大部分时间,秸秆中处理区的半纤维素酶活性高于基质区,只是在最后一次的测试结果低于基质区。土壤中的半纤维素酶活性则大多数时间是处理区高于基质区,差异不是很明显。与对照区相比,处理区、基质区土壤中的半纤维素酶活并不高,说明秸秆在分解过程中半纤维素酶向上运输能力差,并且秸秆分解过程中,对上层土壤半纤维素酶活影响不大。
辽宁省微生物科学研究院在朝阳市龙城区榆树林村测试结果(2011年7~12月,作物为豆角,秸秆使用量为500 kg/亩)见图1。测试结果表明,随着秸秆埋入时间增加,土壤中2种酶的活性不断增加,并且在75 d左右达到最高,以后又逐渐下降,栽培结束时比栽培前土壤中2种酶的活性略高。土壤中2种酶的活性主要受土壤中活菌数的限制,与土壤中活菌数的多少呈正相关。

图1 秸秆还田对土壤纤维素酶、半纤维素酶活性的影响Fig.1 The effect of the straw bio-degradation on the soil enzyme activity of the cellulose and hemicellulase
4.3 秸秆腐熟剂对土壤中微生物种群数量及土壤酶活性的影响
秸秆还田技术使用3年后土壤中微生物菌群及酶活性变化情况见表7。①细菌:处理区和基质区的可培养细菌数量变化趋势相同,都是先上升后下降趋势,高峰期都出现在120 d左右;处理区可培养细菌数量始终高于基质区,作物生长期结束时,可培养细菌数量基本相同。②真菌:处理区可培养真菌数量在90 d左右达到最高,在90~150 d时,可培养真菌数量稳定在107cfu/g左右,到150 d后,开始缓慢下降;基质区可培养真菌数量在120 d左右时达到最高点,并且在120~170 d时为107cfu/g左右,然后快速下降到104cfu/g左右;处理区可培养真菌高峰期比基质区高峰期早30 d左右。对照区可培养真菌数量变化趋势与基质区相同,但是基质区可培养真菌数量比对照区高100倍左右。③总菌数:对照区、基质区、处理区的总菌数的变化趋势相同,都是在120 d左右时达到最高,并且在120~170 d时稳定,170 d后下降,基质区和处理区的总菌数在高位时,比对照高1万倍。④纤维素酶活:处理区纤维素酶活在90 d时达到最高582 U/g,然后开始缓慢下降,到150 d时,降低到25 U/g;基质区的纤维素酶活在120 d左右时达到最高425 U/g,然后开始下降,到150 d时,降低到21 U/g。⑤木聚糖酶活:在45 d时检测到木聚糖酶活性,达到最高点以后逐渐下降,处理区酶活明显比基质区酶活高,对照未检测到木聚糖酶活。
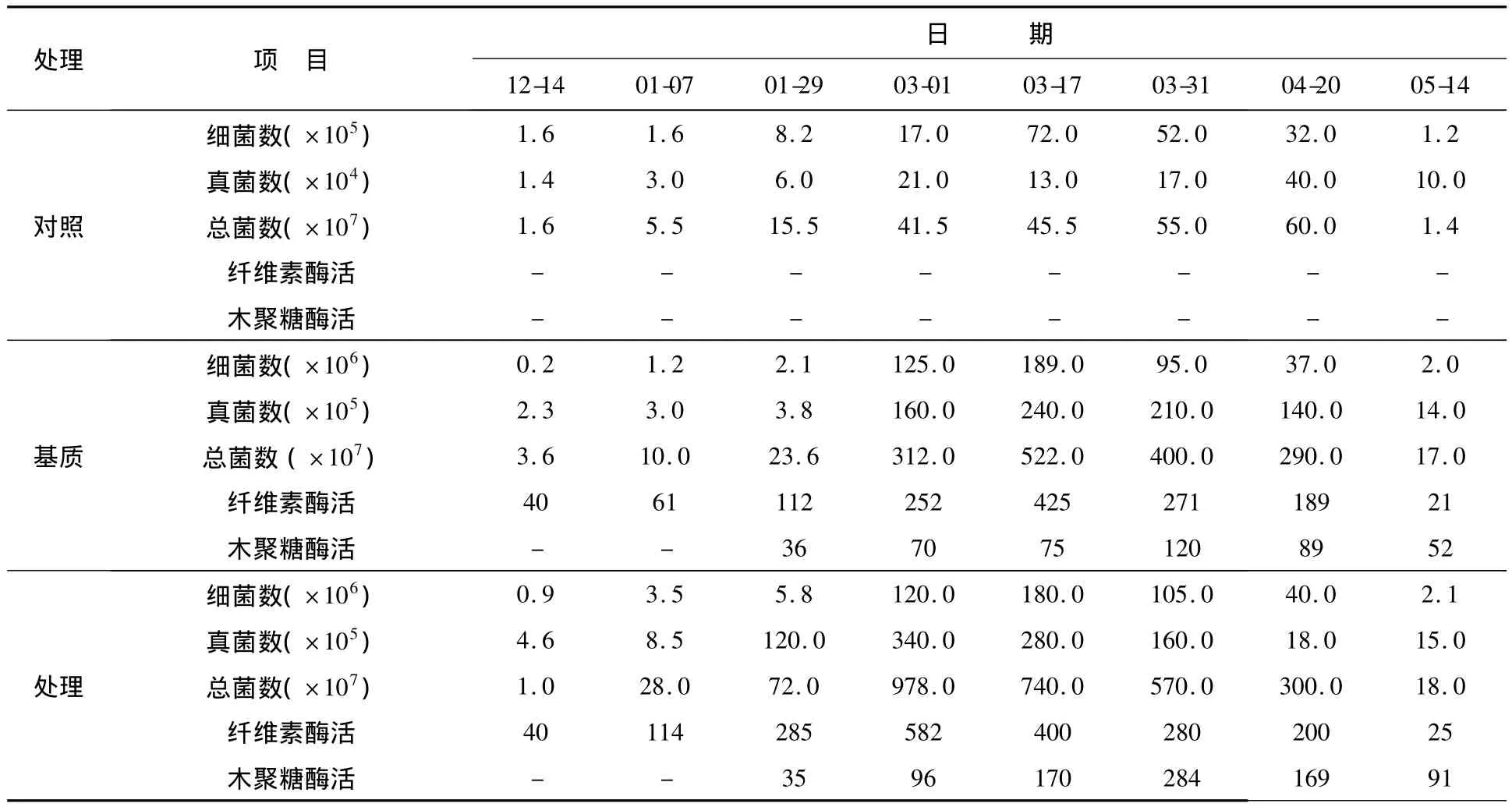
表7 微生物菌群及酶活性变化情况Table 7 The changes of the flora and enzyme activity of microorganisms
大田试验小区微生物种群数量与各处理间显著性分析结果见表8。由表8可以看出,大田玉米使用玉米秸秆降解技术和秸秆腐熟剂对土壤中微生物种群数量有很大影响,由CK与各处理之间比对可以看出,只加秸秆不加腐熟剂的CK处理土壤中的真菌、细菌、放线菌总数及功能菌(自生固氮菌、硝化细菌、纤维素分解菌)与各处理之间差异显著,各处理菌数比CK菌数明显增多,且增加量达到极显著水平,不同菌种使用量土壤中菌数差异也达到了极显著水平。试验小区土壤酶活性与各处理间显著性分析结果见表9,不同菌种使用量土壤酶活性比较结果见图2。从表9及图2可以看出,各种酶活力基本随着腐熟剂施入量的增加而呈现递增趋势,且差异呈显著水平。经过比对还可以看出,施用腐熟剂的各种酶活力均比对照高,且处理4的整体酶活力水平高于各处理间的酶活力水平。说明当腐熟剂施入量为0.4%菌剂时酶活力呈现出较好水平。
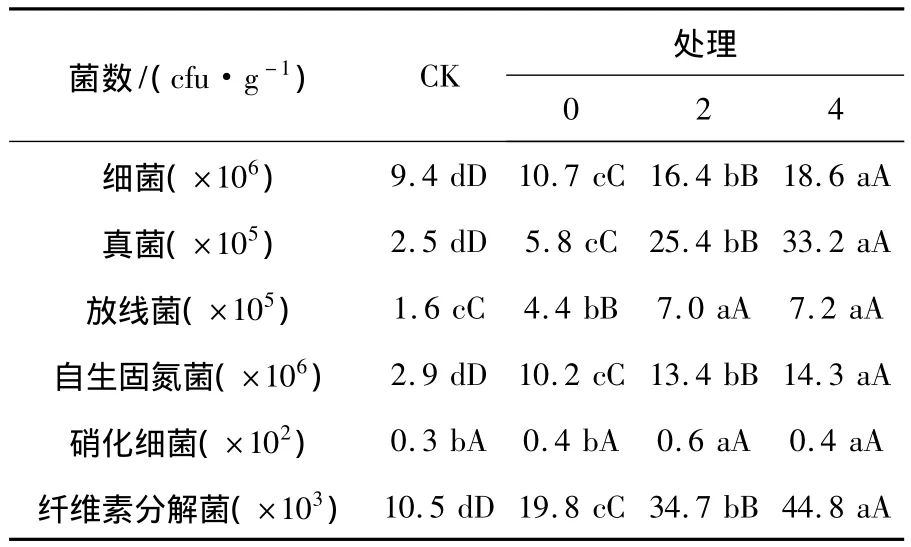
表8 试验小区微生物种群数量与各处理间显著性分析Table 8 The analysis of the microbial populations and significant between each treated room in test area
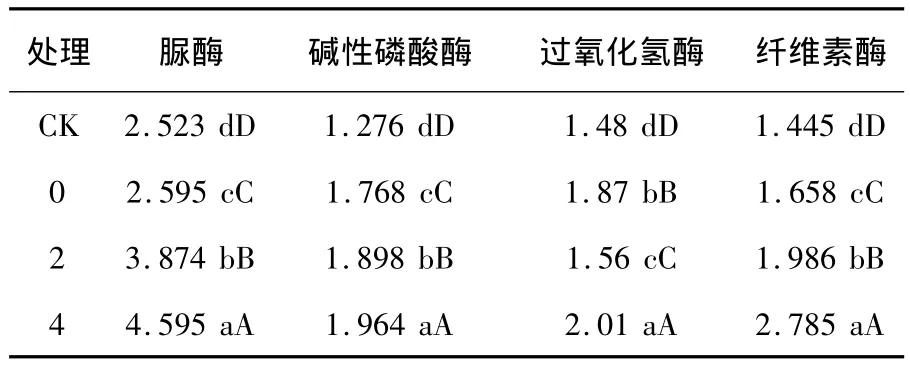
表9 试验小区土壤酶活性与各处理间显著性分析Table 9 The analysis of the soil enzyme activity and significant between each treated room in test area
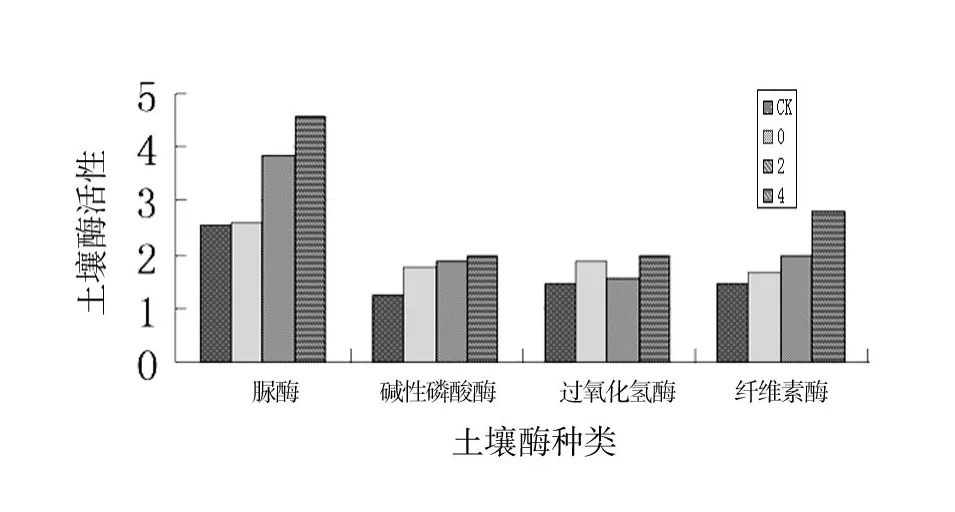
图2 不同菌种使用量土壤酶活性比较Fig.2 The comparison of the soil enzyme activity for the different usage of the strains
5 研究中存在问题与分析
近年来,玉米秸秆快速腐熟技术的应用越来越普遍,说明微生物秸秆腐熟剂在秸秆腐解过程中发挥了重要作用[20-21],试验证明:秸秆+腐熟剂无论是活菌数还是腐解率均较对照有显著差异,效果明显。然而微生物对秸秆的腐熟过程是一个复杂的微生物混合种群生态系统的变化过程[22-23],秸秆腐熟剂的研究涉及土壤微生物群落结构及其功能群分析、土壤有机质微生物转化动力学、聚丙烯酰胺凝胶电泳DGGE为代表的分子指纹图谱技术、土壤微生物生物量测定方法,希望引起广大科技工作者关注。在研究过程中我们发现秸秆腐熟剂在土壤中的定殖能力和腐解率与接入的微生物菌种数量有关,与秸秆中的纤维素酶活性有关,与土壤的温度、湿度和覆土厚度有关,现有的秸秆腐熟剂中微生物的定殖能力还很低,分析其原因,可能是微生物选育和培养过程中温度过高,不适应土壤中的环境。温室大棚常种蔬菜的温度管理指标见表10[24]。
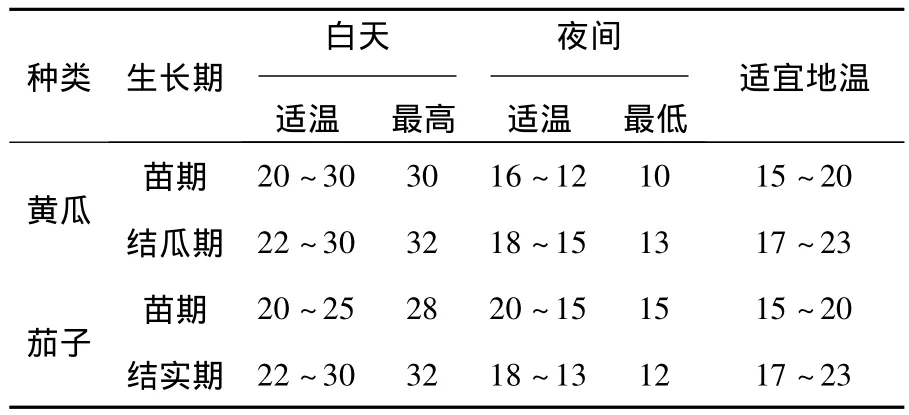
表10 温室中常种蔬菜的温度管理指标(℃)Table 10 The index of temperature management for usual vegetables in the greenhouse(℃)
从表10可以看出,蔬菜从苗期到结实期最适宜的地温是15~23℃,因此在秸秆腐熟剂的微生物菌种分离筛选过程中,应根据温室内地温情况,菌种的培养温度应在20℃左右,这样才能使腐熟剂在使用过程中保证较好的定殖率和腐解率。有关这方面的研究还未见报导,另外,应在土壤中分离菌种才能使菌种适应土壤环境,分离筛选出具有高腐解率的微生物菌种,使微生物腐熟剂在玉米秸秆直接还田中发挥更好的作用,让玉米秸秆这一宝贵资源得到更充分的利用。
从另一个角度看,玉米秸秆还田和秸秆腐熟剂的应用也是调整土壤新的平衡过程,通过研究微生物在土壤有机质的周转和转化中的作用,会更进一步推动土壤微生物的研究与发展,使微生物技术更好地服务于人类。
[1]南雄雄,田霄鸿,张琳,等.小麦和玉米秸秆腐解特点及对土壤中碳、氮含量的影响[J].植物营养与肥料学报,2010,16(3):626-633.
[2]HumbertoBC,LalR,PostWM,OwensLB.Changes in longterm notill corn Growth and yield under different rate sofst over mulch[J].Agron,2006,98:1128-1136.
[3]高忠兰.玉米秸秆还田的优势及其技术[J].现代农业科技,2013,(1):227,231.
[4]A.N.格拉泽,二介堂弘著,陈守文,喻子牛等译.微生物生物技术—应用微生物学基础原理[M].北京:科学出版社,2002.
[5]李俊,沈德龙,林先贵.农业微生物研究与产业化进展[M].北京:科学出版社,2011.
[6]张俐娜.天然高分子改性材料及应用[M].北京:化学工业出版社,2006.
[7]窦森,于水强,张晋京.不同CO2浓度对玉米秸秆分解期间土壤腐殖质形成的影响[J].土壤学报,2007,44(3),458-466.
[8]Nsabimana D,Haynes R J,Wallis F M.Size,activity and catabolic diversity of the soil microbial biomass as affected by land use[J].Appl.Soil Ecol.,2004,26(2):81-92.
[9]Spedding T A,Hamel C,Mehuys G,et al.Soil microbial dynamics in maize growing soil under different tillage and residue management systems[J].Soil Biol.Biochem.,2004,36(3):499-512.
[10]宋长青,吴金水,陆雅海,等.中国土壤微生物学研究10年回顾[J].地球科学进展,2013,28(10):1087-1105.
[11]Lu Z,Lu Y H.Methanocella conradii sp.nov.,a thermophilic,obligate hydrogenotrophic methanogen,isolated from Chinese rice field soil[J].PLoS One,2012,7(4):e35279.
[12]Lu Z,Lu Y H.Complete genome sequence of a thermophilic methanogen,Methanocella conradii HZ254,isolated from Chinese rice field soil[J].Journal of Bacteriology,2012,194(9):2398-2399.
[13]方新,王志学,于淼,等.秸秆自然降解过程中优势菌群的筛选[J].安徽农业科学,2010,38(1):19-20,55.
[14]张庆华,赵新海,李莉,等.秸秆降解菌的筛选及模拟田间应用效果分析[J].微生物学杂志,2010,30(4):101-104.
[15]杨滨娟,钱海燕,黄国勤,等.秸秆还田及其研究进展[J].农学学报,2012,2(5):1-4.
[16]侯占领,牛银霞,郭清霞.不同秸秆还田方式试验研究初报[J].农业科技通讯,2012,(5):110-111.
[17]Masayuki T,Hiroyuki S,Daisuke W,et al.Evaluation of pretreatment with Pleurotus ostreatus for enzymatic hydrolysis of rice straw[J].Journal of Bioscience and Bioengineering,2005,100(6):637-643.
[18]Weng J,Wang Y,Li J,et al.Enhanced root colonization and biocontrol activity of Bacillus amyloliquefaciens SQR9 by abrB gene disruption[J].Applied Microbiology and Biotechnology,2013,97(19):8823-8830.
[19]Ling N,Raza W,Ma J H,et al.Identification and role of organic acids in watermelon root exudates for recruiting Paenibacillus polymyxa SQR-21 in the rhizosphere[J].European Journal of Soil Biology,2011,47(6):374-379.
[20]FRANKENBERGER W T,DICK W A.Relationships between enzyme activities and microbial growth and activity indices in soil[J].Soil Soc Am J,1983,47:945-951.
[21]侯凤慈,王春雷.浅谈农作物秸秆综合利用在建设新农村中的作用[J].河南农业,2008,(12):33.
[22]Bast ian F,Bouziri L,Nicolardot B,et al.Impact of wheat straw decomposition on successional patterns of soilmicrobial community structure[J].Soil Biol.Biochem.,2009,41:262-275.
[23]Baumann K,Marschner P,Smernik R J,et al.Residue chemistry and microbial community structure during decomposition of eucalypt,wheat and vetch residues[J].Soil Biol.Biochem.,2009,41:1966-1975.
[24]盖捍疆.朝阳设施农业栽培实用技术[M].北京:中国农业科学技术出版社,2012.

