嗜麦芽寡养单胞菌D2株smp基因缺失株的构建及鉴定
秦江楠,毕春霞,陈秀琴,罗 玮,张 卫,任 莹,王 斌,闫志勇*
(1.青岛大学医学院 微生物学教研室,山东 青岛 266071;2.青岛市市立医院,山东 青岛 266071)
嗜麦芽寡养单胞菌(Stenotrophomonas maltophilia)属黄单胞菌科寡养单胞菌属,是一种专性需氧的非发酵革兰阴性杆菌,广泛存在于水、土壤、动物体内,为条件致病菌。近年来该菌已成为严重的医院感染菌,其临床分离率在非发酵菌中仅次于铜绿假单胞菌和鲍曼不动杆菌[1]。嗜麦芽寡养单胞菌是多重耐药菌,不仅对β-内酰胺类和氨基糖苷类抗生素天然耐药,而且对喹诺酮类和大环内酯类等也有一定的抗性[2]。此外,研究证实嗜麦芽寡养单胞菌能产生多种具有生物活性的蛋白,如淀粉酶、脂肪酶、透明质酸酶、碱性磷酸酶、蛋白酶等,这些分泌的蛋白对该菌的致病性和耐药性发挥了一定作用[3-4]。从海洋生物双齿围沙蚕消化道分离得到1株可大量分泌SMP蛋白(protein of S.maltophilia,SMP)的嗜麦芽寡养单胞菌(D2株,国家发明专利号ZL200710005055)。研究发现[5],该蛋白为胞外分泌,在培养液上清中产量大、纯度高,且蛋白分泌情况受培养基种类的不同影响较大,即具有可调控性[5],这种高产量胞外分泌现象在其他野生菌株中较为少见。目前已证实SMP具有一定碱性磷酸酶活性,并获得了其完整的基因序列(smp,GenBank收录号GQ413951);此外,还发现smp基因与其Ⅱ型分泌系统基因(T2SS)紧密串联,且前端具有信号肽序列。为进一步了解D2株SMP蛋白的功能及其分泌机制,本研究利用同源重组的方法构建了嗜麦芽寡养单胞菌D2株的smp基因缺失株,为后续研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 本研究中使用的菌株和质粒见表1。
1.1.2 培养基与抗生素 蔗糖培养基:胰蛋白胨1%,酵母提取物0.5%,琼脂1.5%,高压后加入相应体积的蔗糖储存液至终浓度为15%(蔗糖储存液浓度为40%,110℃高压15 min);本研究中所用抗生素浓度:氨苄青霉素(Amp)100 μg/mL、氯霉素(Cm)25 μg/mL。
1.1.3 主要试剂和仪器 实验所用Taq DNA聚合酶、T4连接酶、高保真酶、dNTPs、DNA分子量标准、PrimeSTAR®HS DNA Polymerase为TaKaRa公司产品;PCR产物纯化试剂盒、琼脂糖凝胶回收试剂盒、质粒抽提试剂盒为QIAGEN生产;电泳仪、凝胶成像仪等为BIO-RAD公司产品。
1.2 方法
1.2.1 嗜麦芽寡养单胞菌D2野生株的药物敏感性测试 准备氨苄青霉素、羧苄青霉素、卡那霉素、氯霉素、链霉素、四环素和庆大霉素,稀释法依次配制含有不同浓度以上抗生素的LB液体培养基(因后续试验多数在LB培养基中进行,故以LB培养基代替MH培养基进行药物敏感检测);从新鲜平板上取D2菌用生理盐水制成0.5麦氏浓度的菌液,分别接种到培养基中,25℃,摇菌24 h。
1.2.2 smp基因上下游同源臂及cat基因的扩增根据D2株smp基因上下游同源臂各500 bp左右的序列和氯霉素抗性基因cat序列设计引物,引物序列见表2。其中上下游同源臂扩增的模板为D2野生株基因组,cat基因的扩增模板为 cosmid5。上游同源臂和下游同源臂扩增使用TaKa-Ra的 PrimerSTAR®HS DNA Polymerase制品,扩增参数:94℃预变性5 min;98℃ 10 s,60℃ 5 s,72℃ 40 s,30个循环;72℃延伸8 min。cat基因使用Pyrobest®DNA Polymerase,扩增参数:94℃预变性5 min;94 ℃ 30 s,56℃ 40 s,72℃ 1 min,30个循环;72℃延伸8 min。试剂盒纯化PCR产物,1.0%琼脂糖凝胶电泳鉴定。
1.2.3 SOE-PCR连接各片段 将上游同源臂、下游同源臂、cat基因的纯化产物按1∶1∶1比例混合,混合DNA片段作为融合PCR反应的模板,引物对为up-1和down-2。反应参数同1.2.2中同源臂的扩增,但延伸时间变为1.5 min。PCR产物进行纯化、电泳鉴定并估测浓度。
1.2.4 重组自杀质粒 pEX18Tc-Δsmp/cat的构建分别将融合片段、自杀质粒pEX18Tc用SacⅠ和SalⅠ进行双酶切,酶切产物各自纯化后,按照一定比例用T4 DNA连接酶连接,16℃过夜。重组自杀载体pEX18Tc-Δsmp/cat钙转化入大肠埃希菌SM10λpir,将转化产物在37℃,200 r/min活化1 h后涂布具有氯霉素的LB平板,37℃过夜培养。挑取单个菌落提取基因组DNA,以cat-1/cat-2为引物,通过PCR、酶切鉴定并测序,挑选出含有融合片段并且测序正确的重组自杀质粒。
1.2.5 第1次同源重组 将含有重组自杀质粒的大肠埃希菌SM10λpir(SmS,链霉素敏感)和嗜麦芽寡养单胞菌D2(CmS,氯霉素敏感)菌株分别接种于LB液体培养基,180 r/min培养至OD600约为0.8,各自最适温度为37和30℃。然后4℃、5000 r/min 离心 5 min,收集菌体,再用 100 μL LB液体培养基重悬两菌。将菌液点样于1cm2大小的0.45 μm微孔滤膜,滤膜贴于LB固体培养基,30℃ 过夜接合。用1 mL LB液体培养基洗涤滤膜,吸取适量洗下的菌液涂布在含有双抗(Sm和Cm)的 LB平板上,30℃培养至长出单个菌落。
1.2.6 第2次同源重组及D2 smp缺失株的鉴定挑取双抗平板上的单克隆菌落,接种普通LB平板传1代复苏后,再分别接种到含15%蔗糖的LB平板上,23℃培养2 d长出单克隆菌落,即为嗜麦芽寡养单胞菌D2 smp缺失株。挑取单克隆菌落进行PCR鉴定,鉴定引物分别为cat-1/cat-2和smp-F/smp-R(缺失基因smp内部引物),以野生株D2为对照。
1.2.7 D2缺失株与野生株的蛋白表达观察 将D2野生株和Δsmp缺失株D2分别接种到牛肉膏蛋白胨培养基中,30℃培养48 h,菌液离心后取适量上清进行SDS-聚丙烯酰胺凝胶电泳,观察两菌SMP蛋白的分泌情况。
1.2.8 嗜麦芽寡养单胞菌D2 smp缺失株生长情况的观察 将D2野生株与Δsmp突变株分别从新鲜培养基接种于LB液体培养基中,30℃、200 r/min过夜培养;次日将上述菌液按1∶100比例接种于LB液体培养基中,相同条件培养至OD600为0.8。此时将两菌液稀释入5 mL的LB培养基中,调至相同的OD600吸光值,每隔1 h测1次吸光值,重复测量3次,对所得数据进行统计学分析。
1.2.9 嗜麦芽寡养单胞菌D2 smp缺失株生化试验和药敏试验的检测 采用BD PHOENIX100全自动微生物分析仪对嗜麦芽寡养单胞菌野生株和突变株进行生化及药物敏感性测定。

表1 菌株和质粒Table 1 Strains and plasmids
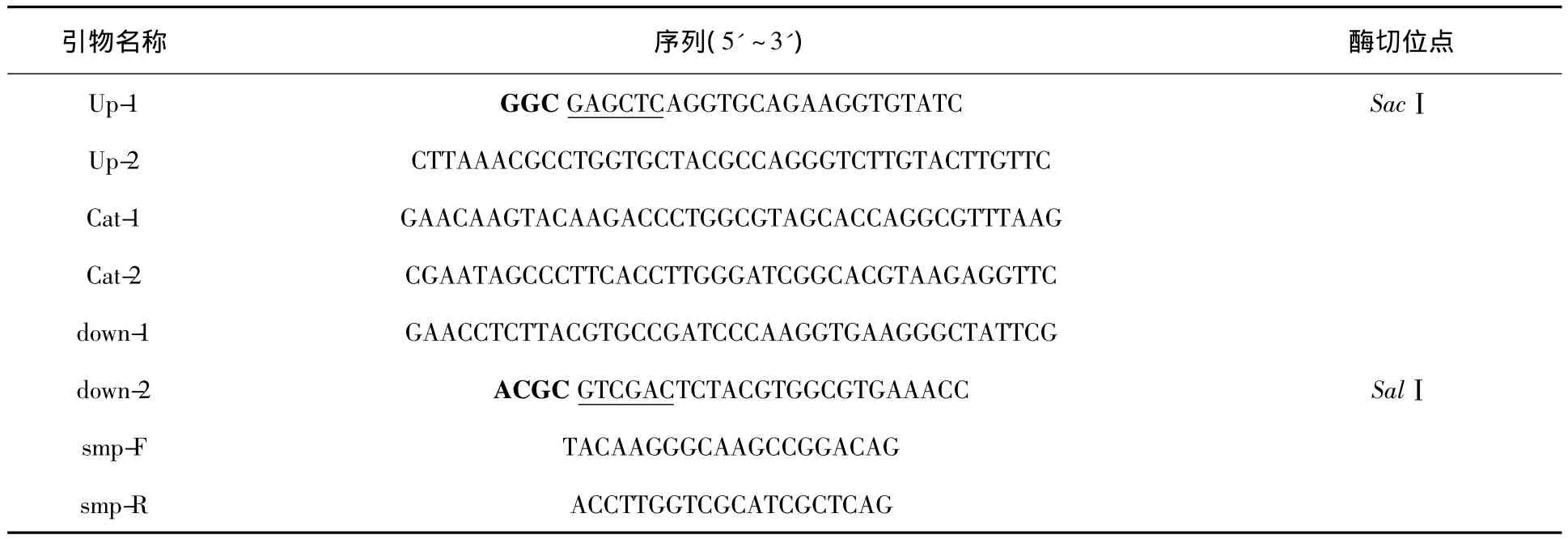
表2 试验引物Table 2 Primers used in this study
2 结果与分析
2.1 D2野生株的药物敏感性测试结果
稀释法测试D2株的药物敏感性,结果显示嗜麦芽寡养单胞菌D2株对氨苄青霉素、羧苄青霉素、链霉素、庆大霉素和卡那霉素等多种抗生素均耐药;在含有一定浓度的氯霉素和四环素培养基中不生长,其中氯霉素的最低抑菌浓度为25 μg/mL,四环素的最低抑菌浓度为12.5 μg/mL,故选择这2种抗生素作为后续同源重组的筛选标记。
2.2 smp基因上下游同源臂片段、cat基因片段及融合PCR片段的鉴定
以引物对up-1/up-2扩增smp基因上游同源臂,大小为547 bp;以引物对down-1/down-2扩增smp基因的下游同源臂,大小为541 bp;以引物对cat-1/cat-2扩增cat基因,大小为847 bp;以引物对up-1/down-2扩增搭桥产物,大小为1855 bp。1%琼脂糖凝胶电泳鉴定结果如图1,产物片段大小相符。
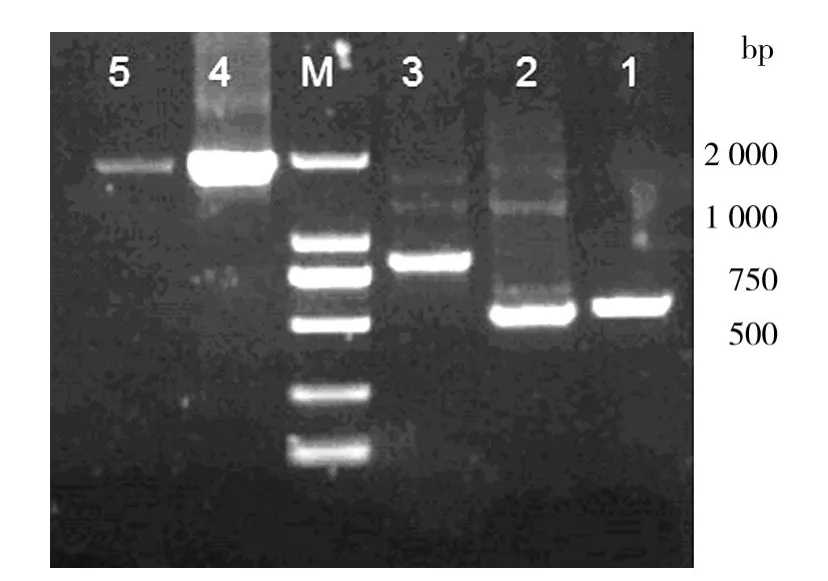
图1 上下游同源臂及融合片段的PCR结果Fig.1 PCR results of the up/down stream and SOE-PCR production
2.3 重组自杀质粒pEX18Tc-Δsmp/cat的鉴定
将载体pEX18Tc和搭桥片段(带有cat基因)各自双酶切后进行连接,TSS法转化入大肠埃希菌SM10λpir,在含有氯霉素的LB平板上培养,筛选出阳性克隆。利用引物对cat-1/cat-2进行PCR鉴定阳性克隆,大小为840 bp左右(图2A);酶切鉴定(图2B)及测序正确。
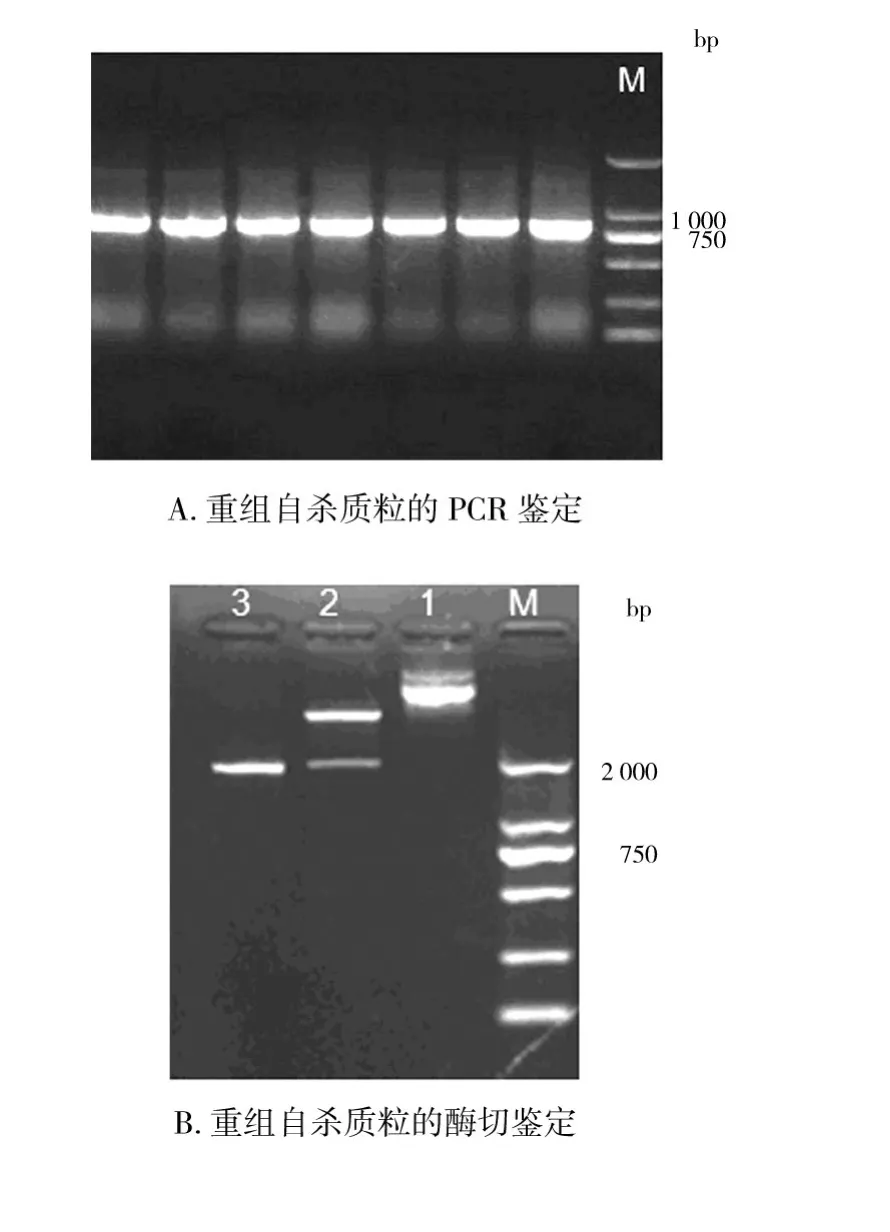
图2 重组自杀质粒的鉴定Fig.2 Identification of the recombinant plasmid
2.4 嗜麦芽假单胞菌D2Δsmp缺失株的筛选和鉴定
大肠埃希菌SM10λpir和嗜麦芽假单胞菌D2在微孔滤膜上接合成功,在氯霉素和链霉素的双抗平板上长出单个菌落。接合子通过蔗糖筛选实验,筛选出突变株D2。用插入的cat基因引物对cat-1/cat-2和缺失的smp基因引物(smp-F/smp-R)进行PCR鉴定,野生株DNA为对照。结果显示野生株扩增出smp基因片段(725 bp),未扩出cat基因;而突变株扩增出cat基因片段(847 bp),未扩出smp基因,证实同源重组成功(图3)。
2.5 野生株与突变株蛋白表达比较
野生D2株和D2缺失株在牛肉膏蛋白胨培养基中的培养上清液进行SDS-PAGE,野生D2株可见42 ku的SMP蛋白条带,缺失株则无该蛋白条带(图4)。

图3 突变株的PCR鉴定Fig.3 PCR identification of mutant
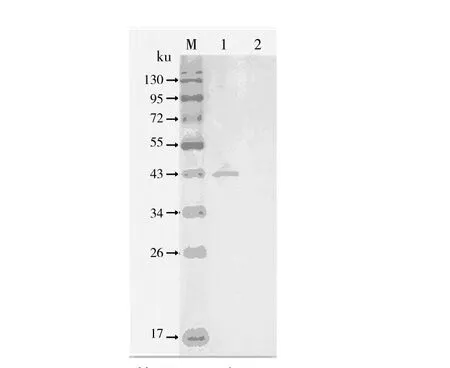
图4 两菌分泌蛋白SDS-PAGEFig.4 SDS-PAGE of SMP expression
2.6 D2缺失株的生长曲线
D2野生株和缺失株在LB液体培养基中的生长曲线基本一致(图5)。
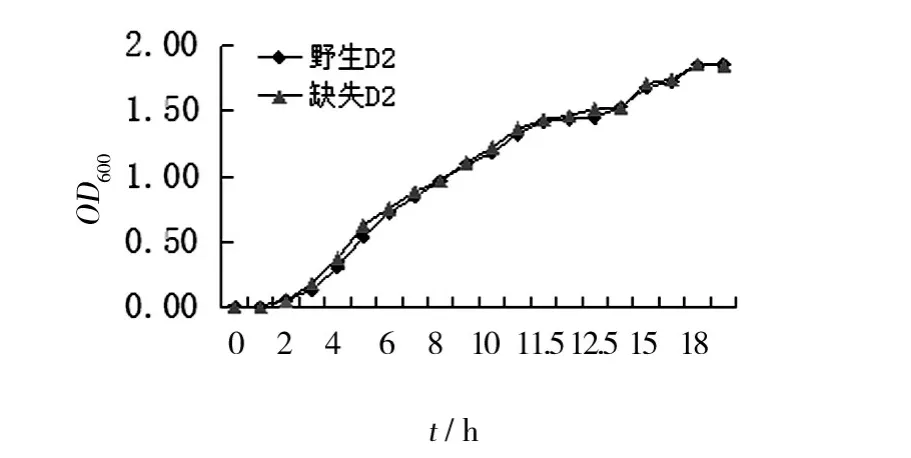
图5 D2野生株和缺失株在LB中的生长曲线Fig.5 The grouth curve of wild-type and Δsmp strains
2.7 嗜麦芽寡养单胞菌D2Δsmp缺失株生化试验和药敏试验的检测
经鉴定,2株菌各生化结果相同,系统均鉴定为嗜麦芽寡养单胞菌,药敏结果显示,野生株对氯霉素敏感,突变株对氯霉素耐药,除氯霉素之外的其他抗生素敏感性均相同。
3 讨论
近年来,嗜麦芽寡养单胞菌因具有多重耐药性,致使该菌的医院感染率逐年上升,在非发酵型革兰阴性菌中位居第3位[6]。另外,嗜麦芽寡养单胞菌能分泌多种生物活性物质,因而具有较高的研发应用价值。本研究中获得的嗜麦芽寡养单胞菌D2株在某些特定培养基中(如富含蛋白胨的牛肉膏培养基等)能够胞外大量分泌SMP蛋白,其编码基因(smp)与Ⅱ型分泌系统基因簇紧密串联,且前24个氨基酸序列为信号肽[7],其分泌机制对于开发新的外源蛋白表达系统具有一定的研究价值。本研究构建了该菌的smp基因缺失株,以期为进一步研究SMP蛋白的功能及其分泌机制奠定基础。
研究基因功能的一个重要方法就是构建目的基因的突变株,将目的基因敲除使之失活,然后通过突变株的表型变化来推测基因的相关功能。基因敲除比较常用的方法是通过同源重组将外源基因与宿主染色体的同源序列进行相应的交换,而传统的同源重组体系为大肠埃希菌内部的RecA重组系统[8]和近年来研究较多的噬菌体Red重组系统[9-10]。本研究采用的是经典的RecA重组系统,对smp基因进行敲除,并以氯霉素抗性基因cat替换。
目前,国内外对嗜麦芽寡养单胞菌基因敲除方面的研究较罕见,之前我们曾尝试了多种自杀质粒,如 pKD46、pWM91、pSD132等,转化入供体菌大肠埃希菌DH5αλpir,但与受体菌D2的接合均未成功。台湾的Hu RM等[11-12]首次报道采用pEX18Tc自杀质粒对嗜麦芽寡养单胞菌的β-内酰胺酶相关基因进行敲除并获得成功,根据其经验选用该质粒,供体菌则选用大肠埃希菌SM10λpir,最终获得成功。
某种细菌如大量合成某种蛋白,则该蛋白往往能在该菌的生命过程中发挥重要作用,在smp基因敲除后该菌是否还能存活,如缺失株不能存活则会严重影响进一步研究的策略。然而,通过比较D2野生株和缺失株的生长曲线、生理生化等特点发现,smp基因的缺失对该菌生长并无明显的影响,证实SMP蛋白并非D2株生命活动所必需。此外,本研究敲除的是D2的包含信号肽在内的完整的smp基因,因而得到突变株并未显著表达出置换smp基因的cat基因。
综上所述,本研究为今后深入了解嗜麦芽寡养单胞菌SMP蛋白胞外分泌机制奠定了基础,如果信号肽作用如所设想的一样,那么嗜麦芽寡养单胞菌D2株经基因改造后即有望成为一种新的原核表达载体。
[1]倪语星,尚红.临床微生物学与检验(第4版)[M].北京:人民卫生出版社,2007:157-158.
[2]耿毅,汪开毓,陈德芳,等.嗜麦芽寡养单胞菌研究进展[J].动物医学进展,2006,27(5):28-31.
[3]Miyaji T,Otta Y,Shibata T,et al.Purification and characterization of extracellular alkaline serine protease from Stenotrophomonas maltophilia strain S-1[J].Letters in applied Microbiology,2005,41(3):253-257.
[4]Denton M,Kerr KG.Microbiological and clinical aspects of infection associated with Stenotrophomonas maltophilia[J].Clinical microbiology reviews,1998,11(1):57-80.
[5]代玉梅,闫志勇,王斌,等.沙蚕消化道产蛋白酶菌D2株的筛选及其酶学性质[J].中国生物制品学杂志,2007,20(10):493-496.
[6]Nyc O,Matejkova J.Stenotrophomonas maltophilia:Significant contemporary hospital pathogen-review[J].Folia Microbiologica,2010,55(3):286-294.
[7]杨丽.嗜麦芽寡养单胞菌D2株碱性磷酸酶基因的克隆与表达[D].青岛:青岛大学,2010.
[8]Gupta R,Ryzhikov M,Koroleva O,et al.A dual role for mycobacterial RecO in RecA-dependent homologous recombination and RecA-independent single-strand annealing[J].Nucleic acids research,2013,41(4):2284-2295.
[9]Yu D,Ellis HM,Lee EC,et al.An efficient recombination system for chormosome engineering in Escherichia coli[J].Proceedings of the national academy of sciences of the United States of America,2000,97(11):6978-5983.
[10]Murphy KC.Phage recombinases and their applications[J].Advances in virus research,2012,83:367-414.
[11]Hu RM,Huang KJ,Wu LT,et al.Induction of L1 and L2 β-Lactamases of Stenotrophomonas maltophilia[J].Antimicrobial agents and chemotherapy,2008,52(3):1198-1200.
[12]Huang YW,Hu RM,Lin CW,et al.NagZ-dependent and NagZ-independent mechanisms for β-Lactamase expression in Stenotrophomonas maltophilia[J].Antimicrobial agents and chemotherapy,2012,56(4):1936-1941.
——紫 苏