反应温度调控生物催化立体选择性的研究进展
俞恩光,郑仁朝,郑裕国
(浙江工业大学生物工程研究所,浙江 杭州 310014)
手性药物的药理作用是药物小分子通过与体内大分子之间的严格手性匹配与分子识别而实现的。因此,服用消旋体药物导致在摄入活性对映体的同时,摄取了大量无效甚至有毒有害的对映体。2006年美国FDA批准的小分子药物中,80%是手性化合物,其中75%是手性化合物中的单个对映异构体。同年1月,我国SFDA也出台了相应的政策法规[1]。可见,医药化工业对手性合成提出了越来越高的要求。由于生物催化具有优异的化学、区域和立体选择性,且反应条件温和(中性、室温)、介质环保、“三废”排放少等诸多优点,在有机合成特别是手性医药化学品的合成中受到越来越多的关注。生物催化剂(酶)对其天然底物通常具有较好的反应活性和立体选择性,但对于非天然底物,其催化活性、稳定性和选择性却难以尽如人意。而有机合成所用底物一般都是人工合成的非天然底物,这就要求开发提高生物催化剂反应活性、稳定性和选择性的方法。目前主要的方法有:①对生物催化剂进行分子改造[2-3];②对非天然底物进行结构修饰[4];③对生物催化剂进行预处理(冻干、印迹酶、固定化等)[5-6];④添加表面活性剂、金属离子或抑制剂[7-8]。但这些方法操作繁琐,成本较高。温度除了可以改变酶促反应的速度外,对酶催化反应的立体选择性也有较大影响。与其他方法相比,温度调控立体选择性具有简单、便捷等优势。
1 酶催化立体选择性与反应温度的关系:理论分析
酶的立体选择性由对映体选择率(enantiomeric ratio,E)表示,它是一个温度依赖性常数[9]。下面从热力学理论角度分析温度对其选择性影响的原因。
温度对酶催化反应选择性的影响是由于温度变化范围内熵和焓变化产生的差异引起的。根据对映体选择率E的定义可知:

由于酶的立体选择性是由2种对映体之间所存在的吉布斯自由能差异所产生的,故
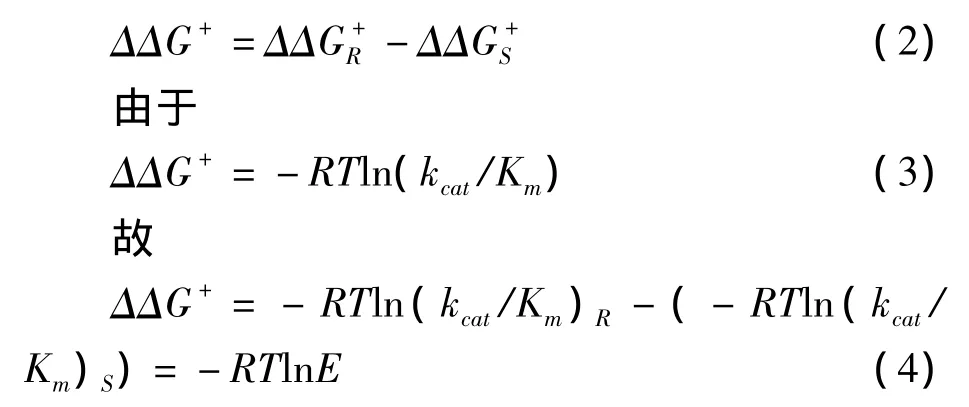
同时,根据热力学定理可得:

假设在某一温度时,酶对消旋底物的2种构型单体选择性相同,则E=1,ΔΔG+=0,此时,熵和焓对酶催化的作用相等。

整理得

Tr被定义为“消旋温度”。这就意味着当反应温度在Tr附近变化时,酶反应的选择性就会发生反转。当反应温度小于Tr时,熵的贡献很小,ΔΔG+主要是活化焓差异 ΔΔH+决定的,E值会随温度的升高而降低,直到T=Tr时,E=1。相反地,当反应温度大于Tr时,ΔΔG+由 TΔΔS+主导,焓起很小的作用,E值随温度的升高而升高。
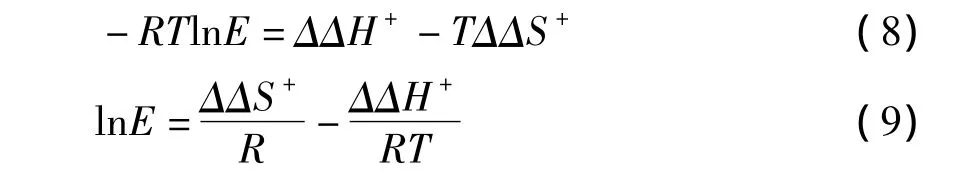
以lnE对1/T作图可得酶催化反应的 ΔΔH+和 ΔΔS+。
式中参数:
(1)ΔΔG+:反应自由能。分子间发生反应所需自由能;(2)ΔΔH+:反应的焓变。与反应自由能相关的温度依赖性常数,是反应形成过渡态时产生的偶极和空间作用力相关;(3)ΔΔS+:反应的熵变。也是反应自由能相关的温度依赖性常数,主要是由于反应形成过渡态时溶剂和反应介质所形成的阻碍作用。
2 反应温度调控生物催化对映选择性的应用
目前,通过温度调节酶立体选择性的实例越来越多,在醇脱氢酶、青霉素G酰化酶和脱卤酶,特别在具有较广温度适应范围(-40~120℃)的脂肪酶和酯酶[10-11]中报道较多。
2.1 反应温度调节醇脱氢酶立体选择性
Phillips等[12]利用 Thermoanaerobacter ethanolicu仲醇脱氢酶(SADH)催化外消旋2-丁醇、2-戊醇和2-己醇生成相应的手性醇中发现,随着温度升高,酶的立体选择性下降甚至发生逆转。以2-丁醇为底物时,Tr=26℃。当T<26℃时,(S)-2-丁醇是酶偏好的底物(lnE<0),而当T>26℃时,(R)-2-丁醇是酶偏好的底物(lnE>0)。即酶的立体选择性发生了逆转,由原来的S型选择性变为R型选择性(图1)。以2-戊醇为底物时,也观察到同样的变化过程,Tr=70℃。
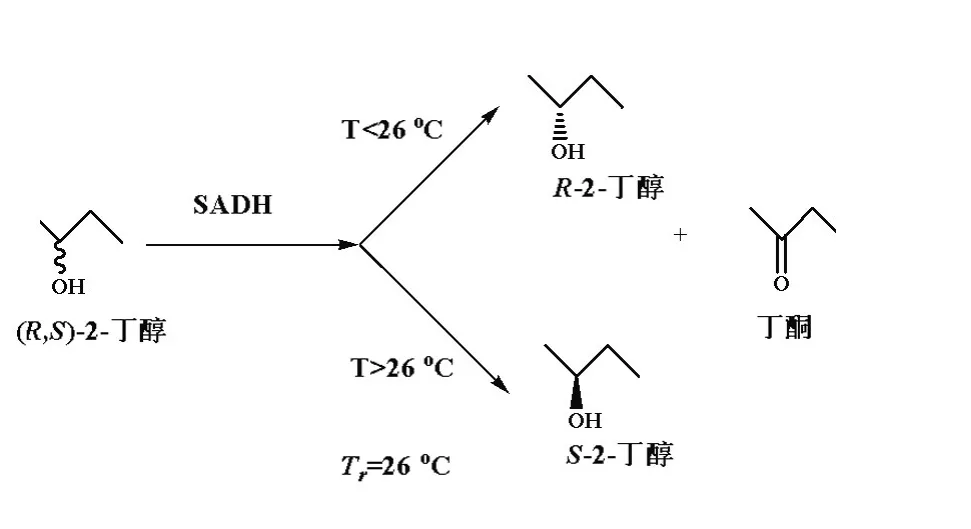
图1 醇脱氢酶不对称拆分(R,S)-2-丁醇生成相应的手性醇Fig.1 Enantioselective resolution of(R,S)-2-butanol by SADH
2.2 反应温度调控脂肪酶或酯酶的立体选择性
酯酶和脂肪酶催化的反应类型多,且在不同类型的反应中均发现温度对其立体选择性影响较大。
2.2.1 温度对脂肪酶催化的乙酰化反应立体选择性的调控 Amir等[13]在利用固定化 Candida antarctita脂肪酶立体选择性乙酰化3-(羟甲基)-1,4-苯并二氮杂卓-2-(酮)中发现:当温度由40℃降至-15℃时,酶对3-(羟甲基)-1-甲基-4-苯并二氮杂卓-2-(酮)的立体选择性提升至原来的5倍;而对 3,3-二羟甲基-1,4-苯并二氮杂卓-2-(酮),产物ee值由0℃时的90%下降为60℃的69%。Tomoko等[14]利用脂肪酶在超临界二氧化碳和乙酸乙烯酯中立体选择性乙酰化外消旋1-(p-氯苯)-2,2,2-三氟乙醇中发现,该脂肪酶的 E值由低温低压的60下降到高温高压的10左右。
2.2.2 温度对脂肪酶催化的氨解反应立体选择性的调控 Paloma等[15]利用 CALB、Thermomyces lanuginosus脂肪酶(TLL)和 Pseudomonas alcaligenes脂肪酶(PAL)分别催化苯基甘氨酸甲酯、苯基丙氨酸甲酯的氨解反应发现(图2),CALB对苯基甘氨酸甲酯的E值随反应温度由40℃降低到-20℃时从17提高到52,而对苯基丙氨酸甲酯的E值变化不大。TLL和PAL对苯基丙氨酸甲酯的E值随温度由40℃下降到-20℃时,由13提高到84。

图2 脂肪酶催化苯基甘氨酸甲酯/苯基丙氨酸甲酯的氨解反应Fig.2 Ammoniolysis of the methyl esters of phenylglycine/phenylalanine by lipase
2.2.3 温度对脂肪酶或酯酶催化的酯化反应立体选择性的调控 ①当T<Tr时,温度升高酶立体选择性降低,温度降低酶立体选择性增加:Yoshitaka等[16]利用来自Candida rugosa脂肪酶MY在丁醇和异丙醚中催化2-苯基丙酸衍生物(图3)酯化生成相应的酯类。图3中1、2随着温度的升高,酶的E值下降到1(57℃)左右,此时,酶无选择性。Takashi等[17]利用Burkholderia cepacia 脂肪酶拆分环氮乙烷-2-甲醇(图4)。当温度降低至-40℃时,酶的E值由17提高到符合工业化要求的99,将脂肪酶固定化到多孔陶瓷上后,酶催化反应速度提高了80倍,这为低温生物催化的工业化应用提供了可能。②当T>Tr时,温度升高酶立体选择性增加,温度降低酶立体选择性降低:Robert等[18]利用Candida rugosa(CRL)酯酶、Rhizomucor miehei(Palatase®)酯酶和极端嗜热菌Sulfolobus solfataricus P1羧酸酯酶Sso EST1催化萘普生甲酯的水解(图5)。CRL酯酶和Palatase®酯酶对萘普生甲酯的消旋温度(Tr)分别为(-46.3±8.9)、(1.1±0.4)℃,温度从0℃升高到60℃时,lnE分别从3提高到5,0提高到1(表1)。羧酸酯酶Sso EST1的Tr为(88.1±6.9)℃,当温度由0℃升高到70℃时,lnE由3降低为1。这是由于羧酸酯酶Sso EST1催化过程主要是由焓控制的,而CRL酯酶和Palatase®酯酶则是由反应的熵控制的。
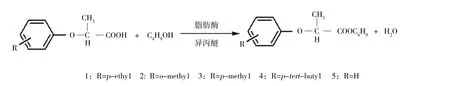
图3 脂肪酶MY催化2-苯基丙酸衍生物的酯化反应Fig.3 Lipase MY catalyzed esterification of 2-phenoxypropionic acids
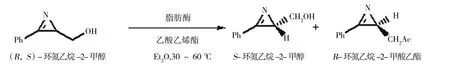
图4 脂肪酶拆分环氮乙烷-2-甲醇Fig.4 Lipase-catalyzed resolution of azirine-2-methanol
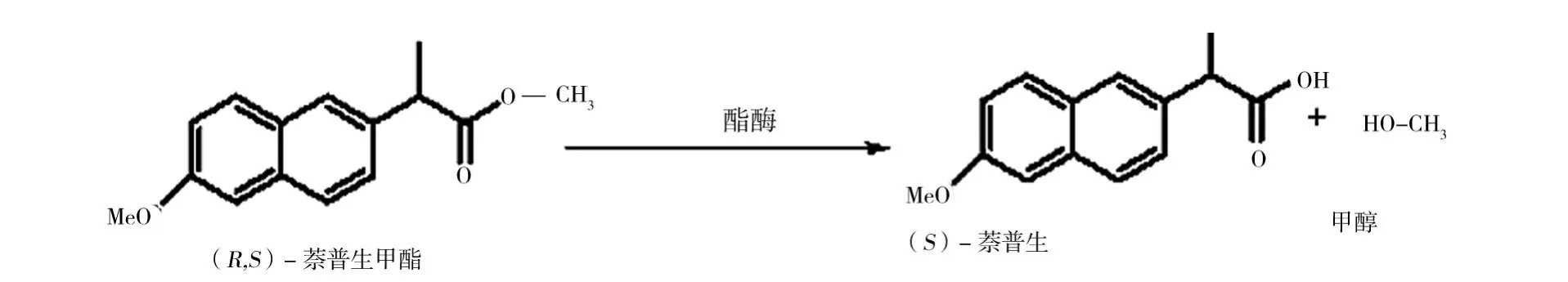
图5 酯酶催化(R,S)-萘普生甲酯的水解Fig.5 Esterase-Catalyzed Hydrolysis of(R,S)-Naproxen Methyl Ester

表1 酯酶催化(R,S)-萘普生甲酯的水解反应中的热力学参数和消旋温度Table 1 Thermodynamic parameter and Trof hydrolysis of(R,S)-Naproxen Methyl Ester catalyzed by Esterase
2.3 反应温度调控其他酶的立体选择性
2.3.1 青霉素 G 酰化酶 Gianfranco等[19]利用青霉素G酰化酶动力学拆分β-内酰胺(图6),发现随着温度的升高,酶的E值下降至24(T=301 K),温度继续升高,酶的E值又上升至130(T=328 K)。通过对温度的简单调节,可以使原本不适用的酶变得非常有效。
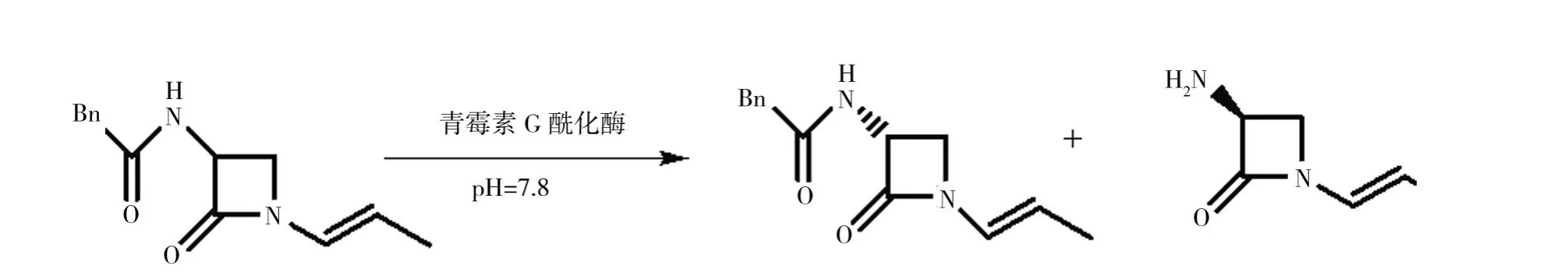
图6 青霉素G酰化酶动力学拆分β-内酰胺Fig.6 Kinetic resolution of racemic β-lactam 1 by PGA(Penicillin G-Acylase)
2.3.2 脱卤酶 Radka等[20]利用 Bradyrhizobium japonicum USDA110卤代烷脱卤酶DbjA研究温度对酶立体选择性的影响。该酶催化不同底物的E值和熵焓变化见表2。研究发现,降低温度可显著提高该酶的选择性。对2-溴戊烷,温度由50℃降低至20℃时,E值由13提高至174;对乙基-2-溴丙酸盐,由197提高至474;对底物甲基-2-溴丁酸盐,由83提高至225。

表2 脱卤酶DbjA催化卤化物脱卤反应E值和熵焓变Table 2 Thermodynamic parameter and Trof dehalo-reaction catalyzed by DbjA
3 结语
综上所述,温度对脂肪酶、酯酶、脱卤酶、醇脱氢酶和青霉素G酰化酶的立体选择性有较大影响。一般来说,当反应温度高于Tr时,提高温度会降低酶催化的立体选择性,但当温度小于Tr时,提高温度可以提高酶的立体选择性。当反应的Tr很低时,可以通过添加有机溶剂调高酶的Tr,从而可以在室温条件下调节酶的选择性。当在室温条件下E值很低时,可降低反应温度来提高E值,从而达到工业化应用的要求。因此,温度调节将在酶立体选择性调控中发挥重要作用。
[1]朱敦明,吴洽庆.生物催化剂立体选择性的基因工程改造[J].生物工程学报,2009,25(12):1770-1778.
[2]Terao Y,Ijima Y,Miyamoto K.Inversion of enantioselectivity of arylmalonate decarboxylase via site-directed mutation based on the proposed reaction mechanism[J].Journal of Molecular Catalysis B:Enzymatic,2007,45:15-20.
[3]Ijima Y,Matoishi K,Terao Y.Inversion of enantioselectivity of asymmetric biocatalytic decarboxylation by site-directed mutagenesis based on the reaction mechanism[J].Chemical Communications,2005,7:877-899.
[4]Arto L,Hanna MK,Petri T.Chemoenzymatic approach to enantiopure piperidine based beta amino esters in organic solvents[J].Tetrahedron:Asymmetry,2007,18(2):181-191.
[5]Asha C,Rajinder P,Surrinder K.Arthrobacter sp.lipase immobilization for improvement in stability and enantioselectivity[J].Applied Microbiology and Biotechnology,2006,73(3):598-606.
[6]Jin CW,Vicknesh S,Hui HT.Immobilization of Candida rugosa lipase by cross linking with glutaraldehyde followed by entrapment in alginate beads[J].Biocatalysis and Biotransformation,2006,24(5):352-357.
[7]Kwang WL,Hyun AB,Gab SS.Purification and catalytic properties of novel enantioselective lipase from Acinetobacter sp.ES-1 for hydrolysis of(S)-ketoprofen ethyl ester[J].Enzyme and Microbial Technology,2006,38(3):443-448.
[8]Zhang DL,Jian HX,Li LZ.Overexpression of Serratia marcescens lipase in Escherichia coli for efficient bioresolution of racemic ketoprofen[J].Journal of Molecular Catalysis B:Enzymatic,2007,47(3):105-110.
[9]Phillips RS.Temperature modulation of the stereochemistry of enzymatic catalysis:prospects for exploitation[J].Trends Biotechnol,1996,14:13-16.
[10]Sakai T.The effect of temperature on the lipase-catalyzed asymmetric protonation of 1-acetoxy-2-methylcyclohexene giving(R)-2-methylcyclohexanone[J].Tetrahedron:Asymmetry,2004,15(18):2749-2756.
[11]Tadashi E,Masafumi K,Toshinobu K,et al.Highly enantioselective lipase-catalyzed reactions at high temperatures up to 120 ℃ in organic solvent[J].Tetrahedron:Asymmetry,2003,14:3943-3947.
[12]Pham VT,Phillips RS,Ljungdahl LG.Temperature-dependent enantiospecificity of secondary alcohol dehydrogenase from Thermoanaerobacter ethanolicus[J].Journal of American Chemical Society,1989,111:1935-1936.
[13]Amir A,Andreja L,Zsuzsa M,et al.Lipase catalyzed acetylation of 3-substituted 2,3-dihydro-lH-1,4-benzodiazepin-2-ones:Effect of temperature and conformation on enantioselectivity and configuration[J].Hflvetica Chimica Acta,1998,81:1567-1582.
[14]Tomoko M.Control of enantioselectivity of lipase-catalyzed esterification in supercritical carbon dioxide by tuning the pressure and temperature[J].Tetrahedron:Asymmetry,2003,14:2087-2091.
[15]Paloma LS,Margreth A,Wegman,et al.Enantioselective enzyme catalysed ammoniolysis of amino acid derivatives:Effect of temperature[J].Tetrahedron:Asymmetry,2001,12:235-240.
[16]Yoshitaka Y,Shin IU.High temperature-induced high enantioselectivity of lipase for esterifications of 2-Phenoxypropionic acids in organic solvent[J].Bioorganic Chemistry,1997,25:88-99.
[17]Takashi S.Low-temperature method for a dramatic improvement in enantioselectivity in lipase-catalyzed reactions[J].Tetrahedron:Asymmetry,2004,15:2749-2756.
[18]Robert MK.Enantiomeric resolution of 2-aryl propionic esters with hyperthermophilic and mesophilic esterases:Contrasting thermodynamic mechanisms[J].Journal of American Chemical Society,2002,124:8190-8191.
[19]Gianfranco C,Valeria DM,Paola G,et al.Temperature and solvent effects on enzyme stereoselectivity:inversion temperature in kinetic resolutions with lipases[J].Chemical.Communications,2000:2351-2352.
[20]Radka C,Zbynek P,Yukari S,et al.Stereoselectivity and conformational stability of haloalkane dehalogenase DbjA from Bradyrhizobium japonicum USDA110:the effect of pH and temperature[J].Journal of Federation European Biochemical Societies,2011,278:2728-2738.