昆虫肠道菌对反枝苋的除草活性筛选及菌株JC-03的初步鉴定
方雅红,陈 洁,施晓莉,蔡颖宇,吴忠云,张应烙
(浙江师范大学化学与生命科学学院,浙江金华 321004)
反枝苋(Amaranthus retroflexus L.)是我国的恶性入侵杂草,严重危害旱田农作物[1]。目前,化学防治是治理反枝苋危害的主要措施,但化学除草剂的长期使用带来了诸如环境污染日趋严重和耐药杂草种群的上升等问题[2-3],从而加大了防除难度。因此,研究开发新型除草剂迫在眉睫。筛选和利用微生物代谢产物防治杂草具有许多潜在优势,是新型除草剂的重要研发方向[4-6]。已有研究表明昆虫肠道菌能分泌一些消化酶帮助昆虫消化食物[7-8],也有可能合成植物毒素,这类毒素能杀死植物以利于昆虫消化吃进去的植物[9]。因此,昆虫 (特别是植食性昆虫)肠道菌可能是新颖除草剂的重要来源。在较系统研究棉蝗和负蝗肠道菌除草活性的基础上[9-11],活性筛选表明1株大黑金龟子肠道菌JC-03对反枝苋具有较好的除草活性。本文报道该活性菌株并初步确定其分类地位,旨在为开发新型微生物源除草剂奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试杂草及常见作物 反枝苋种子采自青岛农业大学周边,旱田常见作物如油菜、大豆、西红柿、辣椒种子购于金华市种子市场。
1.1.2 供试昆虫 甲虫、负蝗、天牛、棉蝗和蚱蜢等捕自浙江师范大学周边。
1.1.3 MEA培养基 生麦芽20 g,加水煮沸30 min,以纱布滤去残渣,滤液加水补足至1000 mL,加入15~20 g琼脂加热熔化,再加蔗糖20 g及蛋白胨1 g溶解,分装,121 ℃、0.1 MPa灭菌20 min备用。不加琼脂者为相应液体培养基(ME)。
1.2 方法
1.2.1 菌种的分离和纯化 参考文献[11]的方法,分离前让昆虫饥饿24 h,在无菌条件下用75%酒精表面消毒,无菌水漂洗3次后解剖,取出昆虫肠道,加少量无菌水在无菌研钵中研磨,用无菌水对研磨液梯度稀释成 10-1、10-2、10-3,分别取各梯度稀释液0.2 mL涂布于MEA培养基中,置于28℃恒温箱中培养,待菌体长出后,挑取所需菌落边缘菌丝纯化培养,最终得到14株昆虫肠道菌。
1.2.2 菌种的发酵及发酵产物的提取 采用液体发酵的方法,挑取已纯化的带有培养基的菌丝体接种到装有约400 mL ME液体培养基的1000 mL锥形瓶中,于摇床上220 r/min 28℃振荡培养。培养约7 d后,获得发酵液。所得发酵液在室温下经纱布过滤后得滤液,滤液经乙酸乙酯萃取多次,直至上层乙酸乙酯层无色为止。将得到的乙酸乙酯层溶液合并,在旋转蒸发仪上蒸发浓缩至干即得粗浸膏[12]。
1.2.3 JC-03不同极性发酵产物的提取 参照1.2.2,对JC-03进行液体发酵并得到发酵滤液,滤液依次用石油醚、二氯甲烷、乙酸乙酯和正丁醇萃取,萃取液经减压浓缩分别得石油醚提取物、二氯甲烷提取物、乙酸乙酯提取物、正丁醇提取物和水提取物。
1.2.4 昆虫肠道菌粗提物的除草活性测试 参照文献[13],用培养皿生物分析法(Petri dish bioassay)测定发酵液粗提物对反枝苋的除草活性,具体操作如下:用0.2%次氯酸钠浸泡反枝苋种子15 min后用清水洗涤3次,将处理过的反枝苋种子置于室温下浸泡1 d催芽露白后备用。用万分之一天平称取发酵液粗提物,再用丙酮稀释成浓度为100 μg/mL的药液。在铺有滤纸的直径为9 cm的培养皿中加入待测药液5.00 mL,待溶剂挥发后即得药膜,再加入5.00 mL蒸馏水后,挑选20粒大小、色泽、成熟度一致的反枝苋露白种子均匀置于培养皿中,盖好皿盖,将培养皿放入28℃智能光照培养箱中培养。另设丙酮和相同浓度的2,4-二氯苯氧乙酸(2,4-D)分别作为空白对照和阳性对照。每个处理重复3次。处理1~2 d后测定反枝苋幼苗的茎和根长,求出抑制率。抑制率的计算公式:抑制率(%)=[(空白对照组幼苗茎或根的长度-实验组幼苗茎或根的长度)/(空白对照组幼苗茎或根的长度)]×100%。
1.2.5 JC-03粗提物对作物的安全性测定 参照文献[14],用培养皿生物分析法测定JC-03菌株乙酸乙酯粗提物对旱田常见的作物如油菜、大豆、西红柿、辣椒的影响。
1.2.6 JC-03菌株鉴定 采用形态特征和 DNA测序相结合的方法鉴定JC-03菌株。首先观察JC-03菌株的菌落形态,挑取少量菌落制片,用生物显微镜观察菌株孢子的形态特征;同时,用基因组DNA提取试剂盒提取该菌株的DNA,再进行PCR扩增。对扩增得到的DNA进行琼脂糖凝胶电泳检测,若条带明显,则将扩增得到的DNA产物进行测序,并利用BLAST和MEGA4,将获得的5.8S rDNA序列在GenBank的核酸序列库中进行同源性序列分析,确定JC-03菌株的种属分类地位。
2 结果与分析
2.1 14株昆虫肠道菌粗提物对反枝苋生长的抑制作用
14株昆虫肠道菌发酵液的乙酸乙酯粗提物对反枝苋的茎和根生长的抑制结果见表1。当供试浓度为100 μg/mL时,JC-03粗提物对反枝苋根的生长表现出显著的抑制作用,其对反枝苋茎和根的抑制率均大于65%,比同浓度阳性对照2,4-D的抑制效果好。
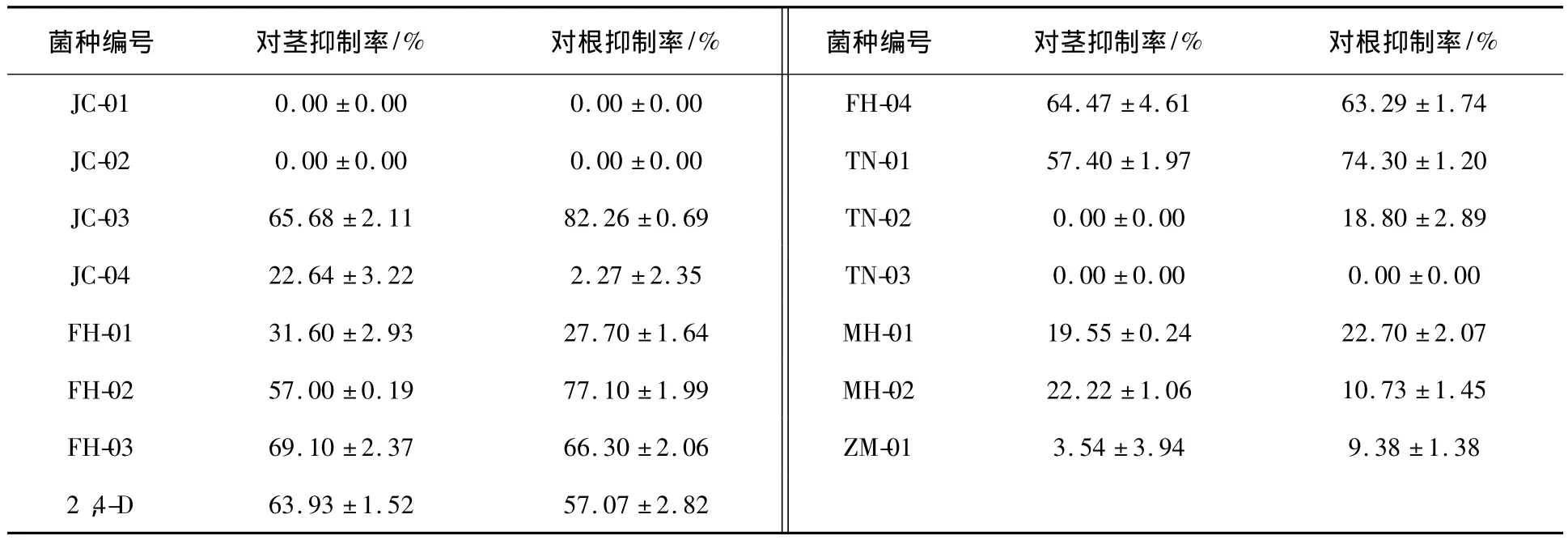
表1 14株昆虫肠道菌乙酸乙酯粗提物对反枝苋茎和根生长的抑制作用Table 1 Inhibitory effect of ethyl acetate extracts from fourteen insect gut fungi against the growth of A.retroflexus’s stem and root
2.2 JC-03不同极性粗提物对反枝苋生长的抑制作用
JC-03不同极性粗提物对反枝苋的除草活性结果见表2。从表中数据可以看出,JC-03发酵液乙酸乙酯粗提物的除草活性最好,其对反枝苋茎和根的抑制率分别为59.43%和70.02%,说明其活性物质主要集中在中等极性的乙酸乙酯提取物中。
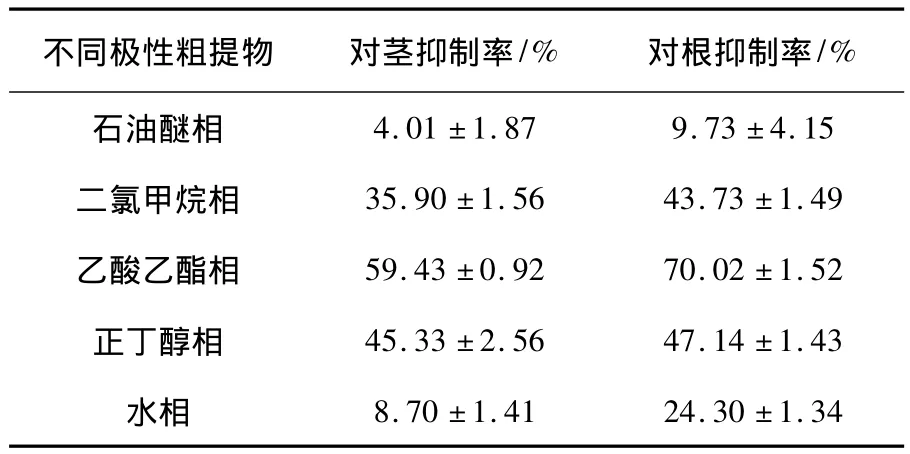
表2 JC-03不同极性粗提物对反枝苋茎和根生长的抑制作用Table 2 Inhibition effect of the strain JC-03’s crude extracts of different polarities against the growth of A.retroflexus’s stem
2.3 JC-03对作物的安全性测定
采用培养皿生物分析法,测定JC-03乙酸乙酯粗提物对旱田常见作物油菜、大豆、西红柿、辣椒的安全性,结果见表3。当供试浓度为100 μg/mL时,JC-03的乙酸乙酯粗提物对作物的安全性较好,对4种作物茎和根的抑制率均低于35%;而同浓度的阳性对照2,4-D对作物的抑制率较高,对4种作物茎和根的抑制率大于65%。因此JC-03菌对作物的抑制作用较小,即对作物的安全性较高。

表3 JC-03乙酸乙酯粗提物对4种作物茎和根的抑制作用Table 3 Inhibition effect of ethyl acetate extract from the strain JC-03 against the growth of 4 crops’tem and root
2.4 JC-03 菌种鉴定
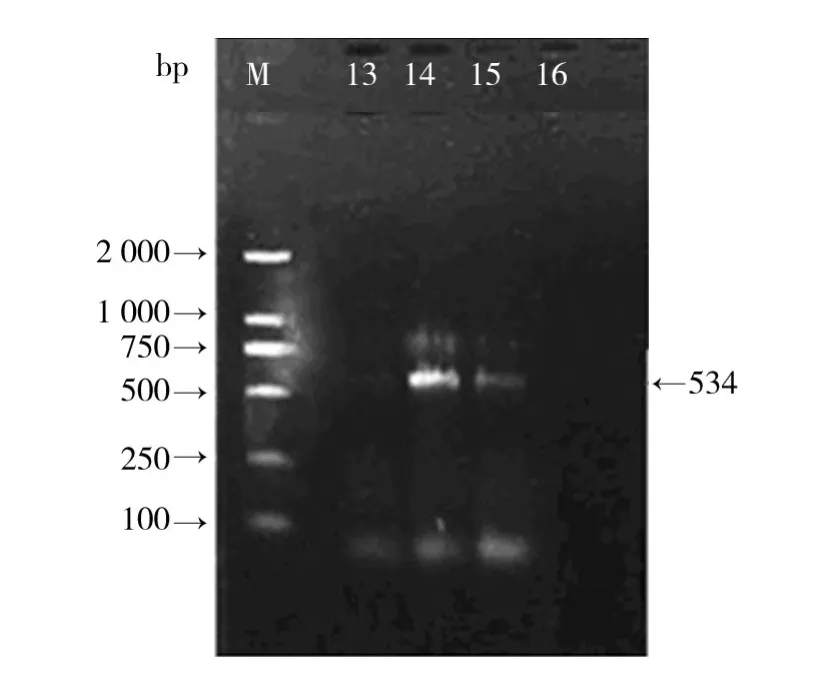
图1 JC-03菌株ITS-5.8S rDNA PCR扩增产物电泳结果Fig.1 Agarose gel electrophoresis of ITS-5.8S rDNA gene of strain JC-03 PCR products
在MEA培养基上,JC-03菌株菌落呈圆形,质地均匀,紧贴平板,菌丝呈絮状,生长旺盛,初期呈白色,后期中央菌丝体由白色转为洋葱红色或者鲜红色。采用插片法培养,镜检发现该菌株可产生孢子,大型分生孢子呈卵形或者纺锤形,具3~5个隔膜,个别具1~2个隔膜。利用ITS-5.8S rDNA区域的通用引物ITSl和ITS4,JC-03菌株的ITS-5.8S rDNA区域进行扩增,PCR扩增产物电泳图谱见图1,片段大小在500~750 bp之间,测序结果表明为534 bp。将JC-03菌的5.8S rDNA基因序列与GenBank上已公布的序列进行比对,发现JC-03菌与赤霉菌(Gibberella intermedia AB725612)的同源性高达99%,在系统发育树上的亲缘关系较近(图2)。再结合形态学鉴定结果,最终确定JC-03菌为赤霉菌(G.intermedia)。

图2 基于5.8S rDNA基因序列构建的菌株JC-03与赤霉菌属相关菌株之间的系统发育树Fig.2 Phylogenetic tree based on the 5.8S rDNA gene sequences of JC-03 and Gibberella’s related strains
3 讨论
本实验从多种昆虫肠道中分离得到14株菌,活性筛选表明大黑金龟子肠道菌JC-03的乙酸乙酯粗提物对反枝苋具有较好的除草活性,且其对常见作物油菜、大豆、西红柿和辣椒的安全性较好。因此,JC-03菌具有开发成安全的微生物源除草剂的潜力。
文献报道与G.intermedia无性态同属的Fusarium nygamai具有除草活性且其活性成分主要为镰刀菌酸(fusaric acid)类物质[15],分离的 JC-03菌是否有该类物质或其他活性成分,还有待于后续的进一步研究。另外,对于该菌的活性作用机理和田间防效等,也有待于进一步的研究探讨。
[1]鲁萍,梁慧,王宏燕,等.外来入侵杂草反枝苋的研究进展[J].生态学杂志,2010,29(8):1662-1670.
[2]Petroski R J,Stanley D W.Natural compounds for pest and weed control[J].Journal of Agricultural and Food Chemistry,2009,57(18):8171-8179.
[3]张朝贤,倪汉文,魏守辉,等.杂草抗药性研究进展[J].中国农业科学,2009,42(4):1274-1289.
[4]仉欢,王开运.微生物除草剂研究进展[J].杂草科学,2010,(2):1-7.
[5]Schraderl K K,Andolfi A,Cantrell C L,et al.A survey of phytotoxic microbial and plant metabolites as potential natural products for pest management[J].Chemistry & Biodiversity,2010,7(9):2261-2280.
[6]Vurro M,Boari A,Evidente A,et al.Natural metabolites for parasitic weed management[J].Pest Management Science,2009,65(5):566-571.
[7]Lundgren J G,Lehman R M.Bacterial gut symbionts contribute to seed digestion in an omnivorous beetle[J].Plos One,2010,5(5):e10831.
[8]Visˆotto L E,Oliveira M G,Guedes R N,et al.Contribution of gut bacteria to digestion and development of the velvetbean caterpillar,Anticarsia gemmatalis[J].Journal of Insect Physiology,2009,55(3):185-191.
[9]Zhang Y L,Ge H M,Li F,et al.New phytotoxic metabolites from Pestalotiopsis sp.HC02,a fungus residing in Chondracris rosee gut[J].Chemistry & Biodiversity,2008,5(11):2402-2407.
[10]Zhang Y L,Kong L C,Jiang D H,et al.Phytotoxic and antifungal metabolites from Curvularia sp.FH01 isolated from the gut of Atractomorpha sinens[J].Bioresource Technology,2011,102(3):3575-3577.
[11]张应烙,尹彩萍,叶圣涛.棉蝗肠道真菌Phoma sp.HC03除草和免疫抑制成分研究[J].天然产物研究与开发,2010,22(4):600-602.
[12]胡松英,张应烙,黄娟翠,等.白蚁共生放线菌的抗菌活性筛选及菌株BY02的初步鉴定[J].微生物学杂志,2011,31(3):17-20.
[13]Mata R,Bye R,Linares E,et al.Phytotoxic compounds from Flourensia cernua[J].Phytochemistry,2003,64(1):285-291.
[14]彭文文.灰葡萄孢培养滤液的生物活性及其影响因素[D].西北农林科技大学硕士学位论文,2005.
[15]Vischetti C,Esposito A.Degradation and transformation of a potential natural herbicide in three soils[J].Journal of Agricultural and Food Chemistry,1999,47(9):3901-3904.

