肺炎链球菌自溶素LytA小片段免疫活性的研究
邹 琴,杨 光,罗 红*,宫晓红,孙文平
(1.大连医科大学临床免疫与微生物教研室,辽宁 大连 116044;2.大连市中医医院,辽宁 大连 116013)
肺炎链球菌(Streptococcus pneumoniae,S.pn)是社区获得性肺炎的主要病原体,可以发生自然转化[1],根据其荚膜多糖抗原性的不同分为90多种血清型,其中约20种血清型对人体有致病性,可引起脑膜炎、中耳炎、鼻窦炎等多种疾病[2-3]。近年来肺炎链球菌耐药的普遍性和多重耐药趋势逐渐升高,开发新的药物和蛋白疫苗进行感染的治疗和预防成为研究热点[4-6]。肺炎链球菌自溶素(N-乙酰胞壁酰-L-丙氨酸酰胺酶,LytA)是肺炎链球菌细胞壁降解酶之一[7],其编码基因在不同血清型之间具有高度保守性[8-9],编码蛋白可以覆盖几乎所有血清型,而且具有免疫活性及溶菌效应,有可能成为新的疫苗靶点及抗菌药物[10-12]。根据GenBank中收录的肺炎链球菌M66菌株的lytA序列设计引物,扩增ATCC49619菌株相应基因片段,以常用的BamHⅠ、HindⅢ酶切后出现新的小片段,通过原核表达技术获得该段基因表达的蛋白,初步研究其免疫活性,为进一步应用于疫苗及相关研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株 肺炎链球菌标准菌株(ATCC49619)由卫生部临床检验中心提供。
1.1.2 主要试剂 细菌基因组DNA提取试剂盒(上海华舜生物工程有限公司),限制性内切酶BamHⅠ、HindⅢ、T4 DNA 连接酶、DNA Marker、蛋白Marker、DNA凝胶回收试剂盒(TaKaRa公司),大肠埃希菌DH5α、表达菌株BL21(DE3)感受态、HRP-羊抗鼠IgG(Novagen公司),克隆载体PGM-T、质粒提取纯化试剂盒(天根生化科技有限公司),表达载体PET-32α(本实验室保存),化学发光底物Super-Signal ECL(Pierce公司),纯化蛋白LytA'免疫血清为本实验室自制(抗体效价1∶32)。
1.2 方法
1.2.1 肺炎链球菌自溶素基因扩增、克隆 根据GenBank中肺炎链球菌M66菌株lytA基因全序列(FN549899.1),设计上下游引物:P1为 5'-GGGGGATCCATGGAAATTAATGTGAGT-3',P2 为5'-GGGAAGCTTTTTTACTGTAATCAAGCCATC-3',斜体部分为引入的BamHⅠ和HindⅢ酶切位点,引物由 TaKaRa公司合成。提取肺炎链球菌(ATCC49619)基因组DNA,PCR反应扩增目的片段(95℃ 4 min;95℃ 30 s、56℃ 30 s、72℃ 1 min、30个循环;72℃ 7 min),反应产物经1%琼脂糖凝胶电泳鉴定。切胶回收,构建克隆质粒PGM-T/lytA',测序由TaKaRa公司完成。
1.2.2 重组表达质粒的构建与鉴定 测序正确的克隆质粒用BamHⅠ、HindⅢI双酶切,将出现的约500 bp小片段切胶回收,与pET-32α(+)载体酶切后的片段16℃过夜连接,转化至感受态细胞E.coli DH5α,于LB/Amp平板上挑取单个克隆培养后,抽提质粒进行双酶切鉴定并再次测序,构建重组表达质粒pET-32α(+)/lytA'。
1.2.3 重组表达质粒的诱导表达与纯化 将鉴定正确的重组表达质粒转化至感受态细胞E.coli BL21(DE3),涂布于LB/Amp平板,筛选阳性克隆接种于LB/Amp液体培养基,37℃培养至对数生长期(A600值为0.6 ~0.8),加入终浓度为1 mmol/L 的IPTG,25℃诱导4 h;4℃离心收集菌体,加入裂解液超声破碎,4℃离心收集上清和沉淀,分别进行SDS-PAGE电泳。用透析袋等电点洗脱法回收纯化蛋白LytA'并定量分析,保存于-80℃冰箱。
1.2.4 免疫血清制备 取6只BALB/c小鼠,雌雄各半,18~20 g,5~6周龄(大连医科大学实验动物中心提供)。LytA'免疫血清制备程序:首次免疫每只小鼠腹股沟皮下注射LytA'0.2 mg;分别于第14及第21天加强免疫,每只皮下注射0.2 mg。末次免疫后第5天摘取小鼠眼球进行采血,分离血清,与纯化蛋白进行双向免疫扩散试验,测定抗体效价后于-20℃冰箱冻存备用。
1.2.5 表达产物 Western blot分析 将纯化的LytA'蛋白按常规方法进行SDS-PAGE电泳后转到NC膜上,以上述免疫血清作为一抗,HRP-羊抗鼠IgG为二抗,ECL显影。
2 结果与分析
2.1 肺炎链球菌自溶素基因的扩增、克隆
lytA全序列扩增产物约950 bp处可见特异性条带(图1),与预期结果(956 bp)相符。重组克隆质粒PGM-T/lytA测序结果与GenBank中M66菌株的基因序列符合率为98%,不同之处主要位于444~466 bp,肺炎链球菌ATCC49619菌株新增了一个BamHⅠ酶切位点(GGATCC),PGM-T/lytA经BamHⅠ、HindⅢ双酶切后出现3条带(图2)。

图1 肺炎链球菌lytA的PCR扩增电泳图Fig.1 PCR amplification of lytA of S.pn

图2 重组质粒PGM-T/lytA酶切图Fig.2 Restriction enzyme analysis of recombinant plasmid PGM-T/lytA
2.2 重组表达载体的构建及鉴定
构建的小片段自溶素的重组表达质粒pET-32α(+)/lytA'经 BamHⅠ、HindⅢ双酶切后显示约500 bp目的片段。序列测定结果显示该片段基因与肺炎链球菌ATCC49619菌株的克隆质粒PGMT/lytA相应部分符合率为100%,未出现变异。
2.3 重组表达质粒诱导表达与纯化
小片段自溶素的重组表达质粒 pET-32α(+)/lytA'经IPTG诱导后,在相对分子质量(Mr)约20 ku处有明显的蛋白表达条带(图3),该蛋白主要以可溶性上清形式存在,用等电点洗脱法纯化后电泳显示为单一蛋白条带(图4)。
2.4 免疫血清制备
LytA'免疫小鼠血清抗体效价为1∶32,所获得的目的蛋白具有较好的免疫原性。
2.5 Western blot分析
LytA'与相应抗体发生特异性结合,相对分子质量约20 ku处出现明显印迹反应带(图5),该目的蛋白具有较好的抗体结合活性。
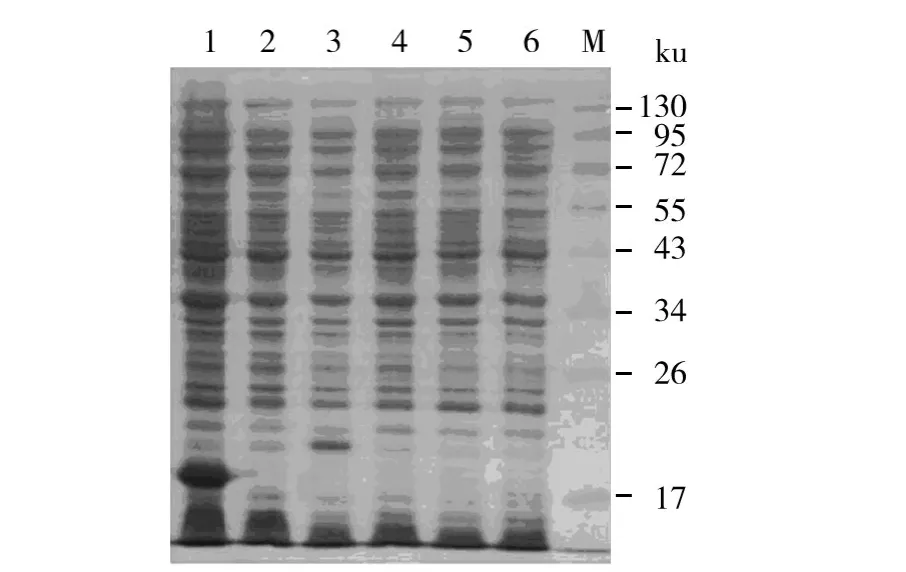
图3 重组表达质粒pET-32α(+)/lytA'的IPTG诱导结果Fig.3 Analysis of the products expressed by pET-32α(+)/lytA'with IPTG induction

图4 纯化蛋白LytA'的SDS-PAGE电泳图Fig.4 SDS-PAGE profile of purified protein LytA'
3 讨论
肺炎链球菌自溶素是肺炎链球菌的主要毒力因子之一,在不同血清型的肺炎链球菌中具有高度保守性,这一特性作为疫苗靶点可以预防不同血清型引起的感染,而且作为蛋白质,可以诱导T细胞依赖性免疫应答,产生免疫记忆,克服了多糖疫苗的局限性[13]。通过基因工程技术获取重组蛋白,不但可以大量获得而且便于分子结构的修饰改良,本研究证明了肺炎链球菌自溶素LytA其中的一个小片段可以通过原核表达技术获得,初步证明具有免疫原性和抗体结合活性,为进一步应用于血清学诊断和疫苗靶点研究奠定基础。
GenBank中尚未收录ATCC49619菌株的自溶素序列,本研究参照已公布的肺炎链球菌M66菌株自溶素序列(FN549899.1)设计引物,成功扩增克隆了肺炎链球菌ATCC49619菌株的956 bp自溶素全片段,所构建的克隆质粒测序结果和M66菌株基因序列同源性为98%,证明了lytA基因序列的保守性。碱基变异的区域主要集中在444~466 bp之间,而且在此区域内碱基的变异恰巧形成了一个BamHⅠ酶切位点,这就提示如果利用ATCC49619菌株表达整段的自溶素蛋白,就需要避免用BamHⅠ酶进行克隆质粒的酶切。本研究中利用BamHⅠ酶切位点来构建小片段自溶素重组表达质粒,成功表达出分子量约20 ku的自溶素蛋白片段,相比于全段rLytA(分子量约56 ku),小分子量蛋白片段用于药物及疫苗靶点可能更具有优势,而且和抗体结合时有利于减少空间位阻,通过免疫小鼠及Western blot实验证明该蛋白具有免疫原性和抗体结合活性,具有应用于疫苗及血清学诊断的可能性。通常以pET32α(+)载体构建的表达质粒,表达出来的是一种融合蛋白,在目的蛋白的N末端融合有分子量约20 ku的硫氧还原蛋白,本实验中的目的蛋白虽然分子量约为20 ku,但所构建的表达质粒经过测序,证实为自溶素的片段,并非是硫氧还原蛋白,具有不必切除硫氧还原蛋白,直接应用于相关研究的优势。
[1]孟江萍,尹一兵,涂植光,等.肺炎链球菌转化模型的建立与优化[J].微生物学杂志,2006,26(1):10-13.
[2]Zhao GM,Black S,Shinefield H,et al.Serotype distribution and antimicrobial resistance patterns in Streptococcus pneumoniae isolates from hospitalized pediatric patients with respiratory infections in Shanghai,China[J].Pediatr Infect Dis,2003,22(8):739-742.
[3]Barzilay EJ,O’Brien KL,Kwork YS,et al.Could a single dose of pneumococcal conjugate vaccine in children be effective?Modeling the optimal age of vaccination[J].Vaccine,2006,24(7):904-913.
[4]Susana Campuzano,María Pedrero,José L.García,et al.Development ofamperometricmagnetogenosensorscoupled to asymmetric PCR for the specific detection of Streptococcus pneumoniae[J].Anal Bioanal Chem,2011,399(7):2413-2420.
[5]R.Bhatia,K.Harris,J.Hartley,et al.Serial PCR genetic load determination in the surgical management of pneumococcal intracranial sepsis[J].Childs Nerv Syst,2012,28(4):515-520.
[6]Maria del Mar Garcia-Suarez,Maria Dolores Cima-Cabal,Roberto V,et al.Performance of a pneumolysin enzyme-linked immunosorbent assay for diagnosis of pneumococcal infections[J].J Clin Microbiol,2007,45:3549-3554.
[7]Regine H,Abderrahim M,Dalia D,et al.Versatility of choline metabolism and choline-binding proteins in streptococcus pneumonia and commensal streptococci[J].FEMS Microbiol Rev,2009,33(3):572-586.
[8]Adrian M.Whatmore and Christopher G.Dowson.The Autolysin-Encoding Gene(lytA)of Streptococcus pneumoniae Displays Restricted Allelic Variation despite Localized Recombination Events with Genes of Pneumococcal Bacteriophage Encoding Cell Wall Lytic Enzymes[J].Infection and Immunity,1999,67(9):4551-4556.
[9]Bogaert D,Hermans PWM,Adrian PV,et al.Pneumoccal vaccines:an update on current strategies[J].Vaccine,2004,22(17):2209-2220.
[10]Peter Mellroth,Robert Daniels,Alice Eberhardt,et al.LytA,major autolysin of Streptococcus pneumoniae,requires access to nascent peptidoglycan[J].The Journal of Biological Chemistry,2012,287(14):11018-11029.
[11]Violeta Rodriguez-Cerrato,Pedro Garcia,Lorena Huelves,et al.Pneumococcal LytA Autolysin,a Potent Therapeutic Agent in Experimental Peritonitis-Sepsis Caused by Highlyβ-Lactam-Resistant Streptococcus pneumoniae[J].Antimicrob Agents Chemother,2007,51(9):3371-3373.
[12]María Morales,Pedro García,Adela G.de la Campa,et al.Evidence of localized prophage-host recombination in the lytA gene,encoding the major pneumococcal autolysin[J].J.Bacteriol,2010,192(10):2624.
[13]Yuan ZQ,Lv ZY,Gan HQ,et al.Intranasal immunization with autolysin(LytA)in mice model induced protection against five prevalent Streptococcus Pneumoniae serotypes in China[J].Immunologic Research,2011,51(1):108-115.

