聚乙二醇干扰素联合利巴韦林治疗慢性丙型肝炎患者疗效及其影响因素分析*
李剑萍,关玉娟,洪文昕,范浰婴,潘能浪,杨可立
据世界卫生组织统计,丙型肝炎呈全球性流行趋势,估计约1.7亿人感染了HCV,慢性丙型肝炎患者约有4000万[1],其中20%~30%患者可发展为肝硬化,甚至肝癌,对人类健康的危害极大。近年来,聚乙二醇干扰素(PEG-IFN)和利巴韦林(RBV)被认为是治疗慢性丙型肝炎最有效的药物,联合治疗优于单药治疗[2]。本文对我院近六年收治的331例慢性丙型肝炎患者的抗病毒疗效及其影响因素进行了临床分析,现报道如下。
1 资料与方法
1.1 病例来源 2005年6月至2011年6月我院诊治的慢性丙型肝炎患者287例 [男性161例,女性126例;平均年龄为(38.7±13.9)岁],慢性丙型肝炎合并脂肪肝30例[男性19例,女性11例;平均年龄为(45.1±11.5)岁],代偿期丙型肝炎肝硬化14例[男性9例,女性5例;平均年龄为(38.7±13.8)岁]。诊断符合2004年发布的《丙型肝炎防治指南》[2]。所有患者均符合下列入选条件:血清HCV RNA≧1000 IU/ml,ALT正常或异常。排除妊娠或哺乳期妇女、失代偿期肝硬化、合并HBV和HIV感染、自身免疫性肝病、精神性疾病、恶性肿瘤、代谢性疾病和有酗酒史等。
1.2 治疗方法 给予PEG-IFN alpha-2a(派罗欣,上海罗氏制药有限公司)180μg或135μg皮下注射,1次/w。当外周血中性粒细胞数低于0.75×109/L且大于或等于0.50×109/L时,将干扰素剂量由180μg/w调至135μg/w或自135μg/w调至90μg/w;当外周血中性粒细胞数低于0.50×109/L时,暂停1~2次干扰素注射,同时使用重组人粒细胞集落刺激因子注射液(瑞血新,北京四环生物制药),待中性粒细胞数回升至0.75×109/L时再恢复原干扰素用量。给予利巴韦林胶囊(浙江诚意药业有限公司)900~1200 mg/d,口服。疗程48~72 w(对患者在24 w血清HCV RNA未转阴者,则延长疗程至72 w),随访24 w。
1.3 检测方法 采用酶联免疫吸附法检测血清抗-HCV(广州中山生物工程公司);采用荧光定量聚合酶链反应法测定HCV RNA(中山大学达安基因股份有限公司试剂盒);采用丙型肝炎病毒分型特异性引物及荧光探针和一步法聚合酶链式反应结合Taqman技术对丙型肝炎病毒进行1型和非1型分型检测(上海之江生物科技股份有限公司);采用全自动生化分析仪检测肝功能(日本OLYMPUS AU 2700)。
1.4 疗效判定 生物化学应答:血清ALT水平低于1倍正常值(40 U/mL)上限;病毒学应答包括:①快速病毒学应答(RVR):在治疗4周时HCV RNA定量小于最低检测限(HCV RNA<1×103IU/ml);②早期病毒学应答(EVR):在治疗12周时HCV RNA定量检测小于最低检测限(HCV RNA<1×103IU/ml),或定量检测降低2个对数级以上;③治疗结束时病毒学应答(ETVR):即治疗结束时定量检测HCV RNA小于最低检测限(HCV RNA<1×103IU/ml);④持续病毒学应答(SVR):在治疗结束随访24周时,HCV RNA定量检测小于最低检测限(HCV RNA<1×103IU/ml)。
1.5 统计学分析 采用SPSS13.0软件进行统计学处理,对计量资料采用t检验,对计数资料采用x2检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 在本组患者中,有输血史者 132例,有手术史者17例,有输血史并有手术史者30例,有吸毒者史者27例,不洁拔牙史及纹身史者各5例,冶游史2例及血液透析病史2例,无明显诱因者111例。在331例中有310例完成48周疗程,18例患者因24周HCV RNA未转阴,延长疗程至72周。所有患者均完成停药后24周随访。
2.2 疗效情况 本组资料表明,在331例CHC患者中,获得 RVR、EVR和SVR分别为 65%(215/331)、94.9%(314/331)和84.9%(281/331);获得 SVR与性别构成、治疗前ALT水平及基因分型无明显相关,与患者年龄、感染HCV病程、治疗前HCV RNA水平及RVR和EVR密切相关。2.3基因分型情况 在331例中有176例行基因分型,其中基因1型为108例(61.4%),非基因1型为68例(38.6%)。基因1型与非基因1型感染患者基线资料比较,两组仅性别比较有统计学意义(P<0.05),但年龄、ALT、AST和HCV RNA定量比较无显著性差异(P>0.05,表1)。

表1 176例慢性丙型肝炎患者基线特征
2.4 不同HCV基因型感染患者病毒学应答率的比较 基因1型与非基因1型组比较,非基因1型感染患者RVR显著高于基因1型者(P<0.05),但两组EVR、ETVR及SVR比较均无明显差异(P>0.05,表2)。
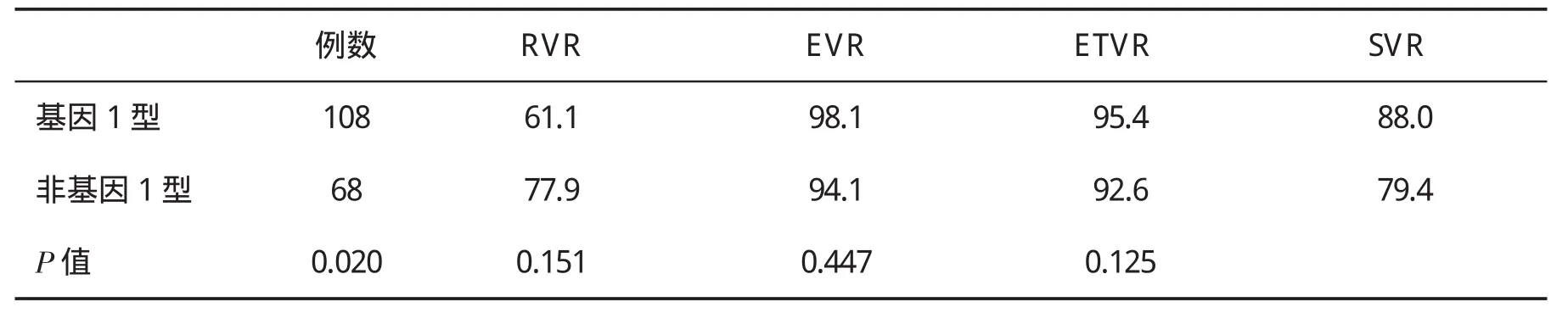
表2 不同HCV基因型感染者病毒学应答率(%)的比较
2.5 病毒载量与疗效的关系 依据HCV RNA基线水平,将患者分为低病毒载量组(≤4×105IU/ml)和高病毒载量组(>4×105IU/ml),比较慢性丙型肝炎患者基线不同HCV RNA水平与疗效的关系。结果发现,低病毒载量组患者RVR、ETVR和SVR均显著高于高病毒载量组(P<0.05),而两组EVR及生化学应答率均无明显差异(P>0.05,表3)。

表3 不同病毒载量组患者疗效(%)比较
2.6 治疗前不同ALT水平患者病毒学应答率的比较 将ALT水平分为高水平(>80 u/L)和低水平(≤80 u/L)两组,结果显示,治疗前ALT水平的高低与长效干扰素抗病毒的疗效无相关性(P>0.05,表4)。
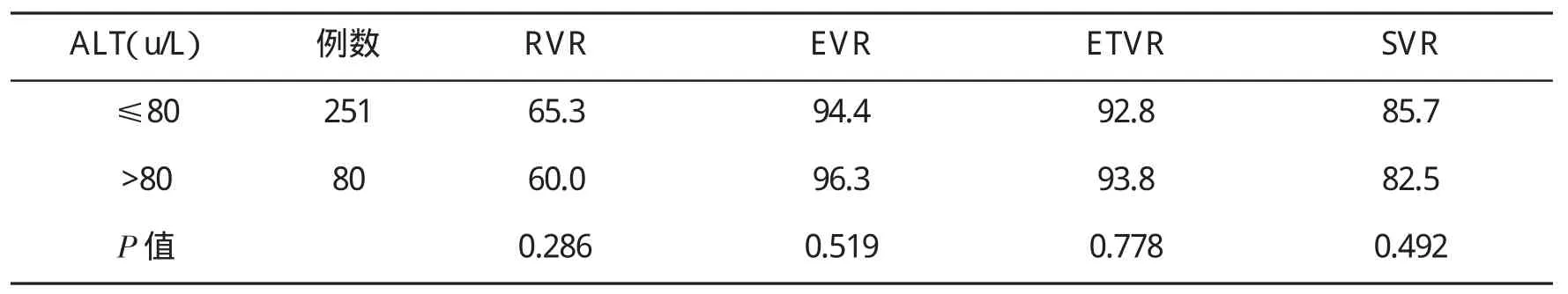
表4 治疗前不同ALT水平患者病毒学应答率(%)的比较
2.7 RVR、EVR与SVR的关系 将患者分为RVR和非RVR组,结果显示RVR组SVR明显高于非RVR组(x2=28.099,P=0.000);EVR组SVR明显高于非 EVR组(x2=63.194,P=0.000,表5)。

表5 早期病毒学应答对SVR(%)的影响
2.8 SVR与非SVR组患者基线资料的比较 结果显示,两组在性别构成、治疗前ALT水平方面无明显差异(P>0.05),获得SVR的患者年龄显著低于非SVR者(表6)。2.9慢性丙型肝炎合并疾病对疗效的影响 在30例合并脂肪肝的患者中,有22例患者获得SVR(73.3%);在14例代偿期丙型肝炎肝硬化患者中,有11例患者获得SVR(78.5%)。两组患者SVR均低于本组总体患者SVR的84.9%,但因病例数少,未进行统计学分析。
表6 获得SVR与未获得SVR患者基线资料(±s,或例)的比较
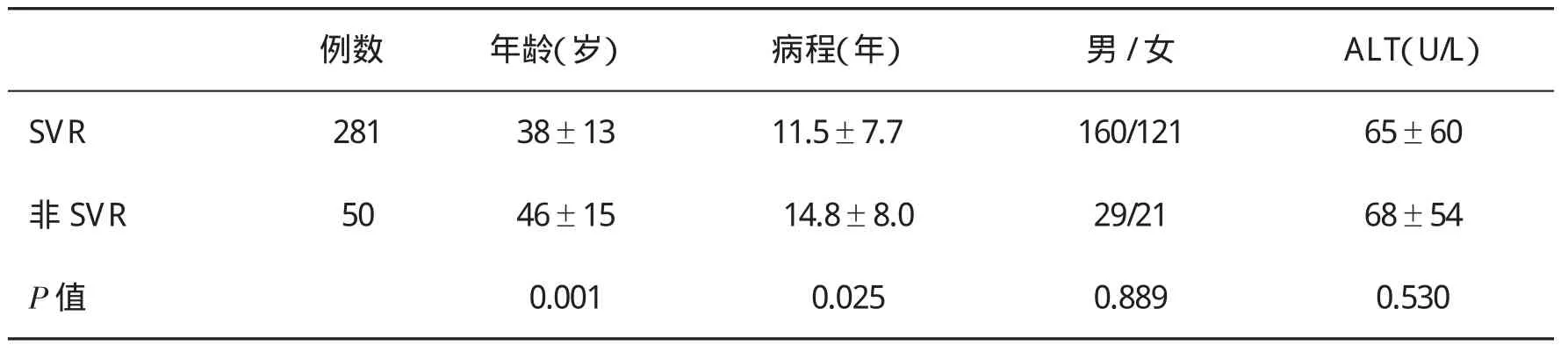
表6 获得SVR与未获得SVR患者基线资料(±s,或例)的比较
?
3 讨论
目前公认治疗慢性丙型肝炎的标准方案为PEG-IFN-α联合利巴韦林治疗24周或48周,治疗时间取决于HCV基因型及治疗反应。在本研究中,331例CHC患者全部使用PEG-IFN-α-2a联合利巴韦林方案。结果显示,RVR、EVR和SVR分别为65%、94.9%和84.9%。
本研究对176例患者行基因分型检测,结果基因1型108例(61.4%),非基因1型68例(38.6%)。两组SVR分别为79.4%和88.0%,无统计学差异。本组资料提示本组HCV基因分型仍是以基因1型为主,与国内李志勤等报道一致[3],但基因1组和非基因1组患者SVR无显著差异,提示基因型不是预测抗病毒疗效的唯一因素,这与南月敏等报道一致[4]。国外文献报道HCV基因1型或4型感染者疗效降低[5,6]。国外McHutchison JG et al[7]报道对基因1型CHC患者使用PEG IFN-α-2a联合利巴韦林抗病毒治疗,SVR仅达40.9%,明显低于本组基因1型CHC的SVR,显示PEG IFN联合利巴韦林对于中国基因1型丙型肝炎疗效更好,考虑可能与亚洲人尤其是中国人群IL28B rs12979860等位基因CC的比例较大有关[8],而该基因型是发生SVR的强预测因素[9~13]。
最新的丙型肝炎防治指南[2]指出,只要HCV RNA阳性,即使ALT正常的患者也应给予积极的抗病毒治疗。在本研究中,治疗前丙型肝炎患者ALT活性与治疗后患者RVR、EVR及SVR的发生率均无直接相关性,与既往报道一致[14]。HCV RNA在血清中的水平是预测干扰素疗效的重要因素之一。患者的病毒负荷量越低,对干扰素治疗的应答率越高。本组治疗4周时RVR和治疗结束时ETVR及SVR结果显示,低病毒载量组明显高于高病毒载量组(P值均小于0.05),与国内朱义玲报道HCV低水平组的疗效优于高水平组一致[15],但两组EVR却无明显差异(P值大于0.05),表明RVR比EVR能更好地预测SVR。
快速、早期病毒学应答对预测SVR有重要的价值[16,17]。本研究结果表明,RVR组SVR明显高于非RVR组,EVR组SVR明显高于非EVR组,两组比较均有显著差异(P<0.05),提示HCV RNA水平是预测干扰素疗效的重要指标之一。在临床治疗方案的制定中,对高病毒载量者,应当给予高度的重视,观测其基线资料、RVR、EVR、ETVR四个重要的预测指标[18,19],根据个体化的应答制定合理的治疗疗程,以增加患者获得SVR的几率。
通过对长效干扰素联合利巴韦林治疗后SVR与无SVR者进行有关指标的分析,发现两组患者在年龄、感染丙型肝炎时间有显著差异(P<0.05),但在性别、治疗前ALT水平比较无显著性差异(P>0.05)。我们还发现,18例CHC患者在治疗24周时HCV RNA未转阴,经延长治疗至72周,其中仍有14例患者达到SVR(77.8%),说明通过延长治疗可提高疗效[20]。
我们观察到获得持续病毒学应答的患者较未获得持续病毒学应答的患者具有以下五个特征:年龄偏小、感染丙型肝炎时间较短、较低的病毒学水平、较高的RVR和EVR,与国内外近年来报道的结果一致,说明将患者年龄、感染时间、治疗前HCV RNA水平和治疗过程中RVR、EVR作为预测长效干扰素联合利巴韦林治疗的疗效有一定的依据[21]。
[1]中华医学会传染病与寄生虫病学分会、肝病学分会.病毒性肝炎防治方案.中华肝脏病杂志,2000,8:324-329.
[2]中华医学会肝病学分会,中华医学会传染病与寄生虫病学分会.丙型肝炎防治指南.中华传染病杂志,2004,2:131-136.
[3]李志勤,武淑环,余祖江,等.387例丙型肝炎患者流行病学及临床特征研究.中华医院感染学杂志,2011,11:2255-2257.
[4]南月敏,郑欢伟,孙殿兴,等.慢性丙型肝炎个体化方案的临床研究.中华肝脏病杂志,2013,21:23-26.
[5]Yu ML,Chuang WL.Treatment of chronic hepatitis C in Asia:when east meets west.J Gastroenterol Hepatol,2009,24:336-345.
[6]Jensen DM,Morgan TR,Marcellin P,et al.Early identification of HCV genotype 1 patients responding to 24 weeks peginterferon alpha-2a(40 kd)/ribavinrin therapy.Hepatology,2006,43:954-960.
[7]McHutchison JG,Lawitz EJ,Shiffman ML,et al.Peginterferon alfa-2b or alfa-2a with ribavirin for treatment of hepatitis C infection.N Engl J Med,2009,361:580-593.
[8]Shi XD,Pan Y,Wang M,et al. ⅠL-28B genetic variation is associated with spontaneous clearance of hepatitis C virus,treatment response to serum ⅠL-28 levels in Chinese population.PLoS One,2012,7(5):e37054.
[9]Ge D,Fellay J,Thompson AJ,et al.Genetic variation in ⅠL28B predicts hepatitis C treatment-induced viral clearance.Nature,2009,461:399-401.
[10]Tanaka Y,Nishida N,Sugiyama M,et al.Genome-wide association ofⅠL28B with response to pegylated interferon-alpha and ribavirin therapy for chronic hepatitis C.Nat Genet,2009,41:1105-1109.
[11]Suppiah V,Moldovan M,Ahlenstiel G,et al. ⅠL28B is associated with response to chronic hepatitis C interferon-alpha and ribavirin therapy.Nat Genet,2009,41:1100-1104.
[12]Mangia A,Thompson AJ,Santoro R,et al.An ⅠL28B polymorphism determines treatment response of hepatitis C virus genotype 2 or 3 patients who do not achieve a rapid virologic response.Gastroenterology,2010,139:821–827,827 e1.
[13]Yu ML,Huang CF,Huang JF,et al.Role of interleukin-28B polymorphisms in the treatment of hepatitis C virus genotype 2 infection in Asian patients.Hepatology,2011,53:7-13.
[14]何伶俐,陈竹,陈杨,等.聚乙二醇干扰素联合利巴韦林治疗慢性丙型肝炎的疗效及其影响因素.中华肝脏病杂志,2011,19:34-37.
[15]朱义玲,陈丽,赵卫峰,等.聚乙二醇干扰素联合利巴韦林治疗慢性丙型肝炎的疗效观察.实用肝脏病杂志,2012,15:123-125.
[16]Yu JW,Wang GQ,Sun LJ et al.Predictive value of rapid virological response and early virological response on sustained virological response in HCV patients treated with pegylated interferon a-2a and ribavirin.Hepatology,2007,22:832-836.
[17]李明慧,陈利军,邱国华,等.快速病毒学应答对干扰素治疗慢性丙型肝炎疗效的预测分析.中华肝脏病杂志,2009,17:497-500.
[18]Fried M.Response-guided telaprevir combination treatment for hepatitis C virus infection.N Engl J Med,2002,347:975-981.
[19]Ferenci P.Predicting sustained virological responses in chronic hepatitis C patients treated with peginterferon alfa-2a(40 KD)/ribavirin.J Hepatol,2005,43:425-433.
[20]Zhang YH,Guo DD,Zhao Y,et al.The effect of cytokine profiles on the viral response to re-treatment in antiviral-experienced patients with chronic hepatitis C virus infection.Antiviral Res,2011,92(2):247-254.
[21]Lee SS.Prognostic factors and early predicatabiliy of sustained viral response with pegylated interferon alfa-2 a(40 KD).J Hepatol,2002,37:500-506.

