动态对比增强MRI在腮腺肿瘤中的诊断应用评价
张跃海 孔令伟 高源统 贾 庆 张 刚.浙江省瑞安市人民医院放射科,浙江瑞安 3500;.内蒙古医科大学附属医院MR室,内蒙古呼和浩特 00059
腮腺瘤是人体头颈部位比较常见的肿瘤,其病理类型非常复杂,且临床表现特异性极差,因此给临床腮腺瘤的诊断带来了极大的困难,尤其是对于恶性腮腺瘤。临床上对腮腺瘤进行准确的定性诊断,制订相应的治疗方案和对预后情况分析非常关键,同时减少其并发症的发生也异常重要[1-2]。在临床诊断中,CT检查对于肿瘤的定位比较有效,但对于肿瘤的定性,CT检查与MRI检查相差甚远[3]。从以往的文献研究结果来看,动态对比增强MRI获取的腮腺瘤数据比较丰富,因此对于临床的腮腺瘤诊断来说,是比较准确的诊断方法。但是,目前MRI检查的临床诊断标准还未统一,临床研究在数据支持上也存在问题,所以还需在MRI检测资料与病理结果的对比分析上得出比较准确的结论[4]。本研究收集了瑞安市人民医院和内蒙古医科大学附属医院经病理证实的腮腺肿瘤患者60例,对良恶性肿瘤的MRI形态学特征、时间信号曲线类型、增强峰值时间等进行了对比研究,现总结报道如下:
1 资料与方法
1.1 一般资料
选择2011年7月~2012年12月瑞安市人民医院和内蒙古医科大学附属医院腮腺肿瘤患者60例为研究对象,病灶总数为65个。其中良性肿瘤29例(良性组),占48.3%,病灶总数为31个。男12例,女17例;年龄 11~69 岁,平均(39.2±14.6)岁。 恶性肿瘤 31 例(恶性组),占 51.7%,病灶总数为 34 个;男 16 例,女15 例;年龄 12~67 岁,平均(37.4±13.6)岁。 两组性别、年龄比较差异无统计学意义(P>0.05),具有可比性。所有入选患者均经病理证实。
1.2 方法
采用西门子1.5 T高场磁共振,相控阵头部线圈,层厚 0.3~3 mm,层间距 0.5~0.6 mm, 增强造影剂用Gd-DTPA,造影剂用量0.2 mL/kg。扫描方法为:经肘静脉注射造影剂6 s后,连续反复扫描5 min以上,连续采集数据,获取时间-信号强度曲线技术参数。
1.3 观察指标和评价方法
观察指标包括:①MRI形态学特征:动态对比增强MRI扫描的肿瘤形状、边缘、信号均匀性,周围组织受侵与否、T2WI信号强度(低信号、等信号、高信号);②时间信号曲线类型[5]:包括持续型(峰值时间>120 s)、廓清型(峰值时间均≤ 120 s,廓清率≥ 0.3%和<0.3%)、平坦型;③增强峰值时间;④与病理结果对照分析动态对比增强MRI诊断腮腺肿瘤的敏感度、特异度、准确度。扫描收集到的数据使用双盲法诊断,由两位MRI专业主治职称以上的医生进行判定,两人意见一致予以采用,不一致请主任或副主任医师会诊。
1.4 统计学方法
采用SPSS 17.0统计学软件进行数据分析,计量资料数据用均数±标准差(±s)表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者MRI形态学特征对比分析
良性组MRI形态规则、边缘清楚、信号均匀、周围组织不受侵、T2WI为高信号者占多数,与恶性组比较差异有高度统计学意义(P<0.01);恶性组以形态不规则、边缘不清、信号不均匀、周围组织受侵、T2WI为低信号和等信号者占多数,与良性组比较差异有高度统计学意义(P < 0.01)。 见表1、图 1。
2.2 两组MRI动态增强特点、时间信号曲线类型、峰值时间比较
良性组的时间信号曲线类型以持续型、廓清型廓清率≥0.3%、平坦型者多见,与恶性组比较差异有统计学意义(P<0.05),恶性组以廓清型廓清率<0.3%者多见,与良性组比较差异有高度统计学意义(P<0.05)。良性组的MRI增强峰值时间大于恶性(P<0.05)。见表2、图 2。
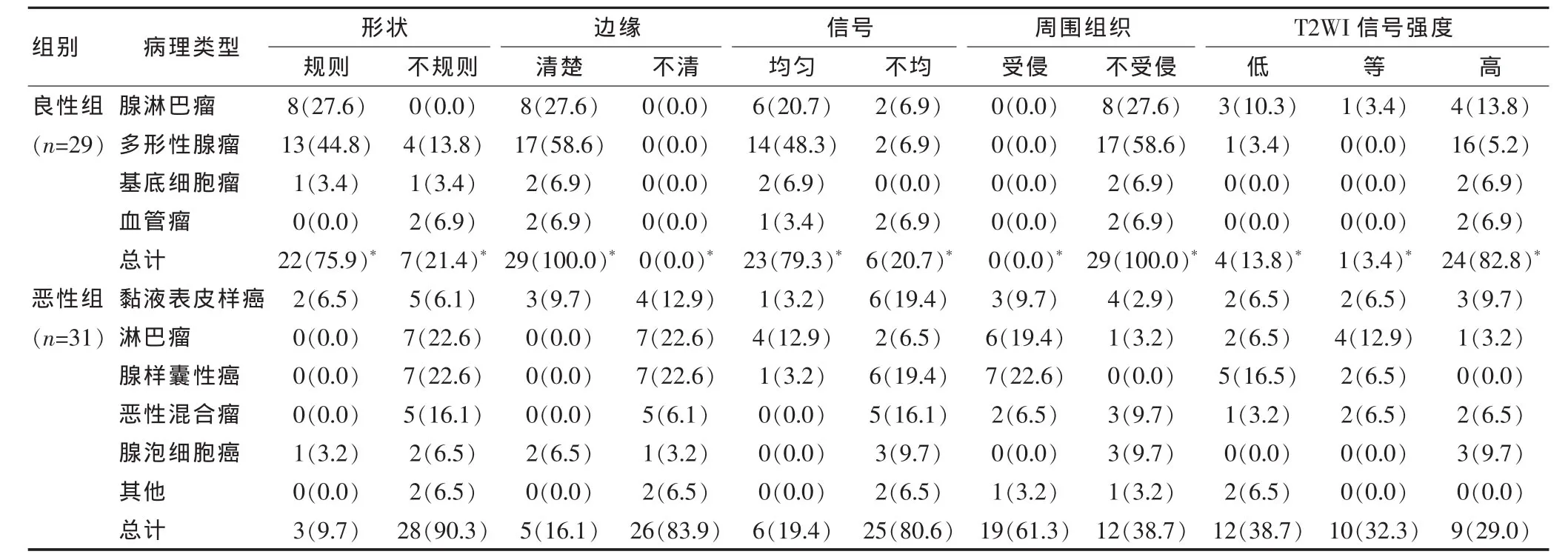
表1 两组MRI形态学特征对比分析[n(%)]
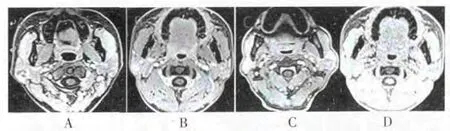
图1 良恶性腮腺肿瘤MRI形态学特征
2.3 MRI平扫形态学和动态对比增强MRI诊断腮腺良恶性肿瘤的高敏感度、特异度、准确度比较分析
根据MRI平扫形态学诊断腮腺恶性肿瘤的准确度、敏感度、特异度分别为90.3%、80.0%和88.0%;根据边缘其准确度、敏感度、特异度分别为83.9%、100.0%和85.3%;根据信号均匀与否其准确度、敏感度、特异度分别为80.6%、80.6%和79.3%;根据周围组织是否受侵其准确度、敏感度、特异度分别为61.3%、100.0%和70.7%;根据T2信号诊断其准确度、敏感度、特异度分别为71.0%、81.5%和72.7%。其中1例多形性腺瘤形态不规则,T2为低信号,增强峰值时间为118 s,廓清率为0.34%,MRI诊断结果偏向恶性肿瘤可能,病理诊断腺淋巴瘤,结果不符合,总计病理符合率为98.33%,时间信号曲线诊断腮腺恶性肿瘤的敏感度、特异度、准确度较好,分别为100.0%、99.6%、100.0%。见表3。
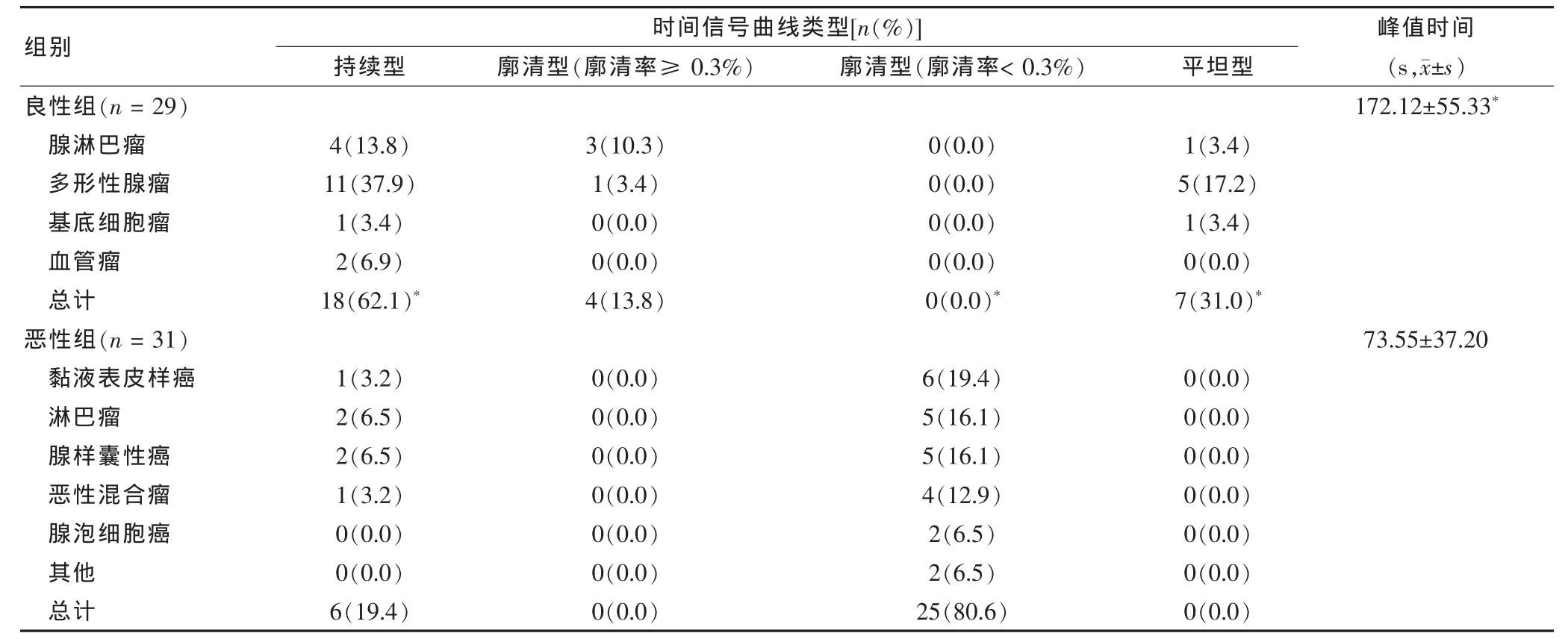
表2 良恶性腮腺肿瘤MRI动态增强特点、时间信号曲线类型、峰值时间比较

图2 腮腺良恶性肿瘤的时间信号曲线类型
3 讨论
3.1 腮腺肿瘤MRI形态学特征
从病理分型角度说,腮腺瘤十分复杂。从临床的统计结果来看,良性肿瘤比较多,恶性肿瘤较少[6]。腮腺肿瘤95%以上是上皮性肿瘤,包括腺淋巴瘤、混合瘤、多形性腺瘤、黏液表皮样癌、腺样囊性癌、恶性混合瘤、基底细胞腺瘤、腺泡细胞癌等;其余大多为间叶组织腮腺瘤[7],包括淋巴瘤、脂肪瘤、淋巴管瘤、血管瘤等。良性的上皮性肿瘤与间叶组织性肿瘤的MRI表现是非常不同的。良性上皮性肿瘤一般都是形状规则,边缘清晰,具有包膜组织。而且,不同类型的腮腺瘤,其T2WI信号以及增强扫描强度也是不同的。本研究结果显示,在60例腮腺瘤患者中,良性肿瘤29例,占48.33%;恶性肿瘤31例,占51.77%。因为本研究在病例筛选选过程中剔除了脂肪瘤、腮裂囊肿等CT检查或MRI平扫就基本能确诊的肿瘤,故本组病例良性肿瘤所占比例相对较少。腮腺肿瘤进行准确的定性诊断是临床制订治疗方案的关键,同时也是患者预后情况分析的重要基础。目前,术前定性诊断主要是活检,但是活检容易出现包膜破裂,从而最终使得癌细胞发生转移,或者是复发,从而出现严重的事件,因此临床不是经常使用[8]。影像学检查在肿瘤的定性诊断过程中具有非常重要地位[9]。作为一种重要的影像学检查手段,MRI因其能够提供肿瘤的详细检测参数,以及高清图像而受到广泛使用[10]。本组资料统计结果显示,从MRI形态学特征分析良性肿瘤形态规则、边缘清楚、信号均匀、周围组织不受侵、T2WI为高信号占多数,分别为75.9% 、100.0% 、79.3% 、100.0%、82.8%(P < 0.05), 而恶性肿瘤以形态不规则、边缘不清、信号不均匀、周围组织受侵、T2WI为高低和等信号占多数, 分别为 90.3%、83.9%、80.6%、61.3%、38.7%和 32.3%(P < 0.05)。 文献报道,间叶组织性肿瘤的MRI成像特点也是非常具有差异性的,其表现为无包膜和形状的不规则,但边缘清晰,可区分良恶性肿瘤[11]。本组7例腮腺肿瘤的T2WI信号呈现低和等信号现象,但其余都呈现为高信号。上皮性肿瘤的实质性上皮细胞含水的量都比较小,因此导致其分泌物和黏液过多,从而导致了高信号。腺淋巴瘤一般都是些坏死的腺腔,而混合瘤则多是些沙砾状的组织[12],T2呈高信号。基质细胞瘤和血管瘤T2大部分都成高信号。恶性腮腺瘤的T2WI信号不均匀,一般都是低、等信号,高信号者较少。这是因为恶性腮腺瘤具有非常强的侵袭性,而且侵犯的范围比较广,因此癌细胞向周围扩散比较容易[13]。因此,本研究认为MRI形态学特点对腮腺肿瘤的定性诊断具有重要的临床价值。
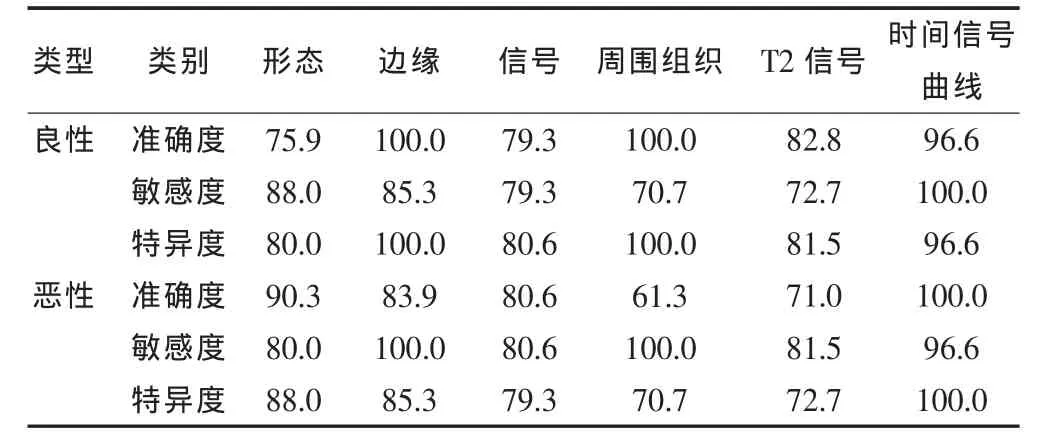
表3 MRI平扫形态学和动态对比增强MRI检查诊断腮腺良恶性肿瘤的高敏感度、特异度、准确度分析(%)
3.2 良恶性腮腺肿瘤MRI动态增强特点、时间信号曲线类型、峰值时间比较
动态对比增强MRI可以获得病灶的时间信号强度曲线,从而获得有关腮腺瘤及毛细血管病变通透性的相关信息,这对阐释腮腺肿瘤的生物学信息是极其重要的。肿瘤的生物学行为与肿瘤血管密切相关,动态对比增强MRI扫描主要是观察腮腺瘤患者出现病变之后的血流动力学变化[14]。对腮腺肿瘤来讲,其动态增强强化的程度和时间主要由肿瘤的血管化程度、细胞外隙、肿瘤内血管的通透性等三个方面决定。肿瘤的血管化程度对肿瘤的早期强化影响非常大,而细胞外隙和肿瘤内血管的通透性主要与后期的强化有关[15]。这主要是因为恶性腮腺瘤的新生血管绝大多数都不是很成熟,血管的内皮细胞一般都不完整,因此通透性非常高。此外,随着细胞密度的增加,细胞外间隙也随着变大[16]。因此,良性腮腺瘤细胞的外间隙都比较小。从MRI扫描的技术角度,腮腺瘤的增强峰值时间与微血管数密切相关,一般情况下,微血管数越多,达到峰值的时间越短。廓清率主要依靠对比剂,如果腮腺瘤细胞外间隙越大[17],说明对比剂滞留其间的时间就越长,因此廓清率就越小;反之,如果腮腺瘤细胞外间隙越小,其廓清率就越高。本组资料显示良性肿瘤的时间信号曲线类型以持续型、廓清型廓清率≥0.3%、平坦型多见,分别占 62.1%、13.8%、31.0%(P <0.05), 恶性肿瘤以廓清型廓清率< 0.3%多见,占80.6%(P < 0.05)。 动态对比增强后,血管瘤的时间信号曲线是持续上升的,而囊性淋巴瘤的时间信号曲线则是比较平坦的。腺淋巴瘤呈轻度增强,混合瘤则呈现中、强度的增强。因此本研究认为良性肿瘤大部分呈持续、逐渐性强化或不强化,时间信号曲线呈持续性或平坦型;而大部分恶性肿瘤血供丰富,部分良性肿瘤的血供相对丰富,动态增强MRI时间信号曲线呈廓清型,但恶性组以廓清率<0.3%多见,良性组以廓清率≥0.3%多见。从肿瘤动态增强峰值时间分析,良性组的MRI增强峰值时间长于恶性组,分别为(172.12±55.33)s和(73.55±37.20)s(P < 0.05);由此可见良性组腮腺肿瘤的峰值时间>120 s,恶性组腮腺肿瘤的峰值时间≤120 s,符合时间信号曲线分型标准。峰值时间>120 s对良性肿瘤诊断价值较高;而峰值时间≤120 s可以是良性或恶性,如果廓清率<0.3%则考虑恶性,廓清率≥0.3%则考虑良性。
3.3 动态对比增强MRI检查诊断腮腺良恶性肿瘤的敏感度、特异度、准确度分析
形状不规则、边缘不清、信号不均匀等MRI图像特征可作为恶性腮腺肿瘤诊断的阳性征象,而形状规则、边缘清晰、信号均匀,可作为腮腺良性肿瘤的征象。部分上皮性肿瘤与间叶组织性肿瘤的MRI形态学存在明显的差异,形状不规则和边缘不清可以作为其定性诊断的依据。时间信号曲线呈持续型及平坦型的MRI相关曲线的腮腺瘤患者提示良性病变;时间信号曲线呈廓清型可以是良性或恶性,结合增强峰值时间和廓清率,对腮腺良恶性肿瘤也可以给予区别。良性组的增强MRI主要表现为渐进性强化、持续强化,而恶性组动态增强MRI以廓清强化多见,为良恶性腮腺瘤的初步诊断提供了依据。本组1例多形性腺瘤形态不规则,T2为低信号,增强峰值时间为118 s,廓清率为0.34%,MRI诊断结果偏向恶性肿瘤可能,病理诊断腺淋巴瘤结果不符合,合计病理符合率为98.33%,其敏感度、特异度、准确度分别为96.7%、93.3%、93.3%。但随着扫描之间的延迟,增强峰值时间到达120 s,诊断的敏感度、特异度和准确度会得到大幅度提升。因此肿瘤的形态学特征和动态增强MRI分型对腮腺良恶性肿瘤的鉴别各有自己的优点,两者结合可提高诊断结果的准确率。
综上所述,动态对比增强MRI对腮腺恶性肿瘤和良性肿瘤的鉴别诊断具有重要的临床价值,值得临床予以推广。
[1]郑少燕,曾向廷,吴先衡,等.腮腺肿瘤的MRI诊断[J].中国医学影像技术,2012,28(4):647-651.
[2]李颖,马林,程流泉,等.腮腺基底细胞腺瘤CT和MRI特点[J].中国医学影像学杂志,2012,20(4):252-254.
[3]蒯新平.CT和MRI功能成像技术在腮腺肿瘤诊断中的研究进展[J].实用放射学杂志,2011,27(4):628-630.
[4]杜立新,元建鹏,关弘,等.腮腺恶性肿瘤的MRI诊断价值及其病理基础[J].南方医科大学学报,2010,30(5):1107-1110.
[5]Yabuuchi Y,Matsuo H,Kamitani T,et al.Parotid gland tumors:can addition of diffusion-weighted MR imaging to dynamic contrast-enhanced MR imaging improve diagnostic accuracy in characterization?[J].Int J Med Radiol,2009,32(1):76.
[6]Simons AL,Lu P,Gibson-Corley KN,et al.The Justy mutant mouse strain produces a spontaneous murine model of salivary gland cancer with myoepithelial and basal cell differentiation[J].Laboratory Investigatior,2013,93(6):711-719.
[7]杜立新,元建鹏,徐化剑,等.MRI在面神经腮腺段的显示作用探讨[J].南方医科大学学报,2010,30(7):1639-1641.
[8]Lung T,Juncar M.Carcinoma ex-pleomorphic adenoma-a giang tumor[J].Chirurgia (Bucur),2013,108(2):273-276.
[9]柏钢,史卫健.腮腺多形性腺瘤与腺淋巴瘤的CT诊断体会[J].河南中医,2013,33(10):277.
[10]刘志,何娜娜.腮腺腺淋巴瘤的MRI诊断[J].中外医疗,2013,32(28):185,187.
[11]刘连生,李恒国.腮腺病变的CT和MRI诊断[J].临床放射学杂志,2011,30(6):909-912.
[12]岑秀雅,罗敏,高源统.多层螺旋CT对腮腺基底细胞腺瘤的诊断价值[J].中国医学影像学杂志,2013,21(3):191-192.
[13]任俊奇,李明华,赵夫娟.腮腺Warthin瘤上皮成分癌变为黏液表皮样癌的临床病理观察[J].临床与实验病理学杂志,2013,29(2):211-213.
[14]Piagkou M,Tzika M,Paraskevas G.Anatomic variability in the relation between the retromandibular vein and the facial nerve:a case report,literature review and classification[J].Folia Morphol(Warsz),2013,72(4):371-375.
[15]Krishnamurthy A,Kanaka R,Majhi U.Parotid gland metastasis from a rectal carcinoma[J].Indian J Surg Oncol,2013,4(3):233-235.
[16]Gunsoy B,Vuralkan E,Sonbay ND.Quality of life following surgical treatment of benign parotid disease[J].Indian J Otolaryngol Head Neck Surg,2013,65(1):105-111.
[17]Kizi Y,Aydil U,Ekinci O.Salivary gland tumors in Turkey:demographic features and histopathological distribution of 510 patients[J].Indian J Otolaryngol Head Neck Surg,2013,65(1):112-120.

