17-DMAG对人结直肠癌裸鼠移植瘤微血管形成的抑制作用
廖坚松 陈焕忠 茹晃耀 柯尊富
我国结直肠癌的发病率持续上升,病死率较高。到目前为止,结直肠癌的发病机制尚未完全清楚,其治疗效果仍不够理想,肿瘤的复发和转移是治疗难点。既往的研究表明,结直肠癌的生长、转移和复发均依赖于肿瘤新生血管的生成,故抑制肿瘤新生血管的生成可能成为结直肠癌治疗的新方向[1]。内皮细胞生长因子(VEGF)是一种促肿瘤新血管生成的生长因子,其表达水平与肿瘤的恶性程度、转移和微血管密度等呈正相关[2]。热休克蛋白90(HsP90)抑制剂17-二甲基胺乙基-17-去甲氧基格尔德霉素(17-DMAG)是格尔德霉素的新一代衍生物,与上一代相比,17-DMAG的水溶性和生物利用度明显提高[3]。笔者见有关17-DMAG抗肿瘤活性的研究较少,故观察了17-DMAG对结直肠癌VEGF的表达和肿瘤微血管生长的影响,以探讨其可能的抗肿瘤作用机制。
材料与方法
一、材 料
BALB/C-nu/nu裸鼠(SPF级)购于中山大学附属第一医院动物实验中心,共24只,4~6周龄,体质量24~28 g,分笼饲养(每笼4只)。人结肠癌SW620细胞株由中山大学附属第一医院动物实验中心提供并保存。17-DMAG购于北京启维益成科技公司,溶解后配成2 g/L的储存液,保存于-4℃冰箱。VEGF购于北京博奥森生物技术有限公司。血小板内皮细胞黏附分子(CD31)购于深圳华拓生物有限公司。
二、动物模型的制备
将人结肠癌SW620细胞株复苏、传代后进行常规收集,调整细胞终密度为5×107个/ml。于裸鼠左侧肋腹部皮下接种,注射剂量为每只200μl,含细胞1×107个。术后精心饲养,每日观察1~2次。一般于接种后4 d出现肉眼可见的肿瘤,隔日用游标卡尺测量肿瘤的大小,计算肿瘤体积:体积=0.52×长径×短径2。
三、实验动物分组及取材
待裸鼠皮下肿瘤生长到体积约100 mm3时,随机把裸鼠分为3组,每组8只:①17-DMAG组腹腔注射17-DMAG 25 mg/kg;②5-氟尿嘧啶(5-FU)组腹腔注射5-FU 20 mg/kg(最常用的结直肠癌化学治疗药);③对照组腹腔注射生理盐水10 ml/kg。3组均每周给药3次,共4周。4周后采用颈椎脱臼法处死小鼠,剥取瘤组织,测量瘤体质量和体积,按以下公式计算抑瘤率:抑瘤率(%)=(对照组平均瘤质量-药物组平均瘤质量)/对照组平均瘤质量×100%[3]。
四、检测项目
1.检测肿瘤组织微血管密度 (MVD)和VEGF
将瘤组织浸入10%甲醛固定,用石蜡包埋切片。切片后的一部分标本进行相关抗原免疫组织化学染色检测CD31、VEGF,严格按试剂盒说明进行,各组标本同一批染色,以磷酸盐缓冲液(PBS)代替Ⅰ抗作阴性对照。
MVD判断标准:按Weidner等[4]推荐的方法,凡呈现棕色单个内皮细胞或内皮细胞簇均作为1个微血管计数.但肌层较厚及管腔面积大于8个红细胞直径的血管不计数。计数方法如下,首先用低倍镜(10×10)扫视整张切片,确定微血管最密集的3个视野,然后在高倍镜(10×40)视野范围内计数所有染色的微血管。取3个视野计数结果的均数为该切片的微血管数[4]。
VEGF判断标准:观察棕黄或棕褐色颗粒的分布情况,细胞内有棕黄或棕褐色颗粒且强度高于背景的着色细胞为阳性细胞,无棕黄或棕褐色颗粒为阴性细胞。根据细胞染色强度分为4级,并分别计分:阴性为细胞无着色(0分),弱阳性为浅黄(1分),中度阳性为棕黄(2分),强阳性为棕褐(3分)。在每张切片上随机选取10个视野(10×10),计数每一强度视野阳性细胞数所占的比率(F),计算每张切片的平均染色强度[5]。
2.蛋白印迹法检测VEGF表达
切片后的另一部分标本保存于-20℃冰箱,用蛋白印迹法检测肿瘤组织中VEGF的表达。按照Kong等[6]推荐的方法,用Image J1.43软件进行分析,每组样本重复3次,取3次均值。
五、统计学处理
使用SPSS17.0统计软件处理数据。正态分布计量资料以¯x±s表示,3组间比较采用方差分析,方差齐则再进一步采用LSD法进行两两分析,方差不齐则采用Tamhane's T2法。两组抑瘤率比较采用t检验。P<0.05具有统计学意义。
结 果
一、17-DMAG组、5-FU组及对照组移植瘤体质量、体积和抑瘤率比较
17-DMAG组、5-FU组在给药结束后瘤体质量、瘤体积与对照组相比均明显下降(P<0.05);17-DMAG组与5-FU组之间瘤体质量、瘤体积、抑瘤率比较差异无统计学意义(P>0.05)。方差分析结果显示,3组瘤体质量比较的F=15.73、P=0.001,瘤体积的F=7.85、P=0.002。见表1。
表1 17-DMAG组、5-FU组及对照组移植瘤重量、体积及抑瘤率的比较

表1 17-DMAG组、5-FU组及对照组移植瘤重量、体积及抑瘤率的比较
注:与对照组比较,a为P <0.05
组 别 瘤体质量(g)瘤体积(mm3)抑瘤率(%)17-DMAG组(8只)1.15±0.49a 301.12±25.43a 48.43±6.75 5-FU组(8只) 1.22±0.58a 366.74±28.92a 45.29±8.34对照组(8只)2.23±0.66 968.68±118.66 0
二、17-DMAG组、5-FU组及对照组免疫组织化学染色检测MVD、VEGF结果比较
17-DMAG组给药结束后MVD、VEGF均较5-FU组及对照组低(P<0.05),方差分析结果显示,3组MVD比较的F=10.69、P=0.001,VEGF比较的F=8.17、P=0.002。5-FU组与对照组给药结束后MVD、VEGF比较差异无统计学意义(P>0.05)。见表2。免疫组织化学染色见图1、2。

表2 17-DMAG组、5-FU组及对照组MVD、VEGF比较(¯x±s)

图1 17-DMAG组、5-FU组及对照组MVD免疫组织化学染色图
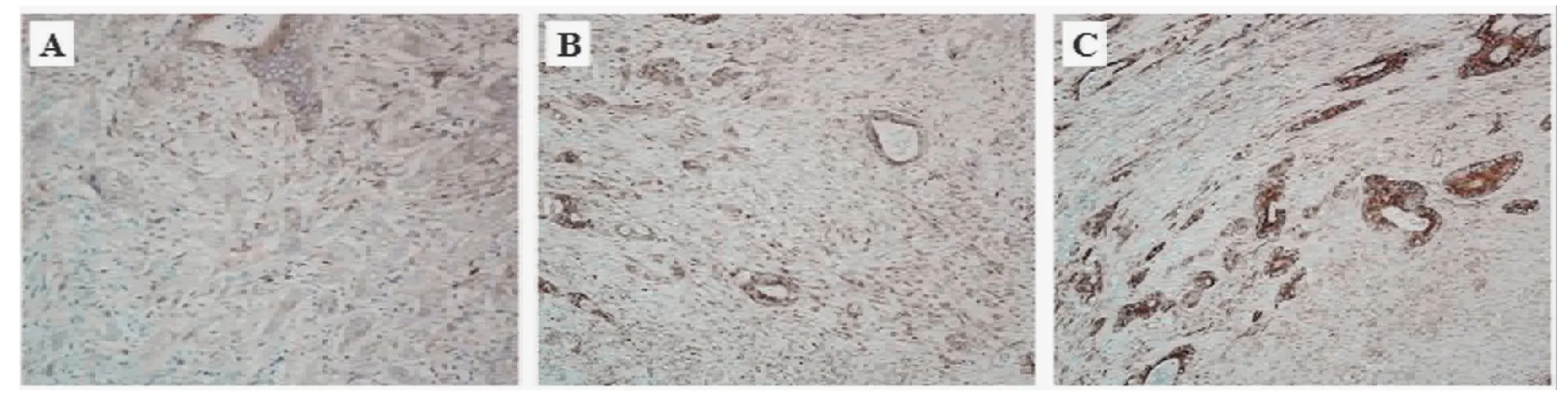
图2 17-DMAG组、5-FU组及对照组VEGF免疫组织化学染色图
三、17-DMAG组、5-FU组及对照组蛋白印迹法检测VEGF结果的比较
方差分析结果显示,3组给药结束后VEGF比较的F=14.52、P=0.001,17-DMAG组VEGF水平明显低于5-FU组及对照组(P<0.05)。见图3。
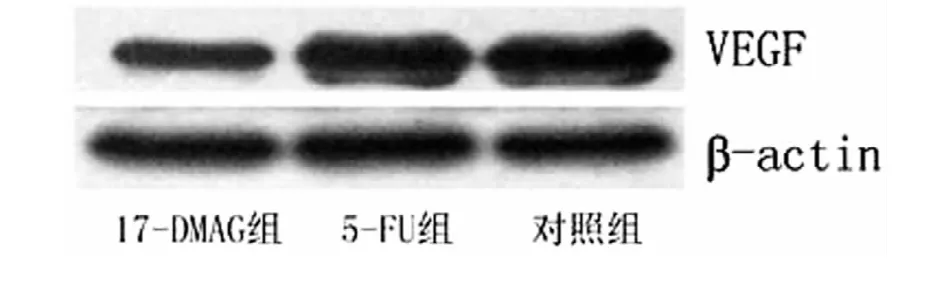
图3 17-DMAG组、5-FU组及对照组蛋白印迹法检测VEGF结果
讨 论
肿瘤血管新生是实体瘤生长、浸润和转移非常关键的因素。新生血管除了为实体瘤提供新陈代谢的途径外,还由于其管壁的高通透性,有利于肿瘤细胞的转移[7]。与肿瘤血管新生密切相关的血管生成因子,如VEGF等,其水平升高在一定程度上反映了肿瘤血管的新生[8]。HSP90几乎控制了所有恶性肿瘤细胞表型组成及细胞信号转导通路,因此,HSP90抑制剂可能会影响肿瘤细胞中多条信号转导通路,全面地影响肿瘤的发生、发展、侵袭和转移 等过程[9]。HSP90抑 制 剂17-AAG 和17-DMAG是苯醌类抗生素戈尔德霉素的衍生物。已有多个肿瘤临床实验证明17-AAG具有良好的治疗效果[10]。但笔者见对水溶性和生物利用度更好的17-DMAG研究较少。本研究选择人结肠癌SW620细胞株来构建肿瘤模型,采用新一代HSP90抑制剂17-DMAG对荷瘤裸鼠进行干预治疗,探讨其对结肠癌血管新生的抑制作用。
有研究认为采用免疫组织化学方法检测CD31的表达,敏感性高、特异性较好,是目前测量肿瘤微血管密度最佳的方法之一[11]。本研究发现,17-DMAG组中MVD明显低于5-FU组和对照组,而5-FU组与对照组之间MVD无明显差异。5-FU虽然对肿瘤的质量、体积有一定的改善,但对肿瘤微血管生成抑制作用不明显;而17-DMAG对肿瘤体积、抑瘤率和微血管新生均有明显改善作用,提示17-DMAG对抑制肿瘤的生长、转移和复发有着重要的作用。
VEGF是一种特异性高的血管内皮细胞刺激因子和血管通透剂,可促进不同来源的内皮细胞分裂增殖和血管构建,促使内皮细胞的迁移和血管内物质的渗漏,是肿瘤发生发展的重要标志[12]。因此笔者选择VEGF为观察疗效的主要指标之一,本研究运用蛋白印迹法检测到的结果显示,17-DMAG组肿瘤组织中VEGF表达明显低于5-FU组和对照组。故提示17-DMAG通过抑制结直肠癌细胞内VEGF表达,从而抑制肿瘤微血管生长,而5-FU并不能通过抑制VEGF阻止肿瘤微血管的生成。
综上所述,17-DMAG能够通过抑制肿瘤微血管生成和VEGF表达起抑制肿瘤的作用。但其作用机制可能还远不止这些,需要不断的研究探讨。
[1]Koshiyama A,Ichibangase T,Imai K.Comprehensive fluorogenic derivatization-liquid chromatography/tandem mass spectrometry proteomic analysis of colorectal cancer cell to identify biomarker candidate.Biomed Chromatogr,2013,27:440-450.
[2]Shibuya M.Vascular endothelial growth factor and its receptor system:Physiological functions in angiogenesis and pathological roles in various diseases.J Biochem,2013,153:13-19.
[3]Aregbe AO,Sherer EA,Egorin MJ,et al.Population pharmacokinetic analysis of 17-dimethylaminoethylamino-17-demethoxygeldanamycin(17-DMAG)in adult patients with solid tumors.Cancer Chemother Pharmacol,2012,70:201-205.
[4]Weidner N,Folkman J,Pozza F,et al.Tumor angiogenesis:a new significant and independent prognostic indicator in early-stage breast carcinoma.J Nail Cancer lnst,1992,84:1875-1887.
[5]Dias FJ,Issa JP,Barbosa AP,et al.Effects of low-level laser irradiation in ultrastructural morphology,and immunoexpression of VEGF and VEGFR-2 of rat masseter muscle.Micron,2012,43:237-244.
[6]Kong YC,Sun B,Zhao KX,et al.Small interference RNA targeting vascular endothelial growth factor gene effectively attenuates retinal neovascularization in mice model.Chin Med J,2013,126:1440-1444.
[7]Chien CC,Kempson IM,Wang CL,et al.Complete microscale profiling of tumor microangiogenesis:a microradiological methodology reveals fundamental aspects of tumor angiogenesis and yields an array of quantitative parameters for its characterization.Biotechnol Adv,2013,31:396-401.
[8]汤颖,叶增纯,李灿明,等.VEGF对小鼠足细胞黏附性的影响及PI3 K/Akt信号通路在其中的作用.新医学,2013,44:671-675.
[9]Franco MC,Ye Y,Refakis CA,et al.Nitration of Hsp90 induces cell death.Proc Natl Acad Sci U S A,2013,110:1102-1111.
[10]Saxena V,Naguib Y,Hussain MD.Folate receptor targeted 17-allylamino-17-demethoxygeldanamycin(17-AAG)loaded polymeric nanoparticles for breast cancer.Colloids Surf B Biointerfaces,2012,94:274-280.
[11]Ishizaka R,Hayashi Y,Iohara K,et al.Stimulation of angiogenesis,neurogenesis and regeneration by side population cells from dental pulp.Biomaterials,2013,34:1888-1897.
[12]Nonaka Y,Yoshida W,Abe K,et al.Affinity Improvement of a VEGF Aptamer by in Silico Maturation for a Sensitive VEGF-Detection System.Anal Chem,2013,85:1132-1137.

