早产儿呼吸机治疗的围生期高危因素分析
袁艳冰 刘海燕 钟倩
早产儿呼吸系统与呼吸中枢发育不成熟,出生后建立规律的呼吸与良好的通气是许多早产儿面临的主要问题。大量的临床资料证实,良好的通气是保证早产儿机体代谢、促进新生肺泡发育、避免肺损伤的必要条件,掌握早产儿辅助通气的需求是决定早产儿存活率及预后的主要因素之一。尽管通过客观体格检查可以发现早产儿呼吸窘迫体征(如呼吸频率、三凹征程度与经皮血氧饱和度等),但在紧急医疗护理及处置方面,对早产儿是否采取呼吸支持措施的恰当程度存在一定的难度与不确定性。为更好地掌握早产儿是否需要CPAP和(或)气管插管呼吸支持治疗的影响因素,本研究选取403例胎龄27~34周早产儿,对其是否需要CPAP和(或)气管插管的临床特征及其影响因素进行分析研究,现报告如下。
对象与方法
一、研究对象
2009年11月至2013年6月出生后30 min内收入我院新生儿ICU、胎龄27~34周的403例早产儿,诊断及治疗常规参考《实用新生儿学》第4版[1]。出生后72 h内需要无创CPAP和(或)气管插管呼吸机治疗超过48 h者纳入观察组,同期入院不需要CPAP和(或)气管插管呼吸机治疗的早产儿纳入对照组。治疗组154例,其中男85例,女69例;需要无创CPAP 80例,需要气管插管呼吸机治疗28例,同时需要2种疗法46例。对照组249例,男108例,女141例。排除伴严重先天畸形、早发型脓毒症、严重颅内出血、监护人签字放弃治疗出院者。两组早产儿的其他基础治疗,如维持内环境稳定等基本相同。本项目获得医院伦理委员会批准,并征得患儿家长知情同意。
二、临床治疗方案
无创CPAP采用鼻罩或鼻塞通气,气管插管方式为经口腔插入气管,管径大小和深度根据患儿体质量选择,通气模式及参数设置根据血气分析结果调节,最终要求血气分析指标维持在正常范围[PaO250~70 mm Hg(1 mm Hg=0.133 kPa),PaCO235~45 mm Hg,pH 7.35~7.45]。并应用多功能监护仪,监测患儿心率、呼吸、血压、SaO2,维持水、电解质、血糖等内环境稳定,并予静脉营养支持治疗。治疗期间根据专门设计的临床规律观察表收集相关临床资料。
三、统计学处理
1.影响因素的选择及赋值
对20项可能相关的围生期高危因素进行收集,并将下列因素赋值为1,没有赋值为0:X1男性,X2胎龄<29周,X3出生体质量<1 000 g,X4剖宫产,X5母多胎妊娠,X6母亲妊娠期糖耐量异常,X7母亲重度妊娠期高血压疾病,X8母亲产前应用地塞米松,X9胎膜早破>48 h,X10生后窒息(出生后5 min阿普加评分≤7分),X11使用肺表面活性物质,X12使用苯巴比妥,X13使用氨茶碱,X14使用抗生素,X15频发呼吸暂停,X16常规复苏后SaO2<85%,X17重度三凹征,X18早期喂养胃潴留,X19动脉导管未闭,X20早期深静脉置管(脐动静脉置管等)。
2.统计学处理
建立数据库后使用SPSS 17.0统计软件进行数据处理。对20项单个自变量资料先采用χ2检验,然后以需要CPAP和(或)气管插管呼吸机支持治疗作为因变量Y(治疗组=1,对照组=0),对单个自变量分析中P<0.1的因素采用二分类Logistic回归模型作进一步分析,以P<0.05为差异有统计学意义。
结 果
一、预测早产儿需要CPAP和(或)气管插管治疗的单个自变量分析结果
单个自变量分析中P<0.1共有12项因素,分别为:胎龄<29周,出生体质量<1 000 g,母亲妊娠期糖耐量异常,母亲重度妊娠期高血压疾病,母亲产前应用地塞米松,胎膜早破>48 h,使用肺表面活性物质,使用氨茶碱,频发呼吸暂停,常规复苏后SaO2<85%,重度三凹征,X18早期喂养胃潴留,见表1。
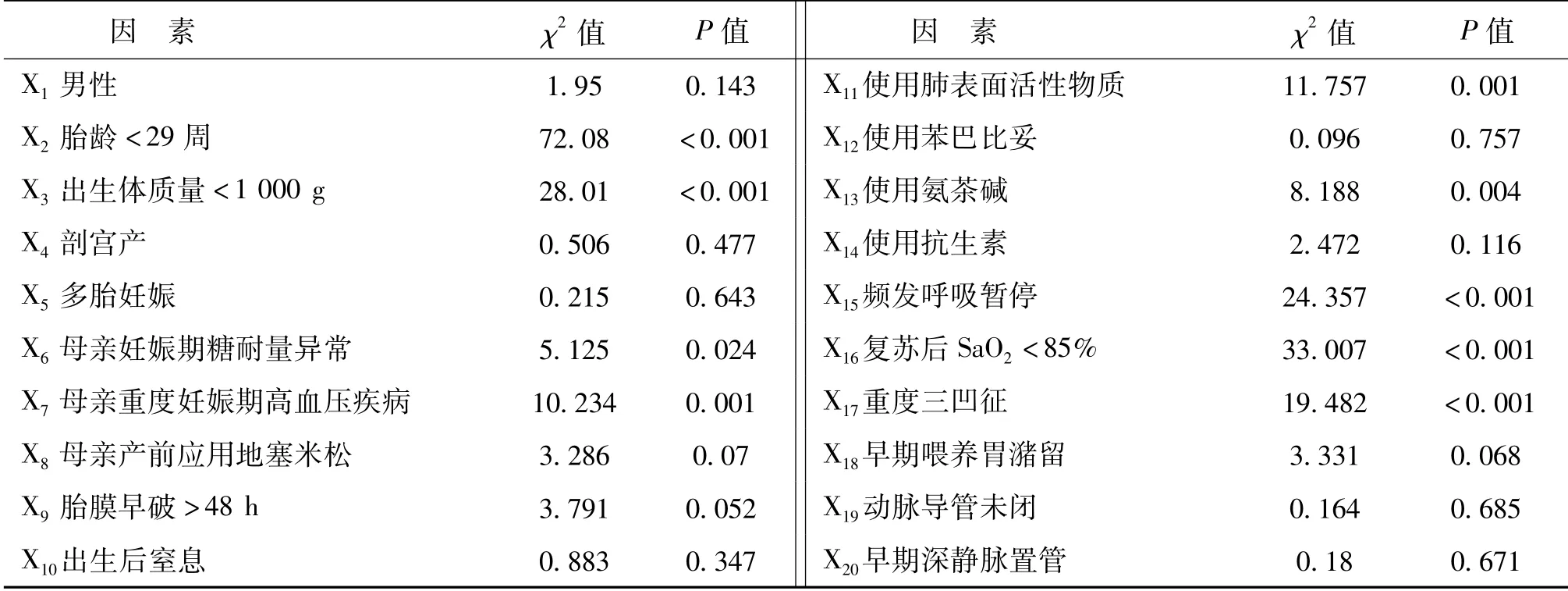
表1 预测早产儿需要CPAP和(或)气管插管治疗的单个自变量分析结果
二、预测早产儿需要CPAP和(或)气管插管治疗的多变量分析
在预测早产儿需要CPAP和(或)气管插管治疗的多变量模型中,有统计学意义的因素包括胎龄<29周、出生体质量<1 000 g、母亲妊娠期糖耐量异常、母亲重度妊娠期高血压综合征、胎膜早破>2 d、使用肺表面活性物质、频繁呼吸暂停、常规复苏后SaO2<85%、重度三凹征、早期喂养胃潴留,见表2。模型最适校正C检验值为0.8。

表2预测早产儿需要CPAP和(或)气管插管治疗的二分类Logistic回归结果
讨 论
近年来,随着新生儿重症医疗监护水平的不断提高,各项新技术如肺表面活性物质、高频呼吸机、一氧化氮的使用,使早产儿的存活率明显得到提高,但是各种并发症和后遗症的发病率也相应增加,如慢性肺部病变、早产儿视网膜病变[2]。这些都与出生后给予呼吸支持治疗密切相关。呼吸支持治疗作为早产儿治疗的重要手段,一直是新生儿科医生关注及研究的重点,但是对于早产儿是否需要呼吸支持治疗、何时采取及终止治疗、采取何种方式及模式等问题仍存在不确定性[3]。因此,探讨早产儿需行呼吸支持治疗的高危因素,有助于及早制定更合理、有效的治疗方案。
在本项对于住院早产儿开展的持续3年8个月的临床研究中,笔者发现早产儿是否需要CPAP和(或)气管插管呼吸机治疗存在相关的因素包括:胎龄较小、出生体质量较低、母亲妊娠期糖耐量异常、母亲重度妊娠期高血压综合征、胎膜早破>48 h、使用肺表面活性物质、有频繁呼吸暂停、重度三凹征、早期喂养胃潴留及常规复苏后血氧饱和度低。其中胎龄较小与出生体质量低已被公认为早产儿呼吸窘迫综合征的危险因素。笔者在实践过程中发现,胎龄<29周与出生体质量<1 000 g的早产儿需要CPAP和(或)气管插管呼吸机治疗的比例较高且接受呼吸机治疗时间较长。这可能是由于胎龄越小与出生体质量越低的早产儿肺发育越差,呼吸肌力量越弱,代偿能力差,易于发生呼吸肌疲劳,使呼吸衰竭加重,同时也容易合并其他感染等并发症加重呼吸系统疾病[4]。
早产儿早期出现频繁呼吸暂停、重度三凹征及复苏后SaO2低这3项临床表现是早产儿出生时肺功能不全的标志[5-6]。频繁呼吸暂停、重度三凹征在临床工作中较容易发现且常伴有SaO2下降及心率变化。本研究按新生儿复苏指南流程复苏,复苏开始使用氧浓度30% ~40% (2010年前采用复苏囊接氧气去除储氧袋复苏,2010年使用空氧混合仪),并根据SaO2调整氧浓度,如有效通气90 s后心率仍不增加或SaO2增加不满意,则将氧浓度提高到100%[7]。目前有研究显示过度给氧,追求高SaO2或是血氧波动较大对早产儿是有害的,会增加早产儿视网膜病发生率及早产儿病死率[8]。本研究发现,大部分SaO2低于85%的患儿及小部分SaO2波动较大的患儿需要CPAP和(或)气管插管呼吸机治疗。
早期喂养胃潴留是早产儿喂养不耐受的主要表现,同时也会影响早产儿对营养的吸收。现有研究发现营养对肺部发育有直接影响,其会导致肺部结构发生改变,在小鼠实验中发现限制热量摄取能减少55%的肺泡数量及25%的肺泡总面积[9]。也有不少报道发现支气管肺发育不良(BPD)与早产儿营养不良有关[10]。Wemhöner等[11]对95个胎龄小于31周的早产儿进行观察性研究发现,肠内营养少的患儿即使有肠外营养的补充也容易发展为BPD。目前没有发现有关早产儿喂养胃潴留能预测早产儿需要呼吸机治疗的文献报道。早期喂养胃潴留主要原因是早产儿胃肠道不成熟,但是有研究发现,当一些合并症导致全身组织缺血、缺氧的情况下,胃肠道也会发生缺血、缺氧、胃肠激素分泌减少等改变,可能导致部分早产儿消化功能欠佳[12]。因此临床上患儿出现胃潴留、胃胀等喂养不耐受的情况时,除要考虑胃肠道发育问题,也要警惕呼吸循环系统导致的缺氧情况。该因素虽然在单变量分析及Logistic回归分析中有意义,但是考虑到其同时可受胎龄、体质量、喂养方式等影响,本研究只能说明在综合分析其他因素的情况下,其对是否需要呼吸机治疗有一定的预测性,同时也有待进一步的研究。
近年来,妊娠合并糖尿病的发病率呈逐年上升趋势,母亲妊娠期间所患疾病可影响早产儿肺功能,也是引起早产的重要原因之一[13]。本组研究数据提示母亲妊娠期糖耐量异常、母亲妊娠期重度高血压疾病、胎膜早破时间较长与早产儿是否需要CPAP和(或)气管插管呼吸机治疗密切相关。产前激素治疗自1972年首次报道以来,已证实可明显减少早产儿呼吸窘迫综合征的发生率[14]。本组资料提示产前激素治疗不能单独预测早产儿是否需要CPAP和(或)气管插管呼吸机治疗,可能与本组早产儿在出生前母亲应用激素的剂型、剂量、疗程及应用时间不规范有关。
本研究尚存在以下不足之处:首先研究仅在一间大学附属医院开展,而作为观察性研究,未给所有纳入标准的早产儿进行系统性X线检查,所以未将该变量纳入到多变量模型中进行分析,这有可能导致较高的统计学偏倚。2013年欧洲早产儿ARDS治疗共识建议接受氧疗的早产儿目标SaO2为90%~95%,本研究采用目标血氧饱和度仅为85%[4]。因此有必要对所有研究对象进一步随访及开展多中心研究,以了解早产儿呼吸机治疗对预后的影响及高危因素对早产儿是否需要CPAP和(或)气管插管呼吸机治疗的预测效能。
[1]邵肖梅,叶鸿瑁,丘小汕.实用新生儿学.4版.北京:人民卫生出版社,2011:35-39,59-80,138-145,234-247,395-398.
[2]Brennan G,Perlman JM.Neurologic complications of mechanical ventilation.New York:Springer,2012:685-690.
[3]Morley CJ.Treatment of respiratory failure:mechanical ventilation.Milan:Springer,2012:497-508.
[4]Sweet DG,Carnielli V,Greisen G,et al.European consensus guidelines on the management of neonatal respiratory distress syndrome in preterm infants-2013 update.Neonatology,2013,103:353-368.
[5]Moriette G,Lescure S,El Ayoubi M,et al.Apnea of prematurity:what's new Arch Pediatr,2010,17:186-190.
[6]Poets CF.Apnea of prematurity:What can observational studies tell us about pathophysiology?Sleep Med,2010,11:701-707.
[7]叶鸿瑁,虞人杰,黄醒华,等.新生儿复苏指南.中国新生儿科杂志,2011,4:004.
[8]Chen M,Citil A,McCabe F,et al.Infection,oxygen,and immaturity:interacting risk factors for retinopathy of prematurity.Neonatology,2011,99:125-132.
[9]Massaro GD,Radaeva S,Clerch LB,et al.Lung alveoli:endogenous programmed destruction and regeneration.Am J Physiol Lung Cell Mol Physiol,2002,28:L305-L309.
[10]Shlomai NO,Patole S.Nutrition in Preterm Infants with bronchopulmonary dysplasia. Netherlands: Springer,2013:421-439.
[11]Wemhöner A,Ortner D,Tschirch E,et al.Nutrition of preterm infants in relation to bronchopulmonary dysplasia.BMCPulm Med,2011,11:7.
[12]唐振,周英,李明霞.早产儿喂养不耐受临床特征分析.中国当代儿科杂志,2011,13:627-630.
[13]梁考文,李小菊.糖尿病母亲妊娠期血糖的控制与新生儿的关系.中华医学研究杂志.2007,7:72-78.
[14]Roberts D,Dalziel S.Antenatal corticosteroids for accelerating fetal lung maturation for women at risk of preterm birth.Cochrane Database Syst Rev,2006,3:CD004454.

