PPARγ、PTEN、Akt在胃癌中的表达及其与胃癌生物学行为的关系
廖山婴 朱小波 王蓓蓓 马娟 沙卫红
胃癌是最常见的恶性肿瘤之一,近年来胃癌患病率有逐年上升趋势,且发病日益年轻化,严重影响人民健康,目前胃癌的病因和发病机制尚未完全阐明[1]。近年来过氧化物酶增殖激活受体γ(PPARγ)与肿瘤关系的研究受到广泛关注,许多恶性肿瘤中存在PPARγ的异常表达,PPARγ被配体激活后可抑制肿瘤生长[2-3]。我们前期研究发现,PPARγ配体罗格列酮具有预防化学致癌剂N-甲基-N'-硝基-亚硝基胍诱导大鼠腺胃癌发生的作用[4]。PPARγ2 Pro12Ala基因多态性与我国汉族人群胃癌的发生有关,增加幽门螺杆菌(Hp)感染后胃癌发生的危险性[5]。以上结果表明PPARγ与胃癌发生、发展密切相关,然而PPARγ在体内的研究还鲜有报道。本研究采用逆转录PCR法(RTPCR)检测胃癌组织中PPARγ及10号染色体缺失张力蛋白同源的磷酸酶基因(PTEN)、丝氨酸/苏氨酸蛋白激酶(Akt)mRNA的表达,并结合胃癌患者的临床病理特征,分析三者的关系及其与胃癌生物学行为的相关性。
材料与方法
一、材 料
选取2010年10月至2012年10月我院胃肠外科行胃癌根治术并均经术后病理检查证实为胃癌标本60例,相应的癌旁正常组织(距肿瘤边缘≥5 cm,手术后证实残端无癌残留)60例,组织取材后立即放入液氮冻存备用。所有患者术前均未予放射化学治疗。其中男38例,女22例;年龄33~72岁,中位年龄53岁;高、中分化腺癌36例,低分化腺癌24例;临床分期采用国际抗癌联盟(UICC)胃癌TNM 分期方法,其中Ⅰ+Ⅱ期28例,Ⅲ+Ⅳ期32例;淋巴结转移41例,无淋巴结转移19例;远处转移13例,无远处转移47例;肿瘤浸润未侵及浆膜层者26例,浸润超过浆膜层者34例。另取本院同期胃镜室的镜下活检20名正常胃黏膜标本(胃镜标本)作为正常对照。所有取材患者均知情同意。
二、研究方法
1.主要试剂
RNA抽提试剂盒购自上海生物工程技术服务有限公司;Trizol RNA提取液、RNA酶抑制剂、AMV逆转录酶和DNA Ladder Marker购自Invitrogen;EDTA、DEPC购自Sigma;Taq DNA聚合酶、dNTP购自Promega;电泳仪和凝胶成像扫描分析仪购自美国Bio Rad;PCR扩增仪9600购自美国PE公司;紫外分光光度计DU70购自美国Beckman公司;台式低温高速离心机购自Eppendorf。引物设计参照Genebank资料,由计算机软件设计,中山大学达安基因生物技术有限公司合成,扩增用引物见表1。
2.方 法
2.1 总RNA的提取和cDNA合成 按照RNA提取试剂盒说明书提取3组标本组织总RNA,RNA纯度OD260/OD280在1.8~2.0。用AMV逆转录酶进行cDNA合成,-20℃保存。
2.2 RT-PCR扩增 PCR反应体系组成:cDNA模板1μl,5×PCR buffer 5μl,上游引物1μl,Taq酶2.5 ul,10mM dNTPs 1μl,加去离子水补至20μl。反应条件:95℃热启动15 min,93℃预变性3 min,93℃变性45 s,55℃退火60 s,72℃延伸60 s,共30个循环,最后72℃充分延伸10 min。完毕后取扩增产物5μl,加6×上样缓冲液2μl,用1.5%琼脂凝胶在82伏特的电压下电泳30 min。
2.3 结果判定 结果进行凝胶图像吸光度分析,扫描定量分析DNA带的含量,以所测得的积分吸光度与内参照β-actin积分吸光度的比值代表半定量值。实验重复3次,取其平均值进行统计分析。比较肿瘤组织、瘤旁组织及正常组织中表达差异。
三、统计学处理
采用SPSS 17.0统计软件包进行统计学分析。计量资料用以表示,多组样本均数比较采用单因素方差分析(ANOVA),PPARγ、PTEN、Akt mRNA的表达与胃癌临床病理特征的关系用检验独立样本t检验,相关性采用Spearman相关分析。
结 果
一、PPARγ、PTEN、Akt mRNA在胃癌组织、癌旁组织及正常胃组织中的表达
PPARγ、PTEN及Akt mRNA经RT-PCR扩增后,扩增产物长度分别是163 bp、280 bp和217 bp,内参β-actin的扩增产物为418 bp,见图1。胃癌组织中PPARγ及Akt mRNA表达水平高于癌旁组织及正常胃组织(P<0.05),而PTEN mRNA表达水平明显较癌旁组织及正常胃组织低(P<0.05),在癌旁组织与正常胃组织间PPARγ、PTEN、Akt mRNA的表达水平均无明显差异(P>0.05),见表2。
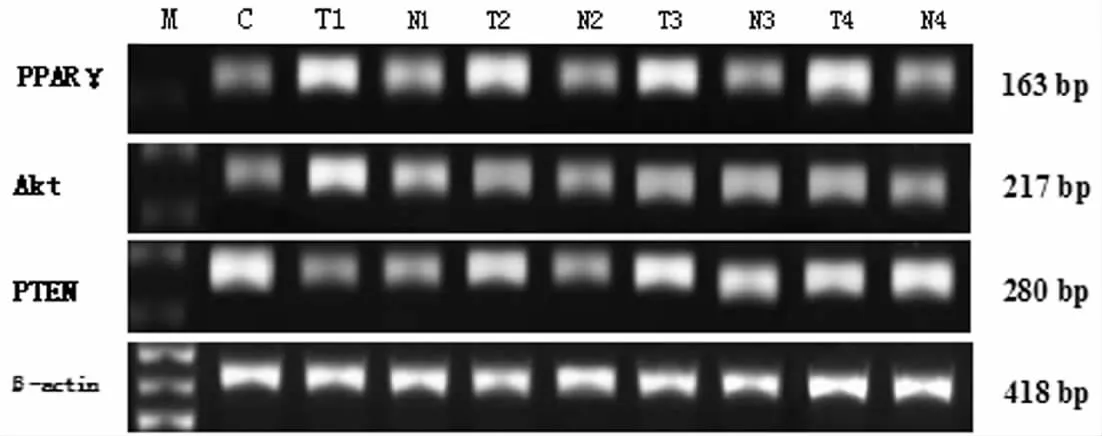
图1 胃癌组织、癌旁组织及正常胃组织PPARγ、PTEN、Akt mRNA表达(RT-PCR)
表2 胃癌组织、癌旁组织及正常胃组织中PPARγ、PTEN、Akt mRNA的表达
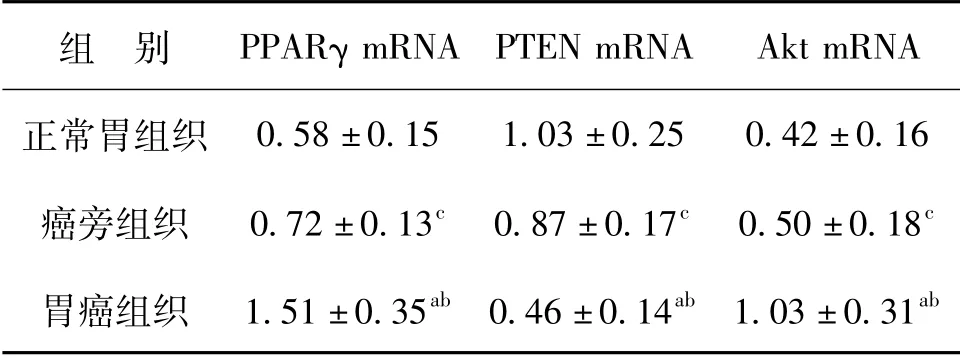
表2 胃癌组织、癌旁组织及正常胃组织中PPARγ、PTEN、Akt mRNA的表达
注:与正常胃组织比较,a P<0.05,F PPARγmRNA=59.029,F PTEN mRNA=24.127,F Akt mRNA=33.173;与癌旁组织比较,b P<0.05,F PPARγmRNA=36.679,F PTEN mRNA=14.036,F Akt mRNA=9.251;与正常胃组织比较,c P>0.05,F PPARγmRNA =1.345,F PTEN mRNA=2.798,F Akt mRNA=0.426
组 别 PPARγ mRNA PTEN mRNA Akt mRNA正常胃组织0.58±0.15 1.03±0.25 0.42±0.16癌旁组织 0.72±0.13c 0.87±0.17c 0.50±0.18c胃癌组织 1.51±0.35ab 0.46±0.14ab 1.03±0.31 ab
二、胃癌组织中PPARγ、PTEN、Akt mRNA表达与临床病理因素的关系
胃癌组织中PPARγ、PTEN、Akt mRNA表达量与患者性别、年龄、肿瘤大小及分化程度无相关性(P>0.05),而与胃癌的TNM 分期、侵犯浆膜、淋巴结转移及远处转移相关(P<0.05),见表3。
三、胃癌组织中PPARγ、PTEN、Akt mRNA表达的相互关系
经Spearman等级相关分析表明,PPARγmRNA与PTEN mRNA表达呈负相关(rs=-0.492,P<0.05),与Akt mRNA表达呈正相关 (rs=0.623,P<0.05),PTEN mRNA与Akt mRNA表达呈负相关(rs=-0.565,P<0.05)。
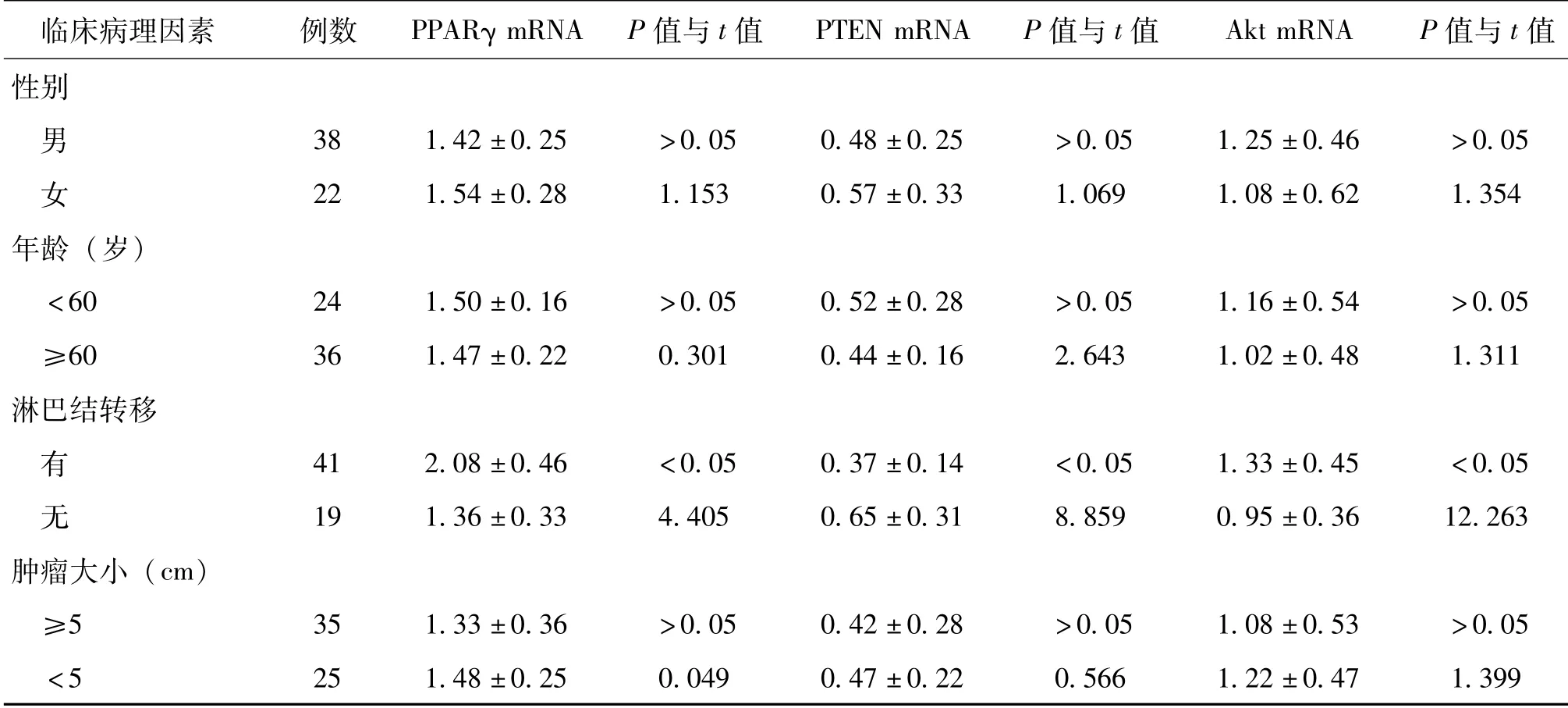
表3 胃癌组织中PPARγ、PTEN、Akt mRNA的表达与临床病理因素的关系
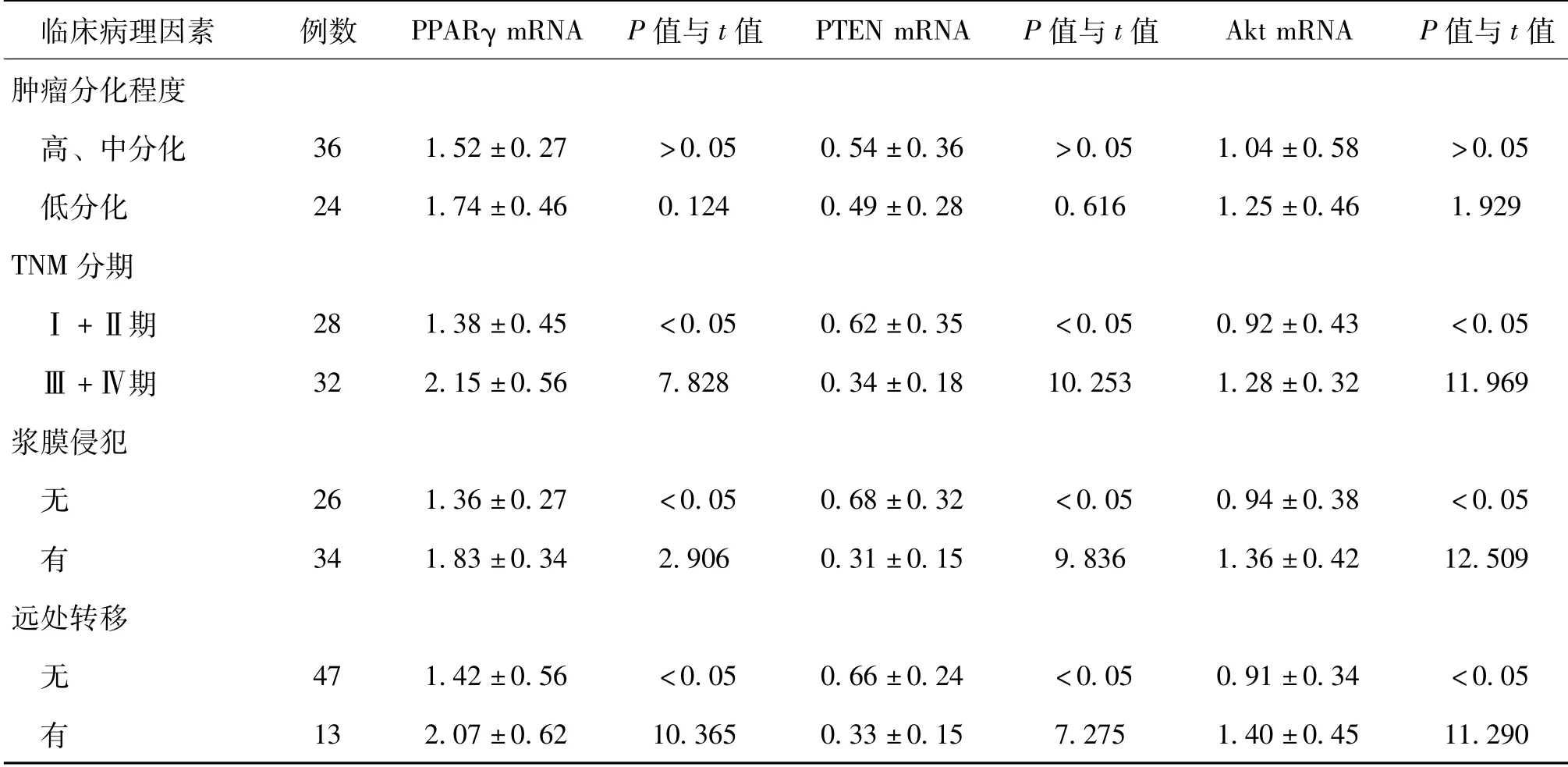
续表
讨 论
胃癌的发生可能与遗传、环境及饮食等多种因素有关,现有治疗方法如手术、放射治疗、化学治疗效果均不理想,根除Hp及抗氧化剂治疗是否对降低或预防胃癌的发生具有真正价值还在进一步探讨[6]。因此胃癌的发病机制和早期预防一直是消化道肿瘤研究热点。
PPARγ是Ⅱ型核激素受体超家族成员,广泛分布于全身许多组织如肾脏、肝脏、胃肠道、胰腺、乳腺、脾脏等,在内皮细胞、血管平滑肌细胞和肿瘤细胞亦有表达。在被配体激活后,与类维生素A类受体结合形成异二聚体,再与靶基因启动子区的特异性DNA序列称为过氧化体增殖反应元件结合,调控靶基因的转录,其生物学效应包括调控脂肪代谢和糖代谢,参与能量储存和利用,控制单核细胞激活及诱导巨噬细胞凋亡、抗炎症反应功能及抗动脉粥样硬化等作用[7]。
近年来研究发现PPARγ与多种消化道肿瘤的发生有关[2-3]。我们的前期动物实验证明,PPARγ配体罗格列酮能显著降低化学致癌剂N-甲基-N'-硝基-亚硝基胍诱导的大鼠腺胃癌发生率[4]。同时体内研究显示,PPARγ2外显子B第12密码子的CCA-GCA的错义突变所致的Pro12Ala基因多态性与我国汉族人群胃癌的发生有关,增加Hp感染后胃癌发生的危险性[5]。为进一步了解PPARγ与胃癌之间的关系,我们检测了胃癌患者的PPARγ mRNA表达情况,结果显示,与正常胃组织及癌旁组织相比,胃癌组织中PPARγ呈高表达,与李强等[8]的研究结果一致,进一步证实PPARγ与胃癌的发生发展相关。
PPARγ与肿瘤发生相关业已明确,但其中的作用机制尚不清楚。目前的研究热点主要集中在PPARγ配体抗肿瘤作用方面,认为其可抑制肿瘤细胞增殖,促进分化并诱导凋亡,抑制血管生成[9]。然而也有研究认为PPARγ配体抗肿瘤作用并不是通过PPARγ途径起作用的[10]。
PTEN-磷脂酰肌醇3-激酶(PI3K)-Akt信号转导通路是关键的细胞增殖相关信号通道之一。抑癌基因PTEN通过第二信使PI3K抑制Akt磷酸化活化,促进细胞色素C从线粒体的释放及Caspases-9和Caspase-3的激活,从而抑制细胞增殖,诱导细胞凋亡,因此,PTEN-PI3K-Akt信号转导通路的活性与多种恶性肿瘤的发生、发展密切相关[11]。薛鹏等[12]的研究结果显示,胃癌组织中PTEN和磷酸化AKT蛋白的阳性表达率均高于相应癌旁组织。近年来研究表明,PPARγ与PTEN-PI3K-Akt信号轴之间也存在联系,PPARγ配体可通过上调PTEN表达,抑制PI3K/Akt信号轴,从而起到抑制细胞增殖,促进细胞凋亡等抗炎症、抗肿瘤作用[13-14]。因此,本研究中我们检测了PPARγ及PTEN、Akt在胃癌患者及正常人群体内表达情况,结果表明,与正常胃组织及癌旁组织相比,胃癌组织中PPARγ及Akt mRNA水平明显升高,而PTEN表达水平相应下降,三者之间存在相关性。进一步结合胃癌患者的临床病理特征分析,结果显示,胃癌组织中PPARγ、PTEN、Akt mRNA表达量与患者性别、年龄、肿瘤大小及分化程度无相关性,而与胃癌的TNM分期、侵犯浆膜、淋巴结转移及远处转移相关。
PTEN-PI3K-Akt信号转导通路又是如何参与肿瘤的发生、发展?新近研究表明,Akt可通过下游调控因子哺乳动物雷帕霉素靶蛋白(mTOR)这一信号通路,调控缺氧诱导因子-1(HIF-1)的活性,促进血管内皮生长因子(VEGF)的表达,进而促进肿瘤发展和新生血管形成[15]。目前我们正在检测胃癌患者肿瘤组织中的p-mTOR、HIF-1和VEGF的表达,从而进一步探讨PTEN-PI3K-Akt/mTOR信号转导通路在胃癌发病机制中的作用。
综上所述,PPARγ、Akt的高表达及PTEN低表达与胃癌的生物学行为密切相关,并且三者相互关联。联合检测PPARγ、PTEN、Akt,可能有助于对胃癌恶性程度的判定及侵袭转移能力的评估,进而为胃癌的预后分析和进一步治疗提供参考依据和新的靶点。
[1]Piazuelo MB,Epplein M,Correa P.Gastric cancer:an infectious disease.Infect Dis Clin North Am,2010,24:853-869.
[2]Dai Y,Wang WH.Peroxisome proliferator-activated receptorγand colorectal cancer.World JGastrointest Oncol,2010,2:159-164.
[3]Wang W,Wang R,Zhang Z,et al.Enhanced PPARgamma expression may correlate with the development of Barrett's esophagus and esophageal adenocarcinoma.Oncol Res,2011,19:141-147.
[4]陈白莉,廖山婴,曾志荣,等.PPARγ配体罗格列酮预防MNNG诱导的大鼠胃癌发生的实验研究.中国病理生理杂志,2009,25:1522-1527.
[5]廖山婴,曾志荣,周韶璋,等.PPARγ2 Pro12Ala基因多态性与我国胃癌关系的研究.中国病理生理杂志,2007,23:757-760.
[6]Qiu HB,Zhang LY,Keshari RP,et al.Relationship between H.Pylori infection and clinicopathological features and prognosis of gastric cancer.BMC Cancer,2010,10:374.
[7]Zieleniak A,Wójcik M,Woz′niak LA.Structure and physiological functions of the human peroxisome proliferator-activated receptor gamma.Arch Immunol Ther Exp(Warsz),2008,56:331-345.
[8]李强,党诚学.PPARγmRNA在胃癌组织中的表达及其与胃癌预后的关系.实用癌症杂志,2012,27:18-20.
[9]Nickkho-Amiry M,McVey R,Holland C.Peroxisome proliferator-activated receptors modulate proliferation and angiogenesis in human endometrial carcinoma. Mol Cancer Res,2012,10:441-453.
[10]Cheon CW,Kim DH,Kim DH,et al.Effects of ciglitazone and troglitazone on the proliferation of human stomach cancer cells.World J Gastroenterol,2009,15:310-320.
[11]Carnero A,Blanco-Aparicio C,Renner O,et al.The PTEN/PI3K/AKT signaling pathway in cancer,therapeutic implications.Curr Cancer Drug Targets,2008,8:187-198.
[12]薛鹏,周翡,李宁,等.胃癌中PTEN和p-AKT蛋白的表达及其临床意义与预后分析.肿瘤,2012,32:281-285.
[13]Pi WF,Guo XJ,Su LP,et al.Troglitazone upregulates PTEN expression and induces the apoptosis of pulmonary artery smooth muscle cells under hypoxic conditions.Int J Mol Med,2013,32:1101-1109.
[14]Kulkarni AA,Thatcher TH,Olsen KC,et al.PPAR-γ ligands repress TGFβ-induced myofibroblast differentiation by targeting the PI3K/Akt pathway:implications for therapy of fibrosis.PLoSOne,2011,6:e15909.
[15]晏淼,朱正秋,卞保祥,等.Akt/mTOR信号通路蛋白在胃癌组织中的表达及其临床意义.中国全科医学,2011,14:3442-3444.

