猪小肠缺血再灌注损伤的多层螺旋CT灌注成像研究
石海峰 强金伟 李若坤
(1.江苏省常州市第二人民医院影像科,江苏常州 213003;2.复旦大学附属金山医院影像科,上海 201508)
小肠是所有腹部脏器中对缺血再灌注损伤(ischemia-reperfusion injury,IRI)最为敏感的器官[1]。小肠IRI常见于不转流的腹主动脉瘤手术、体外循环、绞窄性疝、新生儿坏死性小肠结肠炎、小肠移植,也可见于感染性休克和低血容量性休克[2]。小肠微循环障碍是引发和加重小肠IRI的关键性因素,而且微循环功能障碍往往发生于组织细胞损伤之前[3]。血液浓缩、血栓形成、白细胞堵塞毛细血管、内皮细胞肿胀、血管舒缩功能障碍和与水肿相关的组织间隙压力增加等病理生理机制是导致再灌注失败的原因。小肠IRI可造成肠黏膜屏障功能障碍,引起肠道菌群移位和内毒素血症,进而导致细胞因子及炎性介质失控性释放,诱发全身炎性反应综合征,造成心、肺、肝、肾等远隔器官损伤[4],引起多器官功能障碍综合征和多器官衰竭[5]。所以早期评价小肠IRI微循环变化有着重要的临床意义。CT和超声曾被用来评价小肠IRI发生时肠道的形态学改变[6],但这些方法准确率低和敏感性差。丙二醛(malondialdehyde,MDA)和超氧化物歧化酶(superoxide dismutase,SOD)是反映组织IRI重要的生化指标[7],多层螺旋CT(multi-slice CT,MSCT)灌注成像具有安全、无创、操作简单等优点,可从毛细血管水平评价组织灌注,与组织代谢关系更密切[8]。本研究旨在探讨应用MSCT灌注成像技术评价小肠IRI肠道血流动力学变化的价值,同时研究灌注参数与反映IRI的临床生化指标的相关性。
1 资料与方法
1.1 实验动物及分组 48只巴马猪,体质量(23.8±4.6)kg,雌雄不限,130~150日龄(购自上海农科院养殖场,许可证号:SCXK 沪 2010-0025)。术前禁食24 h,自由饮水。将24只巴马猪随机分为缺血2 h后再灌注1 h、2 h、3 h、4 h IRI组,每组6只;每组分别设立相应时间点(术后3 h、4 h、5 h、6 h)的假手术组(sham组),每组5只。另外,设立单纯缺血组(缺血2 h)作为病理对照,共4只。
1.2 IRI模型制作 巴马猪大腿后上部肌内注射氯胺酮10 mg/kg,阿托品0.02 mg/kg,开放耳缘静脉,连接多功能监护仪,气管插管接麻醉机行机械通气。持续吸入七氟醚维持麻醉。术中滴注晶体液,滴注速度为10 mg/(kg·h),持续监测动物食道体温,并用可调式电热毯进行保温,以维持动物正常体温在38~39 ℃。麻醉平稳后,使猪取平卧位,采用腹部正中切口,分离肠系膜上动脉(superior mesenteric artery,SMA)主干及其主要分支,用无损伤动脉夹夹闭SMA 2 h后松开动脉夹进行再灌注。Sham组仅打开腹腔,分离SMA,不做夹闭处理。单纯缺血组,夹闭SMA 2 h后立即处死巴马猪,手术过程约20 min,出血量10~20 mL,术中猪的生命体征平稳。
1.3 MSCT灌注成像扫描 扫描前猪腹部绑腹带以减轻呼吸运动幅度。采用Somatom Definition AS 128层螺旋CT(德国Siemens公司)进行动态增强灌注扫描,先行平扫,扫描范围为膈顶至耻骨联合。重建层厚5 mm,层间距5 mm,螺距为1,然后选定中下腹部显示小肠最大范围层面作为灌注扫描层面,选择Abdomen VPCT Long扫描模式,覆盖范围16.8 mm,层厚3.0 mm,管电压80 kV,管电流110 mA。增强对比剂选用碘普罗胺(370 mgI/mL,德国拜耳先灵药业公司),采用高压注射器(Medrad,美国PA公司)自动注射,注射速率为5 mL/s,对比剂量50 mL,注射结束后追加0.9%氯化钠液40 mL。注射后延迟5 s开始扫描,连续动态扫描23次,间隔时间为3.50 s,扫描时间共54.08 s。
1.4 灌注图像分析 将扫描重建后图像导入影像诊断工作站(Syngo,德国Siemens公司),采用灌注软件VPCT Body对数据进行灌注成像分析。对图像进行运动校正,通过灌注软件计算获得小肠CT灌注图像以及血容量(blood volume,BV)、血流量(blood flow,BF)、平均通过时间(mean transit time,MTT)和表面通透性(permeability surface,PS)等小肠灌注参数。
按以下标准来选择感兴趣区(region of interests,ROI):(1)选择尽可能小的ROI,图像进行放大2倍左右以便于选取ROI时尽量避开肠腔内气液体和脂肪;(2)选择受呼吸运动及肠管蠕动影像较小的层面,在BF或BV灌注图上进行肠壁ROI的选取,并以最大密度投影(maximum intensity projection,MIP)图像进行对照以确保ROI准确定位于肠壁。对回肠不同部位重复测量6次取平均值,得到MSCT灌注参数值。
1.5 病理观察及检测指标 所有巴马猪在实验结束时静脉注射10%氯化钾20 mL处死,取一段3 cm左右远端回肠(距回盲瓣10 cm)用10%甲醛固定24 h。然后,常规石蜡包埋、切片和HE染色,光镜下观察。采用Chiu[9]等的评分标准评价小肠黏膜损伤情况。另取一段长约20 cm的远端回肠,用0.9%氯化钠液洗净肠腔内容物,用玻片刮取约100 mg的肠黏膜组织,放入液氮瓶内进行速冻,随后将标本放入-80 ℃冰箱保存,送江苏南京建成生物公司检测黏膜内SOD活性和MDA含量。
1.6 统计学处理 采用SPSS 16.0软件进行统计学分析,采用单因素方差分析(One-Way ANOVA)比较IRI组4个时间点的肠道灌注参数以及实验室生化指标,方差齐时采用最小显著差异法(least significant difference,LSD)对各组灌注参数进行两两比较,而方差不齐时采用Tamhane对各组数据进行两两比较。运用Spearman相关性分析,检验BV、BF与MDA、SOD的相关性。IRI组与sham组灌注参数的比较,采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结 果
IRI组2只巴马猪分别在再灌注1.5 h和3.6 h时死亡,因此不用于实验数据分析。sham组和单纯缺血组中无死亡。
2.1 IRI组各时间点小肠灌注参数参数比较 随着再灌注时间的延长,IRI组BF、BV、PS呈整体下降的趋势,其中BF、BV在再灌注3 h时间点有轻度一过性上升(相对于再灌注2 h时间点),再灌注1 h时间点BF与其他各时间点差异均有统计学意义(P<0.05);再灌注1 h时间点BV仅与再灌注4 h时间点差异有统计学意义(P<0.05);各时间点MTT差异均无统计学意义;再灌注1 h时间点PS与再灌注3 h、4 h时间点比较差异均有统计学意义(P<0.01),再灌注2 h和4 h时间点PS差异有统计学意义(P<0.05)。
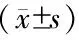
表1 IRI组与sham组灌注参数比较以及 IRI组各时间点灌注参数结果比较
2.2 IRI组与sham组各时间点灌注参数比较 sham组各时间点灌注参数差异均无统计学意义。IRI组BF在再灌注4 h与sham组比较差异有统计学意义(P<0.05);IRI组BV在再灌注2 h、3 h、4 h时与sham组比较差异均有统计学意义(P<0.01);IRI组MTT在各时间点与sham组比较差异均有统计学意义(P<0.01和0.05);IRI组PS在再灌注3 h和4 h时与sham组比较差异均有统计学意义(P<0.01)。见表1。
2.3 小肠黏膜生化指标比较 IRI组各时间点小肠黏膜生化指标差异有统计学意义,MDA除在再灌注3 h时稍有下降外,随着再灌注时间的延长整体呈上升趋势,SOD变化则与之相反。在再灌注4 h时的MDA和SOD值,IRI组与sham组比较差异均有统计学意义(P<0.05),见图1。BF、BV与MDA呈负相关(r=-0.714、-0.713,P<0.01),BF、BV与SOD呈正相关(r=0.641、0.677,P<0.01),见图2。

图1 IRI组、sham组4个时间点肠黏膜的MDA含量和SOD活性。IRI组中随着再灌注时间延长,MDA含量呈增加趋势,SOD含量呈下降趋势;但在再灌注3 h,MDA和SOD含量有一定程度恢复
2.4 小肠黏膜病理观察 IRI组可见小肠黏膜上皮有不同程度的脱落,可见裸露的固有层,黏膜内有数量不等的中性粒细胞浸润,间质水肿,毛细血管充血扩张,见图3。sham组则肠黏膜、黏膜下层结构完整,肠壁内未见炎性细胞,见图4。IRI组再灌注1 h、2 h、3 h、4 h小肠黏膜损伤评分分别为(3.2±1.2)、(3.7±1.1)、(3.5±1.2)、(3.6±1.2)分,缺血组评分4.0分,IRI各组间及其与缺血组间评分差异均无统计学意义(P>0.05)。

图2 BF、BV与MDA、SOD相关散点图,BF和BV与MDA呈负相关,BF、BV与SOD呈正相关

A:BF;B:BV;C:MTT;D:PS;E:小肠黏膜上皮脱落,间质扩张充血,黏膜内可见炎性细胞浸润,病理分级4级(HE染色,×100);F:黏膜内大量浸润的中心粒细胞,见黄色箭头(HE染色,×200)

A:BF;B:BV;C:MTT;D:PS,灌注图显示小肠血流灌注丰富、大致均匀;E:黏膜、黏膜下层结构完整,肠壁内未见炎性细胞浸润(HE染色,×40)
3 讨 论
小肠IRI是一个复杂的、多因素参与的病理生理过程。其中主要的一个病理生理过程就是产生的活性氧致微循环损伤。随着灌注CT扫描可以多层容积灌注以及灌注后处理软件的进一步成熟,特别是运动校正功能的运用,小肠CT灌注变得可行。Sitek等[10]通过移动修正、动态增强CT及单室血流动力学模型初步证实了CT灌注评价小肠血流动力学的可行性。
本研究发现,在小肠发生IRI时,小肠微循环呈现低血流变化。随着再灌注时间的延长,BF除在再灌注3 h时稍有恢复外,整体呈下降趋势。IRI主要是以急性炎性反应的方式影响毛细血管后使微循环损伤,其中白细胞和血管内皮细胞的黏附是损伤的主要原因,随着炎性细胞特别是中性粒细胞的增多,可以导致血管管腔逐渐堵塞,血流速度缓慢[11],上述机制是导致BF下降的原因。再灌注期间BV变化的趋势与BF相仿,BV在再灌注1 h、2 h时下降幅度最大,由于小肠IRI导致内皮细胞肿胀,血管舒张功能障碍以及组织水肿所致的组织间隙压的增高而致毛细血管受压狭窄[3],以上机制可能是再灌注期间BV下降的病理生理机制。本研究发现再灌注各时间点的MTT基本无变化,差异无统计学意义。但是IRI组MTT低于sham组,在小肠发生IRI期间,肠壁内小血管发生持续收缩,导致对比剂在血管内停留的时间较短[12],这可能是IRI组MTT较低的原因,具体机制还有待进一步研究。
生物体内SOD活性的高低反映机体清除自由基的能力,也间接地提示体内自由基是否过剩,当IRI时,产生的相当多的氧自由基致SOD过度消耗。本研究发现BF、BV与SOD呈正相关、与MDA呈负相关。这说明MSCT灌注的结果能比较客观地反映小肠IRI的情况。
本研究发现缺血2 h再灌注后的回肠黏膜组织损伤并没有进一步加重,甚至病理评分略低于单纯缺血时的黏膜损伤。有研究[13]表明,再灌注后肠黏膜损伤会进一步加重,该类研究都是用啮齿类动物来制作小肠IRI模型,我们分析这类动物体内的黄嘌呤氧化酶远高于猪,这可能是导致本研究与以上研究结果相反的原因。
本研究的不足:虽然MSCT灌注后处理软件具有运动校正功能,但呼吸运动和肠道蠕动造成的伪影对MSCT灌注结果仍有一定的影响。由于山莨菪碱及胰高血糖素等抑制肠道蠕动药物对微循环有保护作用,所以本研究未加以采用。另外,由于小肠肠壁菲薄,即使是肠襻聚集区域,在选取ROI时由于腹腔内脂肪及肠腔内气体的影响无法完全避免,时间-密度曲线表现杂乱无章,本研究中此问题无法克服。此外,本研究动物数量较少,更正确的结果有待扩大样本量进一步研究。
综上所述,MSCT灌注成像技术对小肠IRI肠壁微循环的改变有一定的诊断价值,其中BV、BF与反映IRI的生化指标具有很好的相关性,能敏感地反映小肠IRI微循环损伤状况,有望为小肠IRI的诊断提供新的手段。
[1]Stringa P, Lausada N, Romanin D, et al. Defining the nonreturn time for intestinal ischemia reperfusion injury in mice[J]. Transplant Proc, 2012, 44(5):1214-1217.
[2]Guzel A, Kanter M, Guzel A, et al. Anti-inflammatory and antioxidant effects of infliximab on acute lung injury in a rat model of intestinal ischemia/reperfusion [J]. J Mol Histol, 2012, 43(3):361-369.
[3]Vollmar B, Menger MD. Intestinal ischemia/reperfusion: microcirculatory pathology and functional consequences [J]. Langenbecks Arch Surg, 2011, 396(1):13-29.
[4]Hsieh YH, Mccartney K, Moore TA, et al. Intestinal ischemia-reperfusion injury leads to inflammatory changes in the brain [J]. Shock, 2011, 36(4):424-430.
[5]Cerqueira NF, Hussni CA, Yoshida WB. Pathophysiology of mesenteric ischemia/reperfusion: a review [J]. Acta Cir Bras, 2005, 20(4):336-343.
[6]Reginelli A, Genovese E, Cappabianca S, et al. Intestinal Ischemia: US-CT findings correlations[J]. Crit Ultrasound J, 2013, 5 Suppl 1:S7.
[7]Liu KX, Rinne T, He W, et al. Propofol attenuates intestinal mucosa injury induced by intestinal ischemia-reperfusion in the rat[J]. Can J Anaesth, 2007, 54(5):366-374.
[8]Ambrose MS, Valdiviezo C, Mehra V, et al. CT perfusion: ready for prime time [J]. Curr Cardiol Rep, 2011, 13(1):57-66.
[9]Chiu CJ, Scott HJ, Gurd FN. Intestinal mucosal lesion in low-flow states. II. The protective effect of intraluminal glucose as energy substrate [J]. Arch Surg, 1970, 101(4):484-488.
[10]Sitek A, Sheiman RG. Small-bowel perfusion measurement: feasibility with single-compartment kinetic model applied to dynamic contrast-enhanced CT [J]. Radiology, 2005, 237(2):670-674.
[11]Boros M. Microcirculatory dysfunction during intestinal ischemia-reperfusion [J]. Acta Physiol Hung, 2003, 90(4):263-279.
[12]Anadol AZ, Bayram O, Dursun A, et al. Role of endogenous endothelin peptides in intestinal ischemia-reperfusion injury in rats[J]. Prostaglandins Leukot Essent Fatty Acids,1998,59(4):279-283.
[13]Suto Y, Oshima K, Arakawa K, et al. The effect of nicorandil on small intestinal ischemia-reperfusion injury in a canine model[J]. Dig Dis Sci, 2011, 56(8):2276-2282.

