乳腺囊内乳头状癌的钼靶X线表现
傅晶 施雄 余燕民
(1. 上海市闵行区妇幼保健院放射科,上海 201102;2.上海市黄浦区中心医院乳腺外科,上海 200002)
乳腺囊内乳头状癌(intracystic papillary carcinoma, IPC)因肿瘤局限于一囊腔内而命名。IPC是导管内乳头状癌的一种变异型,十分少见,发病率占乳腺恶性肿瘤的0.5%~2%[1]。IPC的组织学特征是呈乳头状瘤样结构的恶性上皮性增生,但无浸润性。IPC的钼靶X线表现缺乏乳腺癌的主要征象,术前易被误诊为良性肿瘤。因此,本研究回顾分析了经手术病理证实的9例IPC的临床特点、钼靶X线表现,旨在提高IPC的诊治水平。
1 资料和方法
1.1 一般资料 选择2010年1月—2013年12月在上海市闵行区妇幼保健院与黄浦区中心医院经手术病理证实的9例IPC患者,均为女性,年龄57~77岁,平均70岁,均以发现乳腺肿块就诊,2例伴有浆液性乳头溢液。肿块位于右乳5例、左乳4例;内上象限2例、内下象限1例、外上象限3例、外下象限1例、中央区2例。首发表现均为单侧乳房肿块,无疼痛感。肿块最大径12~40 mm,平均23 mm,质地中等偏硬、表面光滑、边界清、活动度欠佳、无酒窝征及橘皮样外观;双侧腋下及锁骨上、下未扪及肿大淋巴结,4例曾误诊为良性占位。
1.2 仪器和方法 采用美国GE公司生产的Senographe DS全数字化平板乳腺成像系统摄片,9例患者均常规摄取乳腺头尾位片和内外45°斜位片,必要时加压摄侧位片。
2 结 果
乳腺钼靶X线检查显示,病灶呈类圆形或不规则,高或中等密度,边缘多光滑或浅分叶,皮下脂肪完整,乳头皮肤正常。病灶钼靶X线表现:肿块呈类圆形5例(图1),不规则形4例(图2);肿块边缘光滑6例(图3),浅分叶状3例(图4);肿块密度高于周围正常组织7例(图5),等同于周围正常组织2例(图6);病灶不伴钙化6例,伴钙化3例(图7),钙化呈粗细不等的颗粒状,少于10粒。
所有病例均未见毛刺样肿块,无成簇钙化,无腋前窝淋巴结肿大。术前X线诊断为良性占位或提示异常征象,乳腺影像报告及数据系统(BI-RADS)分级:Ⅲ级4例,ⅣA级5例(其中诊断及可疑IPC3例,另2例未明确诊断)。
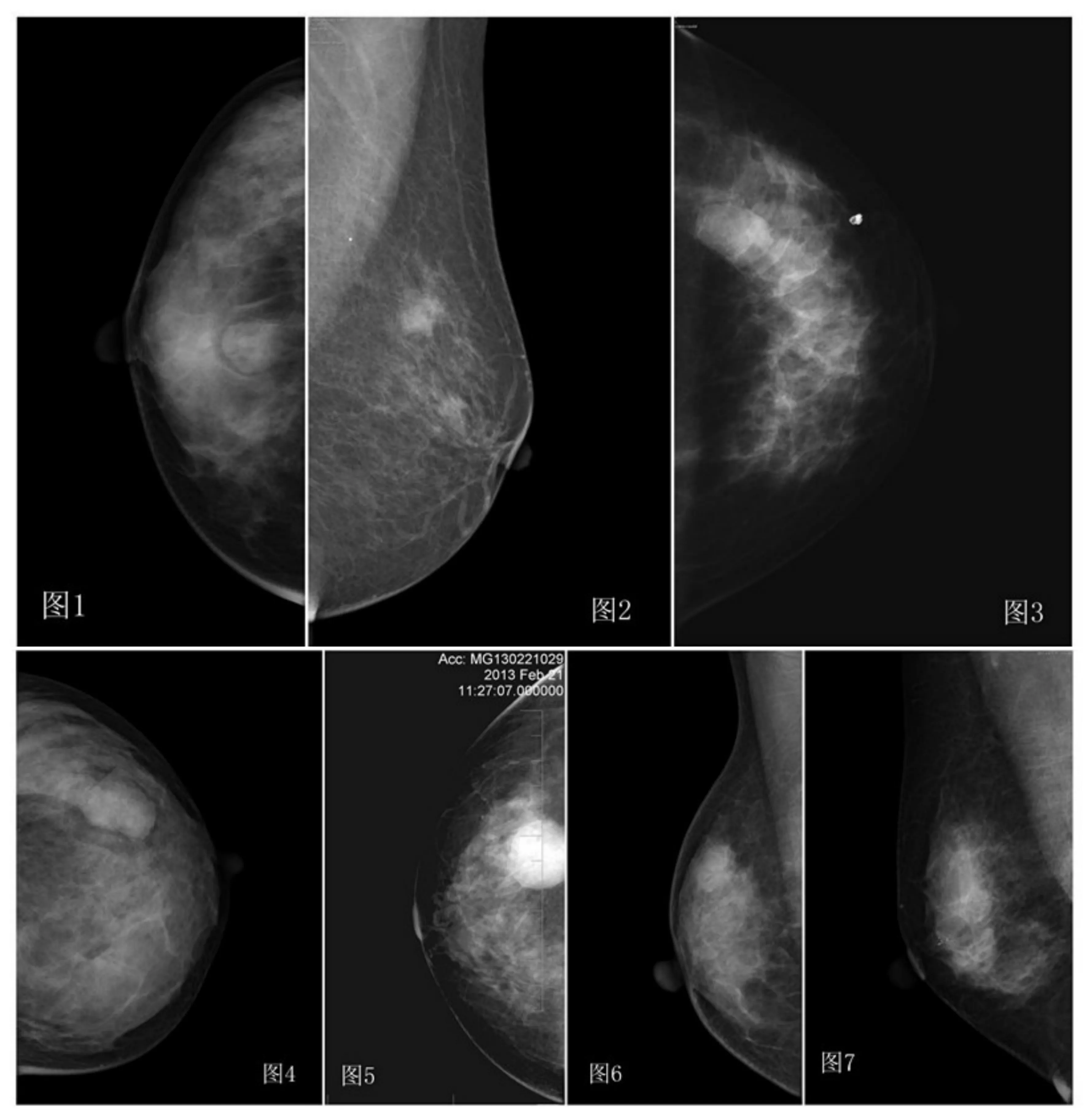
图1,肿块形态呈类圆形;图2,肿块形态呈不规则形;图3,肿块边缘光整;图4,肿块边缘浅分叶状;图5,肿块密度高于周围正常组织;图6,肿块密度等同于周围正常组织;图7,肿块伴有钙化。
3 讨 论
IPC是一种具有独特组织学特征的肿瘤,除扩张的囊内可见到乳头状癌外,其囊壁内衬的细胞亦为肿瘤性,且无肌上皮存在,提示其可能是分化较好的原位癌向浸润性癌进展的病变[2]。世界卫生组织(WHO)2003分类中将其归为导管内乳头状癌的一种特殊亚型,发生于囊状扩张的导管内[3]。IPC的发病率在乳腺癌中仅占不到2%,十分少见。本组9例IPC均在钼靶片上显示肿块,但以良性X线表现为主,术前误诊率达50%(4/9)。
3.1 临床特点 本组9例患者最小年龄57岁,最大年龄77岁,平均年龄70岁,与文献[4]报道相近。乳腺导管内乳头状癌多见于中老年妇女,患者多以乳腺肿块为首发症状就诊,可伴有乳头溢液,少数仅以乳头溢液为主要症状就诊[5]。本组患者均以发现乳腺肿块就诊,查体发现乳腺有一肿块,质地中等、偏硬,表面光滑,边界清,活动度欠佳,酒窝征(-),橘皮征(-),双侧腋下及锁骨上、下均未扪及肿大淋巴结。2例患者伴有少量浆液性乳头溢液。临床触及肿块及发现乳头溢液/血对提示病灶和病变部位有帮助,但触诊类似良性占位。
IPC肿块常较大,本组9例肿块最大径为12~40 mm,平均20 mm。此外,IPC可发生于乳腺导管系统内任何部位,主要发生于乳晕后大导管内[6]。但本组的9例IPC中,仅有2例发生于乳晕后大导管内,其余7例分别发生于离乳头较远的4个象限的2级以下导管内,造成这种差异的原因可能在于本组病例较少。
3.2 病理改变及X线表现 (1)IPC肿块以类圆形为主,边缘多光滑或浅分叶,无毛刺征象。病理结果:切面囊实性,有完整囊腔,囊内充满颗粒状或乳头状灰红色或灰白色组织,质脆、易出血,肿瘤与周围组织界限明显。镜下观察:肿瘤均位于完整的厚纤维囊内。病灶边缘清楚光整是导致我们误判为良性占位的主要原因之一;(2)肿块呈高或中等密度,以高于周围腺体组织密度为主,局部伴有颗粒状钙化。瘤体密度增高及伴钙化的病理基础可能与癌细胞DNA含量增加、囊内出血、含铁血红素沉着及组织坏死有关。
本组病例均未见到诊断乳腺癌的直接征象,如成簇钙化或者毛刺肿块,但通过诊断为良性占位的钼靶片比较分析,能够发现一些次要征象:(1)肿块边缘光滑,密度较高,周围局限性结构紊乱;(2)呈现密度中等的小结节(直径约1cm),周围呈非对称片状高密度影;(3)星芒征,其及时发现对于不典型乳腺癌的诊断有一定的价值[7]。本组5例诊断为ⅣA级,其中3例怀疑IPC,其肿块外形以光滑整齐为主,通过仔细观察能发现以上一些征象;另2例患者,在其肿块边缘的某一部分可见局限性不规则向外侵犯征象,但与一般乳腺癌较难鉴别,必要时需进一步行乳腺导管造影以明确诊断。
3.3 鉴别诊断 本组9例的肿块X线表现缺乏恶性直接征象,且有4例曾诊断为良性占位。因此,需将IPC与乳腺纤维腺瘤及囊肿相鉴别。
3.3.1 乳腺纤维腺瘤 乳腺纤维腺瘤好发于青春期妇女(腺瘤钙化者的年龄可稍大),为单发或多发,多发者呈散在分布,最大径多为1~3 cm,可发展成巨大肿块。肿瘤边界清楚、表面光滑、质硬、活动度大,与皮肤基底无粘连。钼靶X线表现为圆形、卵圆形块影,边缘光滑、整齐、锐利,密度常均匀,与周围腺体组织密度相近,当肿瘤较大且呈分叶状时,可显示密度不均。块影周围脂肪组织被挤压可使其形成一宽约1 mm的透明晕,块影内有时可见片状、粗颗粒状钙化灶。钙化灶常位于瘤体中央,被施压后形态变化不大。X线上测得的瘤体大小常大于临床测量值。
3.3.2 乳腺囊肿 乳腺囊肿好发于中年女性,钼靶X线常表现为单发或多发肿块,多发者互相挤在一起。单发者多呈圆形,形态变化小,向各方向等速扩展,其长轴与胸壁垂直或指向乳头;多发者可因互相挤压而呈卵圆形、半圆形、新月形等,罕有发展成巨大者。乳腺囊肿密度均匀,近似或略高于周围萎缩的腺体组织密度。囊肿壁偶有钙化,钙化可呈环状、阴影淡薄。较大囊肿推压周围脂肪组织,使其呈透明晕影。
IPC患者如果以溢液/血为主,触诊肿块不明显,钼靶X线片无典型异常表现,可行乳导管造影的,应与乳腺导管内乳头状瘤、导管上皮非典型增生、导管内癌等鉴别。本组病例中2例有浆液性溢液,触诊有包块,故未再行导管造影。
3.4 预后 IPC预后较好。Lefkowitz等[4]报告,IPC患者10年生存率为100%,10年无病生存率为91%。IPC的预后与肿瘤周围是否伴有导管内癌或浸润性癌有关,当周围乳腺组织中不存在导管内癌或浸润性癌时,IPC的预后非常好[8]。本组9例均属于上述情况。但Solorzano等[9]报道,2例IPC分别于术后28个月和7年出现腋淋巴结转移和骨转移;Mulligan等[10]报告,2例经过广泛取材的IPC出现前哨淋巴结转移。
综上所述,对于以乳腺肿块为首发症状就诊的患者,若伴有或不伴有乳头溢液/血;查体肿块质地中等偏硬、表面光滑、边界清、活动度欠佳;钼靶X线表现为肿块偏大(直径>2 cm)、高密度、边缘光滑或浅分叶、伴有或不伴有颗粒状钙化,或呈现密度中等的小结节(直径约1 cm)、周围呈非对称片状高密度影,应首先考虑IPC。尤其是对于老年妇女,若其乳腺中发现密度显著高于腺体、直径>2 cm的单发肿块,即使边缘光滑仍应考虑IPO。此外,应认真观察IPC钼靶X线片上可能存在的异常征象,如肿块周围潜在小钙化、星芒征等,以提高诊断率。
[1]郭琳沽,吴中耀,张胜,等.葡萄膜黑色素瘤病理学特征与预后的关系[J].中华病理学杂志,2002,31:518.
[2]卢晓梅,柳玮华.乳腺囊内乳头状癌4例临床病理分析[J].临床和实验医学杂志, 2012,1(11):36-39.
[3]Tavassoli FA,Devilee P.World Health Organization classificationoftumours.Pathology and genetics of tumours of the breast andfemalegenitalorgans[J].Lyon:IARC Press,2003:78-80.
[4]Lefkowitz M,Leftkowitz W,Wargotz ES.Intraductal (intracystic) papillary carcinoma of the breast and its variants:acliniconpathological study of 77 cases[J].Hum Pathol,1994,25(8):802-809.
[5]李树玲.乳腺肿瘤学[M].北京科学技术文献出版社,2000:241-242.
[6]鲍润贤.中华影像医学乳腺卷[M].北京:人民卫生出版社,2003:125-127.
[7]殷国玮,章龙娇,吴雪梅,等.全数字化乳腺摄影对不典型乳腺癌诊断的应用价值[J].上海医学影像,2008,17(1):12-14.
[8]Inoue S,Kunitomo K,Okamoto H,et al.A case of male noninvasive intracystic papillary carcinoma forming a tumor inthe nipple duct[J].Breast Cancer, 2003,10(1):85-88.
[9]Solorzano CC,Middleton LP,Hunt KK,et al.Treatment andoutcome of patients with intracysticpapilary carcinoma of thebreast[J].Am J Surg,2002,184(4):364-368.
[10]Mulligan AM,Malley FP.Metastatic potential of encapsulated(intracystic)papilary carcinoma of the breast:a report of 2 caseswithaxilary lymph node micrometastases[J].Int J SurgPathol,2007,15(2):143-147.

