肺癌骨转移SPECT/ CT融合图像的影像学特点分析
张一秋 石洪成 李蓓蕾 修雁 顾宇参 陈曙光 蔡良
(复旦大学附属中山医院核医学科,上海 200032)
晚期肺癌患者常出现肿瘤骨转移。99Tcm-亚甲基二膦酸盐(99Tcm-methylene diphosphonate,99Tcm-MDP)全身骨显像是诊断肿瘤骨转移的常用方法,其诊断骨转移病灶的灵敏度高,但特异性较低。目前已有较多有关肺癌骨转移全身骨显像中病灶分布特点的研究[1-2],但这些研究中的诊断结果往往缺乏病理结果的证实或随访确认,因而存在假阳性结果的可能。单光子发射计算机断层显像/计算机断层成像(single photon emission computed tomography/ spiral computed tomography,SPECT/CT)通过一次检查同时获得SPECT与CT图像,并将二者进行同机融合,既反映了骨骼的功能和代谢特点,又明确了病变骨骼的形态学变化情况,进一步提高了诊断肿瘤骨转移的灵敏度和特异性[3-8]。我们的前期研究[7]显示,SPECT/CT显像较全身骨显像能为肺癌骨转移提供更多的信息,因而提高了诊断的准确性。本研究分析了肺癌骨转移病灶SPECT/CT显像的图像特点,以评价SPECT/CT显像对肺癌骨转移的诊断价值。
1 资料与方法
1.1 一般资料 2008年4月—2012年6月共有17553例患者在复旦大学附属中山医院行全身骨显像,其中9943例因全身骨显像不能明确诊断而行SPECT/CT显像,其中因疑似肺癌骨转移而行SPECT/CT显像者4071例。本研究从中筛选出经病理确诊为肺癌且无其他恶性肿瘤病史的患者113例,均根据初次全身骨显像及SPECT/CT显像诊断为骨转移;其中5例患者术后病理证实为骨转移,其余108例患者至少再行1次全身骨显像及SPECT/CT显像随访,确认诊断为肿瘤骨转移。随访未能明确诊断或初次诊断错误者未纳入本研究。113例患者中男性68例,女性45例;年龄29~77岁,平均年龄(58.6±9.8)岁;其中腺癌90例,鳞癌5例,腺鳞癌3例,大细胞癌1例,小细胞癌14例。随访至2013年6月,从初次全身骨显像及SPECT/CT显像至再次显像确认诊断为肿瘤的骨转移时间为2~33个月,平均(7.8±6.4)个月。
1.2 骨平面显像及SPECT/CT显像方法 静脉注射99mTc-MDP(上海欣科医药有限公司生产)1110MBq后3~6 h,先行全身骨显像。由1名经验丰富的核医学科医师分析全身骨显像图像后,选择不能确定诊断的病灶行SPECT/CT显像。SPECT/CT显像采用荷兰Philips公司生产的Precedence型SPECT/CT(16排)。CT采集条件为:120 kV,160 mAs,视野 400 mm,层厚5 mm,层间距2.5 mm。图像重建层厚2 mm。SPECT图像采集的条件为:双探头平行采集,分别旋转180度,15 s/帧,矩阵64×64。应用荷兰Philips公司推荐的Astonish程序处理核医学原始图像,采用荷兰Philips公司配备的Syntegra软件进行SPECT与CT图像融合。
1.3 诊断标准
1.3.1 SPECT/CT融合图像的诊断标准[5-9](1)肿瘤骨转移:SPECT图像放射性异常病灶处,CT表现为溶骨性或(和)成骨性骨质破坏,伴或不伴有软组织肿块;或SPECT图像无明显放射性异常分布,CT表现为明显溶骨性骨质破坏;(2)良性病变:SPECT图像放射性异常病灶处,有明确的手术、外伤、放疗史;CT表现为非病理性骨折、关节脱位、骨囊肿、骨岛及其他良性骨肿瘤性病变以及骨质增生、硬化、骨赘形成、椎体压缩及其他骨关节退行性病变等,无骨质破坏及软组织肿块表现。
1.3.2 随访诊断标准[7-8](1)肿瘤骨转移:随访过程中,初次诊断为肿瘤骨转移的病灶增大,或者类似的病灶数量增多,CT出现溶骨或成骨性骨质破坏;(2)良性病变:随访过程中,初次病灶的放射性异常分布消失,CT未出现溶骨或成骨性骨质破坏,且患者自始至终无骨痛等症状。
1.4 图像分析 2位核医学医师共同分析全身骨显像平面图像,结合SPECT/CT融合图像,达成一致结论。将再次全身骨显像及SPECT/CT显像与初次显象结果进行对比分析。
2 结 果
113例肺癌骨转移患者共482处病灶纳入本研究,其中肺癌骨转移病灶429处,转移灶位于脊柱(包括颈椎、胸椎和腰椎)者占50.6%(217/429),胸廓(包括肋骨、锁骨、胸骨和肩胛骨)29.1%(125/429),骨盆(包括髋骨、骶骨和骶髂区)17.0%(73/429),四肢2.1%(9/429),颅骨1.2%(5/429)。SPECT/CT融合图像所示不同病理类型的肺癌骨转移病灶的部位分布见表1。初次病灶SPECT/CT图像表现为放射性异常浓聚者占90.7%(389/429),无放射性分布异常者占9.3%(40/429)。CT图像表现为成骨性转移占41.0%(176/429),溶骨性转移占50.3%(216/429),混合性(兼有溶骨和成骨)转移占4.0%(17/429),骨质形态学正常者占4.7%(20/429)。SPECT/CT融合图像所示不同病理类型肺癌骨转移病灶骨质改变的CT表现见表2。此外,113例患者中有23例患者同时伴有良性病灶,共53处,主要表现为退行性病变、创伤、良性骨肿瘤病变,随访全身骨显像或SPECT图像示放射性浓聚减淡或消失,且CT图像表现无明显变化,患者无明显骨痛等症状(图1)。
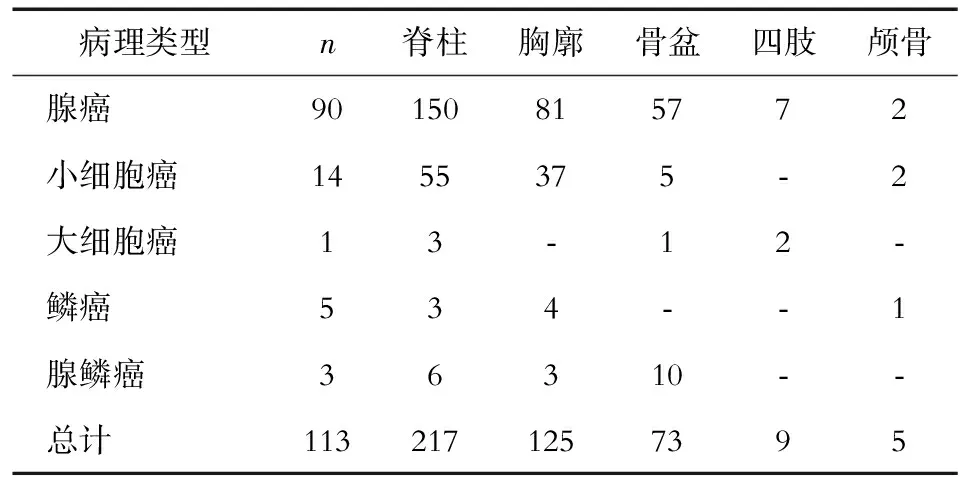
表1 SPECT/CT融合图像示不同病理类型肺癌骨转移病灶的部位分布(n)
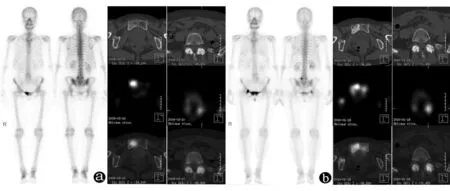
图1女性,61岁。a:初次全身骨显像示第5腰椎左侧和右侧耻骨放射性浓聚;SPECT/CT融合图像示右侧耻骨溶骨性骨质破坏伴放射性异常浓聚,第5腰椎椎小关节退变伴左侧椎小关节放射性异常浓聚。b:10个月后复查,全身骨显像示第5腰椎左侧放射性浓聚无明显变化,右侧耻骨放射性浓聚范围明显增大;SPECT/CT融合图像示右侧耻骨骨质破坏伴放射性异常浓聚病灶增大,第5腰椎椎小关节退变伴左侧椎小关节放射性异常浓聚,较前无明显变化
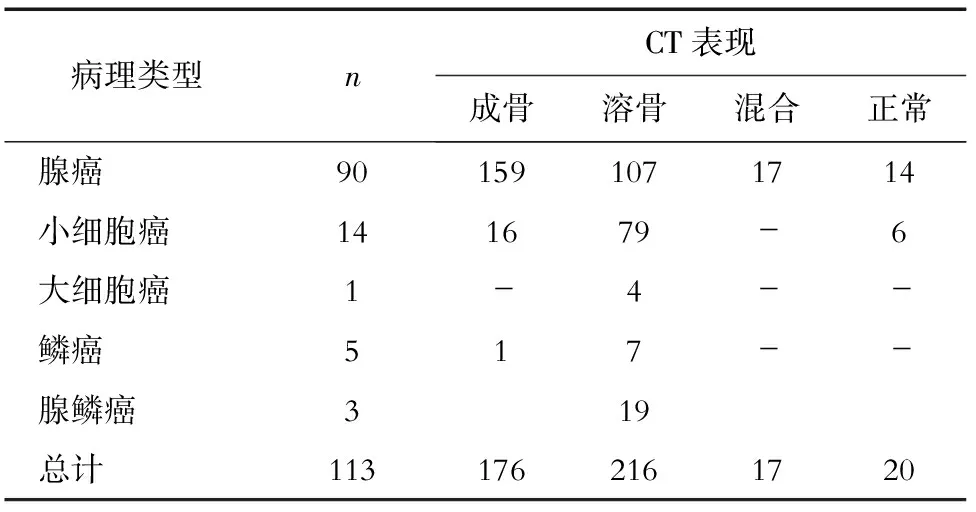
表2 SPECT/CT融合图像示不同病理类型肺癌骨转移病灶骨质改变的CT表现(n)
3 讨 论
肺癌骨转移可导致病理性骨折、脊髓压迫、严重骨痛和高钙血症等骨骼相关事件(skeletal-related events,SRE),严重影响患者生活质量。了解肺癌骨转移的特点和规律,有助于骨转移的早期诊断,这对改善患者预后及提高患者生活质量至关重要。
全身骨显像对肿瘤骨转移高度敏感,是早期诊断恶性肿瘤骨转移的较好方法。其诊断原理为:骨转移灶局部的血流量及骨代谢发生异常改变,大多数成骨性病灶表现为骨质代谢的增强,而溶骨性病灶的周围骨骼常伴有不同程度的代谢活跃,这种高代谢的骨质部分会摄取更多的放射性药物,从而使骨转移病灶易于被检出。以往多采用全身骨显像诊断肺癌骨转移[1-2]。然而,全身骨显像对骨折、炎性反应、良性骨肿瘤等均显示放射性分布异常,因其显示的是重叠的平面影像,难以鉴别放射性分布异常区域的病变性质。SPECT/CT借助CT的空间分辨力和密度分辨力,可准确地显示溶骨和成骨性改变,有助于识别骨折、退行性病变等病变的形态学改变,有效地提高了诊断的灵敏度和特异性;但是,一次SPECT/CT显像常不能确诊[7-9]。本研究通过病理学诊断或再次全身骨显像及SPECT/CT显像对第一次SPECT/CT显像的诊断结果加以验证。结果显示,初次SPECT/CT显像诊断为肺癌骨转移的429处病灶中有90.7%(389/429)表现为放射性异常浓聚,其余9.3%(40/429)骨显像表现为阴性;此外,23例患者伴有53处良性病灶,SPECT/CT均表现为放射性异常浓聚,随访示放射性浓聚减淡或消失。以上结果充分证明了SPECT/CT显像的高敏感度和特异性。
肺癌的播散途径有直接侵犯、淋巴道转移、血行转移和种植转移。不同病理类型肺癌的主要播散途径不同:肺鳞癌以淋巴道转移为主,小细胞肺癌早期即有血行和淋巴道转移,肺腺癌往往兼有淋巴道和血道转移。肺癌以腺癌和小细胞癌发生骨转移较为常见,转移部位以脊柱最多见,其次是肋骨[10]。腺癌多发生于肺的周边,容易直接侵犯邻近肋骨和胸椎;此外,肿瘤细胞经血液循环到达骨骼,容易在含红骨髓的躯干骨生长和繁殖,而较少在含黄骨髓的四肢骨生长。腺癌以成骨性转移为主,而小细胞肺癌兼有溶骨性转移和成骨性转移[2]。本研究显示,肺癌转移的部位以脊柱为主,胸廓次之;骨转移患者以腺癌多见,且以成骨性转移为主。
综上所述,SPECT/CT显像敏感度高,特异性好,较全身骨显像可更好地显示骨转移病灶的性质,
可为肺癌患者骨转移病灶的进一步检查及治疗提供更为准确的信息。
[1]张莉华, 谢文晖, 俞志昌. 1500例肺癌患者核素骨显像结果分析[J]. 中华核医学杂志, 1999(1), 19:6-7.
[2]刘宇, 周道安. 肺癌骨转移的临床病理特点分析[J]. 现代肿瘤医学, 2008, 16(3):367-369.
[3]张一秋, 石洪成, 陈曙光, 等. SPECT/CT融合图像对脊柱单发病灶鉴别诊断的增益价值[J]. 中国临床医学, 2010, 17(5): 741-744.
[4]Zhao Z, Li L, Li F, et al. Single photon emission computed tomography/spiral computed tomography fusion imaging for the diagnosis of bone metastasis in patients with known cancer[J]. Skeletal Radiol, 2010, 39(2):147-153.
[5]Helyar V, Mohan HK, Barwick T, et al. The added value of multislice SPECT/CT in patients with equivocal bony metastasis from carcinoma of the prostate[J]. Eur J Nucl Med Mol Imaging, 2010, 37(4):706-713.
[6]Zhang Y, Shi H, Gu Y, et al. Differential diagnostic value of single-photon emission computed tomography/spiral computed tomography with Tc-99m-methylene diphosphonate in patients with spinal lesions[J]. Nucl Med Commun, 2011,32(12):1194-1200.
[7]张一秋,石洪成,顾宇参,等.SPECT/螺旋CT骨显像对肺癌骨转移诊断的增益价值[J]. 中华核医学杂志, 2011,31(4):219-222.
[8]Zhang Y, Shi H, Cheng D, et al. Added value of SPECT/spiral CT versus SPECT in diagnosing solitary spinal lesions in patients with extraskeletal malignancies[J]. Nucl Med Commun,2013,34(5):451-458.
[9]Daisuke U, Shinya S, Masanori I, et al. Added value of SPECT/CT fusion in assessing suspected bone metastasis: comparison with scintigraphy alone and nonfused scintigraphy and CT[J]. Radiology, 2006, 238(1):264-271.
[10]Jasmin C, Coleman R, Coia L, et al. Textbook of Bone Metastases[M]. London: John Wiley & Sons Inc, 2005:523.

