20例肛管直肠黑色素瘤的临床治疗分析
李文翔 刘亚岚 韦烨 任黎 钟芸诗 秦新裕 牛伟新 许剑民
肛管直肠黑色素瘤(anorectal melanoma,ARM)的发病率极低,在黑色素瘤中占的比例不到1%,在结直肠和肛管肿瘤中占的比例不足0.5%,约占所有肛管肿瘤的4%[1-2]。尽管如此,肛管直肠是恶性黑色素瘤的第三个常见好发部位,仅次于皮肤和眼睛。手术切除是ARM首选的治疗手段,但是对手术方式的选择尚存争议。目前,国内外尚没有明确的关于ARM手术方式的指南。本文回顾性分析我院2002-2012年间收治的20例ARM患者的临床病历资料和随访资料,并结合相关文献,做一总结分析。
资料与方法
一、一般资料
20例患者中,男性8例,女性12例,男女比例为1 ∶1.5,发病的平均年龄为54岁(41~84岁)。首诊均以便血为主要的临床表现。其他症状包括肛门肿物或肿物脱出3例,肛门不适2例,大便性状改变2例以及腹痛2例。患者出现症状到就诊的平均时间间隔为6.4个月(0.5~60个月)。初诊误诊为痔疮的比例为40%(8/20)。8例误诊患者中3例已于外院按痔疮行局部切除术,1例行硬化剂局部注射治疗。MRI或CT显示5例患者伴有肝转移(25%),并且其中1例伴直肠周围淋巴结及多发骨转移,1例伴一侧精囊腺及盆腔淋巴结转移。
20例患者就诊时均做肠镜检查,19例取活检或局部切除肿块送检,常规病理诊断为恶性黑色素瘤的比例为94.7%(18/19)。其中有14例加做HMB-45、S-100、Vimentin染色进一步确诊,结果显示3个指标的阳性率均为100%。17例手术患者术前病理免疫组化确诊率为70.5%(12/17)。病理诊断中需要鉴别诊断的肿瘤包括上皮源性或肌源性肿瘤、低分化恶性肿瘤以及恶性间质瘤等。6例病理结果描述了光镜下黑色素瘤细胞典型的梭样或上皮样形态,其中1例观察到胞浆内明显的黑色素样颗粒。
20例患者中肛管直肠(肿块在齿状线周围或横跨齿状线)或肛管(肿块位于齿状线以下)黑色素瘤占19例,肿块距肛缘的平均距离为2.7 cm(0.5~5 cm),中位距离为3 cm,其余1例为直肠黑色素瘤(肿块在齿状线以上)[3]。肿瘤的平均直径为3.2 cm(1.7~7.0 cm),中位直径为3 cm。
二、治疗措施
15例无远处转移的患者中12例行腹会阴直肠癌根治术(abdominoperineal resection,APR),1例行APR+双侧腹股沟淋巴结清扫术,2例行局部切除术(local resection,LE)。3例患者术后予以IL-2治疗,2例患者术后2年内接受了IL-2/LAK方案的免疫治疗。1例患者术后1年内出现单侧腹股沟淋巴结肿大,后予以干扰素治疗,该患者因全身转移死亡。1例患者术后2月出现肝转移,目前行介入治疗中。5例肝转移患者中1例行APR术,1例行同步Dixon加肝转移灶切除术,其余3例患者中2例接受干扰素和IL-2为基础的免疫治疗,另外1例接受达卡巴嗪(DTIC)为基础的Dartmouth方案的化疗。
三、术后病理资料
17例手术患者原发灶病理均证实为恶性黑色素瘤。15例行根治术患者原发灶局限于黏膜下层、浸润肌层、浸润全层的比例为4:6:5,肠系膜或肠旁淋巴结转移比例为46.7%(7/15)。其中行APR加双侧腹股沟淋巴结切除术的患者腹股沟和肠旁淋巴结均未发生转移。肝转移灶同步切除的患者转移灶病理证实为转移性恶性肿瘤。免疫组化显示S-100、HMB-45、Vimentin的阳性率分别为100%(16/16)、93.7%(15/16)、100%(15/15)。加做眼球转录因子(microphthalmia-transcription-factor,MIFT)检测3例,结果均为阳性。加做CD117(C-KIT)检测7例,结果为阳性或部分阳性。15例行APR术的患者肿瘤上下切缘均未见癌累及。2例行LE术的患者中,1例环周切缘未见癌累及。另外1例未检测环周切缘,后该患者手术区域复发,再次行扩大的局部切除术(wide local resection,WLE)。
四、随访结果
以电话、信件或回院复查的方式进行随访,至2014年2月,完整随访17例,失访3例。最短随访时间为3个月,最长随访时间为110个月。20例患者的中位随访时间为13个月(3~110个月),中位生存时间为22个月(95% CI 3.0~41.0),1年、3年、5年生存率分别为65.0%、39.5%、19.7%(图1)。13例无肝转移并行根治术的患者中位生存时间为22个月,1年、3年、5年生存率分别为76.9%、31.9%、31.9%。术后发生转移4例,其中1例初为单侧腹股沟转移,后出现全身转移,2例肝转移,1例原发灶复发(表1)。未手术肝转移患者中1例在确诊后3月因全身转移死亡。
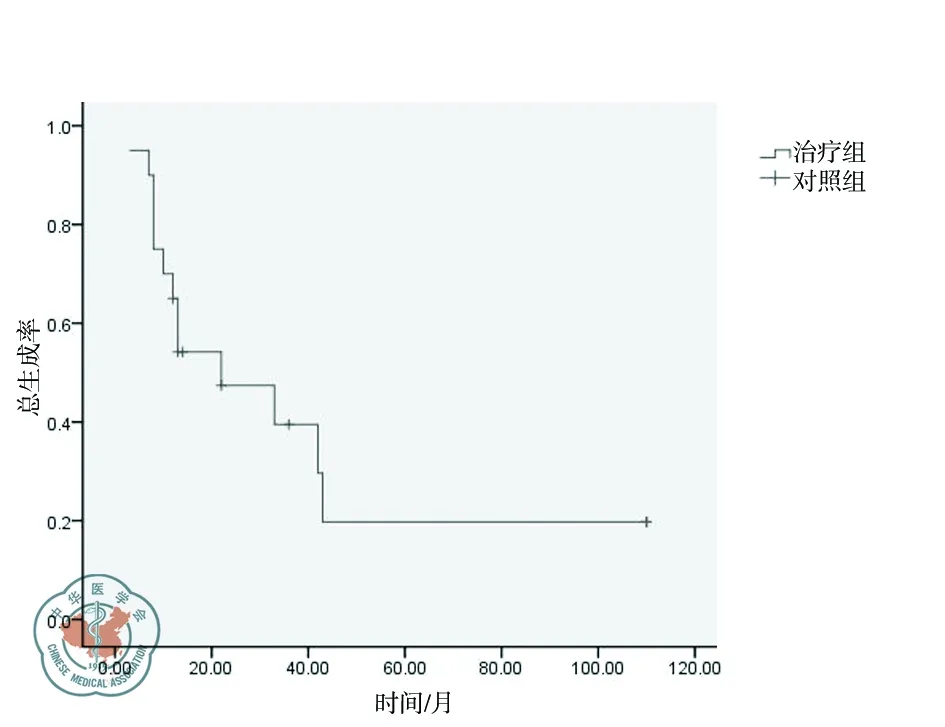
图1 Kaplan-Meier分析20例患者的生存曲线图
分析和讨论
一、ARM流行病学和病因学
尽管ARM是临床上极为少见的疾病,但肛管直肠是胃肠道原发性黑色素瘤最常见的好发部位,每年文献报道约500例。美国的年发病率为0.4/100万。ARM患者的预后极差,中位生存时间为2年,5年生存率在15%~30%左右。本组20例患者的5年生存率为19.7%。13例无转移并接受根治术的患者5年生存率为31.9%,显著高于5例肝转移患者的5年生存率(20%),但差异无统计学意义。ARM发
病的起始年龄在40岁左右,女性多见,50~60岁年龄段人群发病率增高[4]。本组平均发病年龄为54岁(41~84岁),男女比例为1∶1.5,与国内外报道的较为接近。临床上女性患者比例较高可能与女性例行会阴部妇科检查有关,但是肿瘤的生物学特点是否存在性别差异,目前未有相关研究。本组5例肝转移患者中4例为男性,推断可能和平时就诊频率较低有一定相关性。流行病学证据显示感染HPV的患者ARM的发生率增加,这或许是女性患者多发原因之一。另有研究显示ARM患者中感染HIV的比例较高,提示ARM的发生可能与患者本身的免疫抑制状态有关[5]。
对ARM的起源问题,一直有很大争议。目前较一致的观点认为ARM起源于齿状线移行区延伸至肛管的黑色素细胞,免疫组化证实正常情况下这一区域存在黑色素细胞。本组20例患者中肛管直肠/肛管黑色素瘤占19例,肿块距肛缘的平均距离为2.7(0.5~5 cm),中位距离为3 cm,大部分肿瘤位于肛缘和齿状线附近,与前述观点较为相符。与肛管直肠/肛管部位的黑色素瘤相比,直肠黑色素瘤较少见,本组只有1例(肿块距肛缘10 cm)。由于直肠黏膜不含黑色素细胞,有学者提出直肠黑色素瘤是肛管部位的黑色素细胞恶变后沿黏膜由下向上浸润所致,应视为一种转移,也有观点认为直肠黑色素瘤细胞可起源于接近齿状线的正常肠上皮。就本组中1例直肠黑色素瘤而言,该患者同时伴有肝转移,术后病理显示7枚肠旁淋巴结中4枚见肿瘤转移,肝转移灶也证实为转移性肿瘤。对直肠黑色素瘤的起源、临床特点等仍需进一步研究。
二、ARM临床特点
目前国际上广为采用的分类方法是根据肿瘤与齿状线的关系将ARM分为3类:位于齿状线下方和上方的分别称为肛管黑色素瘤和直肠黑色素瘤,在齿状线周围或横跨齿状线的称为肛管直肠黑色素瘤[3,6]。其中,齿状线以下是最常见的好发部位,肿块多位于齿状线距肛缘3 cm的范围内,本组这一比例占80%(16/20)。由于病变不易发现以及患者出现症状较晚等原因,与肛管黑色素瘤相比,直肠和肛管直肠黑色素瘤一般较大,浸润也较深。文献报道的肿瘤直径一般在3~4 cm左右[7],本组肿瘤平均直径为3.2 cm(1.7~7.0 cm),多数较大肿瘤位于齿状线以上,其中直径7 cm的为直肠黑色素瘤。目前研究认为,肿瘤的浸润深度而不单是肿瘤大小更有助于评估临床分期以及选择手术方式[8]。因此,术前应对ARM患者常规行超声内镜以及CT、MR检查,以全面了解肿瘤浸润层次和累及范围[9]。本组患者只有1例行超声内镜检查,因此内镜规范化诊疗有待于进一步加强。
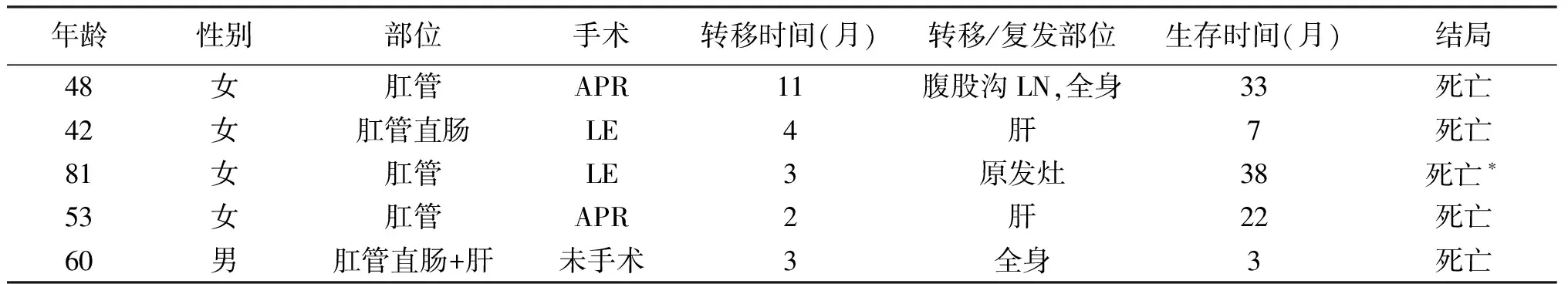
表1 复发转移患者具体资料情况表
ARM患者没有特异的临床表现。由于血供丰富,肿瘤容易破溃出血。超过半数患者有便血症状,其次为一些非特异性症状,包括肛门不适、疼痛、瘙痒、里急后重等。发生转移的患者则有消瘦、贫血等恶病质的表现。本组患者均有便血症状,其中伴肛门肿物或肿物脱出仅占3例,与近肛缘的病例较少以及大部分肿块无蒂有关。2例伴腹痛的患者均存在肝转移,且腹痛表现为右上腹痛。临床上ARM的误诊率很高,最易误诊为痔疮或其他直肠良性病变,部分黑色素瘤是在痔或肠息肉切除标本的病理检查中发现的。肠镜下少数肿块呈现黑色外观,并且约1/3的黑色素瘤没有色素沉积,导致临床上漏诊和误诊的比例较高。本组患者初诊误诊为痔疮的比例为40%(8/20)。8例误诊患者当时均未取活检,3例已于外院行痔切除术,1例行硬化剂注射治疗。误诊为痔疮的患者可能选择中医治疗或其他保守治疗方法,有研究显示误诊为痔疮的患者预后较差[10],因此,临床上降低误诊率显得尤为重要。降低误诊的方法有:(1)常规直肠指诊和内镜检查,特别应注意肿块颜色以及有无溃疡等;(2)多巴和酪氨酸酶反应;(3)电镜观察黑色素小体;(4)免疫组化染色。
三、ARM的转移途径
ARM的转移途径包括血运转移和淋巴转移。血运转移的常见器官包括肝、肺、脑等,大部分转移发生在确诊后的30个月内。临床上60%的患者会发生远处转移,约25%-38%的患者就诊时已伴有远处转移。有学者认为在肿瘤发生的过程中即伴随全身的播散转移,在原发灶比较明显的时候微转移灶就已形成,因此,ARM应视为一种全身性疾病[8]。本组患者初诊时转移病例占25%,至随访结束时新增4例转移病例,且转移均发生在术后1年内。总体转移比例偏低(45%)可能与病例数较少和随访信息不全有关。国外研究显示,约60%的患者存在局部淋巴结转移,远离齿状线的病变更易使局部淋巴结受累,可能是由于淋巴引流的不同。淋巴转移最常见的部位为肠旁淋巴结,其次是腹股沟淋巴结。本组20例患者局部淋巴结转移的比例为45%(9/20,影像学诊断2例,病理诊断7例),均为肠旁或盆腔淋巴结。本组只对1例肛管黑色素瘤患者行双侧腹股沟淋巴结切除,术后病理却未见转移。国外开展的前哨淋巴结定位术能发现腹股沟和盆腔的亚临床淋巴结转移,因而显示出较高的淋巴结转移比例,目前国内尚未开展这一方面的研究。
四、ARM病理特征
典型的ARM细胞为巢样排列的梭样或上皮样细胞,细胞异型明显,核分裂象多见,本组中描述的核分裂象约300个/50HPF。细胞内的色素颗粒有助于黑色素瘤的诊断,然而这一比例只占30%~70%。对于无黑色素(少色素)的肿瘤细胞,免疫组化可进一步鉴别和明确诊断,其中,S-100、HMB-45和Vimentin是最常用的检测指标,三者联合能够提高确诊率。HMB-45是恶性黑色素瘤的特异性抗体,在诊断方面具有较高的特异性;S-100的灵敏度较高,但是特异性不强[11]。在HMB-45阴性的情况下,Melan-A阳性也有助于确诊。本组中1例HMB-45呈阴性,由于未做Melan-A染色,故诊断为“高度倾向恶性黑色素瘤”。其他指标包括CK(细胞角蛋白)、CD117(C-KIT)、MITF等。超过95%的黏膜黑色素瘤CK呈阴性。上皮性肿瘤特别是肛管低分化癌CK染色呈阳性。本组行CK检测15例,11例为阴性,4例部分阳性病例均为肛管或肛缘肿瘤。因此,起源于肛管的黑色素瘤CK常呈阳性表达,在诊断时特别需要注意鉴别。本组行CD117检测7例,结果为阳性或部分阳性,显示出较高的阳性率。在ARM中,CD117的突变率约为15%。本组一例肝转移的患者测序显示C-KIT基因第9,11,13,17外显子未突变,另外一例无转移患者C-KIT基因11外显子也未突变。进一步检测C-KIT基因的突变率,可以为开展靶向治疗研究提供依据。
五、ARM分期和治疗
美国癌症联合会(American Joint Committee on Cancer,AJCC)根据浸润深度、淋巴结状态以及有无远处转移将ARM分为4(I-IV)期。SEER(surveillance,epidemiology,and end results)数据库将肿瘤划分为局部疾病、区域疾病和转移疾病3类。其中,局部疾病是指肿瘤完全局限于原发器官,区域疾病是指肿瘤侵及周围组织或累及区域淋巴结,转移疾病是指远处器官或淋巴结发生转移[12]。临床研究中后者的分期方法更为常用,但对行LE术的患者两者均有低估分期的风险。本组局部疾病、区域疾病和转移疾病的比例为9:6:5。7例病理证实的淋巴结转移部位均为肠旁淋巴结,肠系膜淋巴结均未见转移。一例患者的病理显示神经侵犯和脉管转移。肿瘤浸润深度和周围神经侵犯(peripheral nerve invasion,PNI)是ARM患者重要的预后因素[13]。未有研究发现局部淋巴结转移对局部复发和患者生存产生影响。前哨淋巴结定位术虽然能够发现腹股沟和盆腔的亚临床淋巴结转移灶,有助于评估分期,但是未有研究显示前哨淋巴结活检对患者整体生存和疾病复发产生影响,因此前哨淋巴结活检的可行性商存争议[14]。
外科手术仍然是ARM的主要治疗方法。其他治疗措施包括化疗、放疗和免疫治疗等。长久以来,APR和LE两种术式是争论的焦点。LE术的优势主要体现在手术并发症发生率低,并且避免了永久性造口导致的生活不便。与LE术相比,APR术能够清扫肠系膜淋巴结,根治性更为彻底。LE术后的局部复发率高达65%,与术中肿瘤细胞播散有关。APR术能够降低术后局部复发率,患者可避免二次手术。同时,APR术能够减少因局部复发而产生的一系列症状,例如大便失禁、出血等,从一定程度上也能提高患者的生活质量。但也有观点认为尽管根治术能有效降低局部复发率,但是并没有给患者带来生存获益,因为局部复发和多部位的远处转移通常是同步发生的。如前所述,ARM应视为一种全身疾病,局部的治疗对疾病转归没有影响。大部分回顾性研究表明APR术和LE术对患者的预后影响没有统计学意义。SEER数据库纳入了143例ARM患者,是迄今最大样本的研究。其中51例接受了APR术,92例接受了局部切除,两组患者的中位生存时间和5年生存率均无显著性差异[15]。对腹股沟淋巴结的处理,目前较一致的观点认为对临床阳性的腹股沟淋巴结可同步切除,对触诊阴性的患者行预防性双侧腹股沟淋巴结切除术并不能提高生存率,反而会带来一些手术相关并发症。最近的研究显示,与APR术相比,保留括约肌的LE术联合术后原发灶和区域淋巴结的放疗能够获得同样的局部疾病控制。
国外以往的文献多支持倾向APR术。目前,国外研究建议将肿瘤厚度作为手术的指南。若肿瘤厚度超过4mm,建议行APR术。大部分回顾性研究认为当技术上具有可行性并能获得阴性切缘时,建议采取LE术,只有对较大的肿块无法局部切除或出现梗阻等并发症时才采取APR术[16]。目前,国内大部分医生倾向APR术。本中心的治疗经验亦显示APR术是主要治疗手段,与多数肿瘤较大以及疾病处于进展期有一定相关性。由于存在两种不同的手术方式以及疾病的不良预后,医生的个人经验和患者偏向对术式选择也有一定影响。本组17例手术患者中只有2例女性选择LE术,1例为41岁年轻女性,1例为81岁老年患者。前者在外院误诊为环状痔并行局部切除,8个月后来我院行肠镜活检发现仍有肿瘤残余,再次行扩大的局部切除术,该患者术后6月因肝转移去世。至于老年患者,考虑其年龄和一般情况,初始行LE术,3月后因局部复发再次行手术切除,该患者术后38月因脑溢血去世。可见2例局部切除患者的治疗效果均欠佳,但对于高龄患者我们认为选择局部切除是合理的。
化疗、放疗和免疫治疗作为辅助或姑息治疗手段在ARM中的治疗作用尚未明确。黑色素瘤是化疗不敏感的肿瘤,无论单药还是联合给药都不能给患者带来生存获益[17]。尽管如此,化疗大约能使20%的进展期肿瘤获得一定的反应率。本中心早期对1例IV期肝转移患者实施化疗,后该患者出现全身转移,后续未再开展化疗的相关治疗研究。放疗作为一种局部治疗手段能够减少局部复发,特别适用于接受LE术的患者。Kelly等报道了54例LE术后接受放疗的患者,术后5年的局部复发率只有18%[18],但是没有研究显示术后辅助放疗能够提高患者的总体生存率。
与其他肿瘤相比,黑色素瘤更易受免疫系统的攻击。研究发现典型的黑色素瘤细胞周围有大量淋巴细胞浸润,因此推论一部分自行消退的黑色素瘤可能是由免疫反应介导。作为一种重要的治疗手段,白介素和干扰素为基础的免疫治疗已用于IV期和术后复发患者。通过输注荷载黑色素瘤抗原的树突细胞诱导主动免疫,目前在皮肤黑色素的研究和临床试验中取得了一定的成果,在ARM中的研究尚未展开。作为一种过继免疫治疗措施,LAK细胞输注在多种类型的肿瘤患者中取得了显著的疗效。本组2例患者术后接受了LAK为基础的免疫治疗,其中1例I期患者术后4年无复发,随访至今身体状态良好。
[1] Klas J V,Rothenberger D A,Wong W D,et al.Malignant tumors of the anal canal:the spectrum of disease,treatment,and outcomes.Cancer,1999,85(8):1686-1693.
[2] Roumen RMH.Anorectal melanoma in The Netherlands:a report of 63 patients.Eur J Surg Oncol,1996,22:598-601.
[3] Bello DM,Smyth E,Perez D,et al.Anal versus rectal melanoma:does site of origin predict outcome? Dis Colon Rectum,2013,56(2):150-157.
[4] Laforga Canales JB,Gasent Blesa JM.Amelanotic anorectal malignant melanoma:case report with immunohistochemical study and literature review.Case Rep Oncol,2009,2(1):30-37.
[5] Heyn J,Placzek M,Ozimek A,et al.Malignant melanoma of the anal region.Clin Exp Dermatol,2007,32(5):603-607.
[6] Weyandt GH,Eggert AO,Houf M,et al.Anorectal melanoma:surgical management guidelines according to tumour thickness.Br J Cancer,2003,89(11):2019-2022.
[7] Heeney A,Mulsow J,Hyland JM.Treatment and outcomes of anorectal melanoma.Surgeon,2011,9(1):27-32.
[8] Podnos YD,Tsai NC,Smith D,et al.Factors affecting survival in patients with anal melanoma.Am Surgeon,2006,72:917-920.
[9] Malik A,Hull TL,Floruta C.What is the best surgical treatment for anorectal melanoma? Int J Colorectal Dis,2004,19(2):121-123.
[10] Zhang S,Gao F,Wan D.Effect of misdiagnosis on the prognosis of anorectal malignant melanoma.J Cancer Res Clin Oncol,2010,136(9):1401-1405.
[11] Chute DJ,Cousar JB,Mills SE.Anorectal malignant melanoma:morphologic and immunohistochemical features.Am J Clin Pathol,2006,126(1):93-100.
[12] Kiran RP,Rottoli M,Pokala N,et al.Long-term outcomes after local excision and radical surgery for anal melanoma:data from a population database.Dis Colon Rectum,2010,53(4):402-408.
[13] Yeh JJ,Shia J,Hwu WJ,et al.The role of abdominoperineal resection as surgical therapy for anorectal melanoma.Ann Surg,2006,244(6):1012-1017.
[14] P Carcoforo,M.T Raiji,G.M,et al.Primary anorectal melanoma:an update.J Cancer,2012,3:449-453.
[15] Iddings DM,Fleisig AJ,Chen SL,et al.Practice patterns and outcomes for anorectal melanoma in the USA,reviewing three decades of treatment:is more extensive surgical resection beneficial in all patients? Ann Surg Oncol,2010,17(1):40-44.
[16] David AW,Perakath B.Management of anorectal melanomas:a 10-year review.Trop Gastroenterol,2007,28(2):76-78.
[17] Chapman PB,Einhorn LH,Meyers ML,et al.Phase III multicenter randomized trial of the Dartmouth regimen versus dacarbazine in patients with metastatic melanoma.J Clin Oncol,1999,17(9):2745-2751.
[18] Kelly P,Zagars GK,Cormier JN,et al.Sphincter-sparing local excision and hypofractionated radiation therapy for anorectal melanoma:A 20-Year Experience.Cancer,2011,117(20):4747-4755.

