一例转移性直乙交界癌患者治疗的反思
冯青阳 许剑民
一、病例简介
患者女性,30岁,2012年5月因“便秘伴大便少量带血4月余”入我院。患者既往体健;否认高血压、糖尿病、心脏病等慢性病史;否认肝炎、结核等传染病史;否认家族性遗传病史。患者已婚,育有1子。查体:体力状况评分(Zubrod-ECOG-WHO,5分法)0分;全身各浅表淋巴结未及肿大;心肺检查无异常;腹软,全腹无压痛、反跳痛,未触及肿块;肝脾肋下未触及;无移动性浊音;直肠指检未及明显异常。
患者入院后查肠镜示:距肛缘13 cm见一紫红色肿块,表面凹凸不平,质脆易出血,约占肠腔全周1/2,伴肠腔部分狭窄,肠镜尚能通过。活检病理示:腺癌,分化Ⅲ级。PET/CT检查示:直肠乙状结肠交界处肠壁明显增厚伴糖代谢异常增高,结合病史恶性可能性大;病变肠周多发淋巴结转移;肝右叶巨大转移;病变肠道与左侧附件分界欠清,左侧附件区见约42.4×36.1 mm囊实性占位,糖代谢轻度增高,局部侵犯不除外。查增强CT及MRI检查示:乙状结肠直肠交界区恶性肿瘤侵犯周围脂肪间隙,伴周围淋巴结肿大;肝脏较大转移灶(图1)。胸部CT检查未见明显异常。
患者参加多学科团队(multidisciplinary team,MDT)会议讨论:直肠乙状结肠交界癌伴肝转移诊断明确cT4NxM1,IV期。原发灶累及周围组织,可以切除;肝转移灶体积较大,手术风险大,为潜在可切除;考虑患者一般情况尚可,无梗阻症状,仅少量便血,建议暂不手术,行转化治疗。
二、治疗过程
患者以肠镜标本行基因检测,提示K-ras基因为野生型,BRAF基因V600E野生型。2012年06月至2012年08月患者行FOLFIRI联合西妥昔单抗(爱必妥)方案治疗4周期(伊立替康180 mg/m2持续静脉滴注1 d;亚叶酸钙400 mg/m2持续静脉滴注1 d;氟尿嘧啶400 mg/m2静脉推注1 d,随后1200 mg/m2/d×2 d持续静脉滴注;爱必妥400 mg/m2静脉滴注1 d,250 mg/m2静脉滴注8 d;每2周重复)。治疗1周期后,患者便秘症状即显著改善。治疗4周期后患者于2012年08月接受评估,行上腹部及盆腔MRI检查提示:肠原发灶较前显著缩小,仍与左侧附件区分界不清;肝转移灶较前显著缩小(图2)。病情总体评估PR(RECIST评估标准,以下皆同)。MDT讨论后考虑患者病情较前显著好转,已获得根治性手术机会,建议患者行肠原发病灶、子宫附件及肝转移灶同期切除。但患者拒绝手术,并于2012年09月起暂停FOLFIRI联合爱必妥治疗,转入外院行中医治疗。
2013年01月患者出现腹痛腹胀,排便不畅,伴恶心,发热,体温最高为39.8℃。患者于我院急诊就诊,查体腹部膨隆,中下腹轻压痛,未及明显反跳痛,听诊肠鸣音稍亢进;查血常规白细胞为17.68×109/L,中性粒细胞占88.4%;查腹部立卧位平片未见明显气液平面。结合患者既往病史,诊断为肿瘤导致不完全肠梗阻。考虑患者症状尚能忍受,予禁食,胃肠减压,抗炎补液,对症支持治疗,后症状好转。2013年01月患者复查上腹部及盆腔MRI提示:原发灶及肝转移灶较2012年08月相比稍进展(图3),但MDT评估后认为患者仍然存在根治性手术机会,建议患者分期手术,先行原发灶切除,解除梗阻,再考虑后续肝转移灶治疗。
患者于2013年01月行剖腹探查、Dixon术联合全子宫双附件切除术。术中探查:腹腔内大量腹水;腹腔、大网膜等未见转移结节;肝脏右叶可及转移灶;直肠乙状结肠交界处可触及直径8 cm肿块,侵犯浆膜和周围组织,侵犯左侧卵巢,形成直径10 cm左右脓肿,周围有大网膜覆盖,吸出脓液800 ml。术后病理:(直肠)溃疡型腺癌,分化II-III级,累及肠壁全层及周围纤维脂肪组织,伴癌结节形成及部分区域大量中性粒细胞浸润,脓肿形成。两切缘阴性。检出淋巴结(4/33)。(全子宫及双侧附件)子宫及右侧附件未见特殊病变;左侧附件缺如,代之以癌性结节及脓肿形成,考虑为腺癌组织浸润破坏左侧附件。病理分期为pT4N2M1。
2013年02月07日患者继续应用FOLFIRI+爱必妥方案治疗2周期。至2013年03月10日再次MDT评估,行MRI检查提示:肝转移灶较2013年01月略增大,可疑腹膜后淋巴结转移及肾包膜累及(图4)。考虑患者当前肝转移灶仍有手术机会,建议患者行肝转移灶手术切除。
2013年3月14日行“肝右后叶切除术”。术中探查:盆腔脏器粘连,无法探查明确;肝门淋巴结无肿大,门静脉主干无癌栓;肿瘤位于肝右叶VI、VII段,直径约6.5 cm,向下紧邻右肾。术后病理:(肝右叶)腺癌,分化II-III级,伴坏死,结合病史,符合直肠腺癌肝转移。
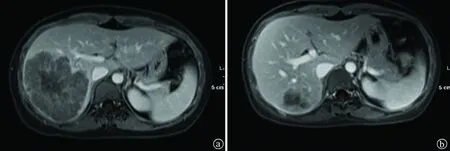
注:a图中可见患者第二肝门处占位;b图中可见患者肝右叶占位
患者术后接受MDT评估,已得到根治性手术,盆腔未见复发,肝脏无肿瘤残余;但考虑患者复发概率极高,需继续辅助化疗,并联合靶向治疗。患者肝转移术前化疗2周期后肿瘤略有增大,术后病理提示坏死范围较小,考虑原方案耐药,建议更改为mFOLFOX6方案。
2013年03月29日患者应用FOLFOX联合爱必妥治疗3周期(奥沙利铂85 mg/m2持续静脉滴注1 d;亚叶酸钙400 mg/m2持续静脉滴注1 d;氟尿嘧啶400 mg/m2静脉推注1 d,随后1200 mg/m2/d×2d持续静脉滴注;爱必妥400 mg/m2静脉滴注1 d,250 mg/m2静脉滴注8 d;每2周重复)。2013年05月13日评估疗效,上腹部MRI检查提示:肝内第二肝门及肝右前叶见多个结节状异常信号(6枚以上),直径1.4~2.3 cm,考虑为新发转移;腹膜后淋巴结转移(图5)。MDT建议患者行经导管肝动脉化疗栓塞术(TACE),并更换为3线治疗方案。患者未接受MDT治疗建议,自主离院,回当地行姑息性治疗。该患于2013年11月25日死亡,死因为严重黄疸,多脏器功能衰竭。
三、讨论
患者初诊即发现直肠乙状结肠交界处癌,累及左侧卵巢,伴同时性肝转移,无肝外转移。考虑到患者肝转移灶体积较大,当下不考虑切除。但ESMO结直肠癌诊疗指南(2012版)[1]指出,转移灶的潜在可切除性不受转移灶数量、大小和两叶分布等因素的影响;且患者PS评分0分,体力情况良好,并有积极治疗的意愿;因而该患者应归于ESMO分组中的1组,即潜在可切除组。对于这类患者,应当给予积极的转化治疗,包括化疗、靶向治疗、局部治疗等,在短期内最大限度地缩小肝转移灶,以期获得根治性切除的手术机会。Adam等[2]的研究也显示,在接受转化性化疗联合靶向治疗以后,约有67%的患者能够获得根治性手术的机会,且这种根治性手术的预后并不亚于初始可切除的肠癌肝转移患者。
对于以转化性治疗为目标的患者,在治疗方案的选择上,应当在机体能够耐受的范围内尽量选择高效的方案。在化疗方面,相比FOLFOX、FOLFIRI等两药联合方案,联合三个细胞毒性药物的FOLFOXIRI(5-Fu+CF+奥沙利铂+伊立替康)方案可以最大程度地提高治疗反应率,但会显著增加腹泻等不良反应的发生率,降低患者的耐受性;另外,FOLFOXIRI方案在提高远期PFS和OS方面的作用也并不显著[3]。在靶向治疗方面,该患者基因检测KRAS,BRAF均为野生型,抗EGFR和抗VEGF治疗均适用。然而近期的大宗临床试验显示,贝伐单抗在转化性治疗方面效果不佳,在治疗反应率方面没有显著获益[4-5]。因此对于KRAS基因野生型的患者,转化性治疗首选西妥昔单抗。但是在西妥昔单抗和化疗方案的搭配方面,目前的意见尚不一致:NCCN指南认为,FOLFOX方案联合西妥昔单抗的疗效存在疑问,不推荐作为一线治疗方案;ESMO指南却将FOLFOX联合西妥昔单抗作为转化治疗的最佳推荐方案之一(推荐等级+++)。为了追求最大疗效,也为了避免可能的矛盾,我们选择了另一种主流化疗方案FOLFIRI方案与西妥昔单抗联合应用。这一治疗计划也同时得到NCCN指南和ESMO指南的高度推荐。后续的治疗也显示,FOLFIRI联合西妥昔单抗在该患者的一线转化治疗中确实取得了良好的效果,为患者争取到了根治性手术的机会。
四、专家点评
该患者接受了4个周期的转化治疗后,肝转移灶和原发灶均显著缩小,影像学评估提示具备根治性手术的条件。从转化性治疗的角度上看,前期的诱导治疗无疑是成功的。然而该患者最终未能获得长期生存,我认为,主要原因在于没有把握住最佳的根治性手术时机。我们应当意识到,尽管一线转化性治疗可能取得良好的效果,单纯药物治疗目前无法治愈转移性结直肠癌。随着治疗周期的延长,化疗及靶向治疗的疗效必然会达到瓶颈,进而出现耐药,直至肿瘤进展。这是由肿瘤内部异质性和药物诱导突变所决定的[6-7]。
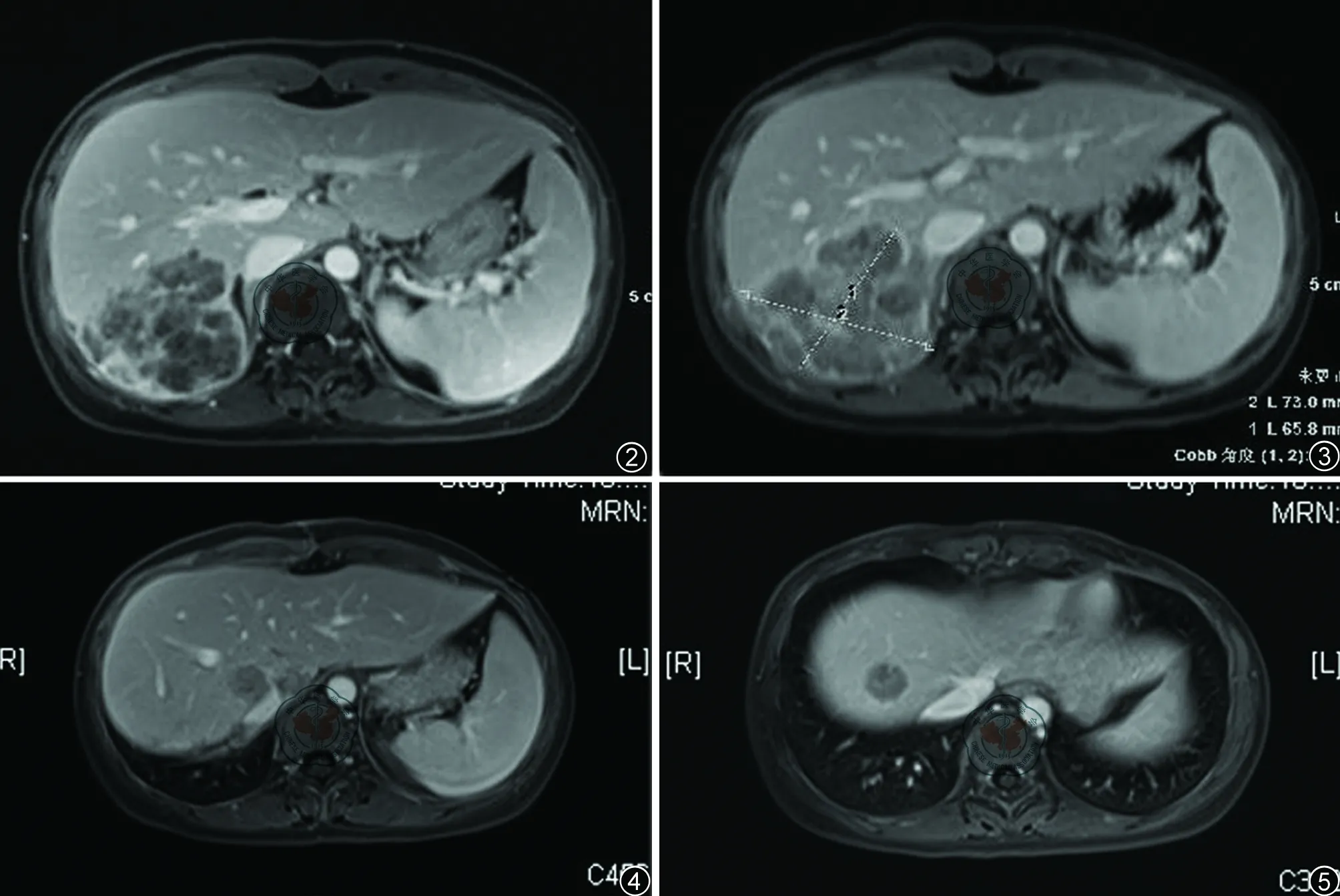
图2 直乙交界癌患者2012年8月肝脏MRI检查图像;图3 直乙交界癌患者2013年1月肝脏MRI检查图像;图4 直乙交界癌患者2013年3月肝脏MRI检查图像;图5 直乙交界癌患者2013年5月肝脏MRI检查图像
然而,在转化性治疗的过程中,转移灶缩小到何种程度最适合手术,目前尚无临床试验证据。肿瘤外科专家肝转移管理小组(expert group on oncosurgery management of liver metastases,EGOSLIM)讨论共识[8]认为,对于接受转化性治疗的患者,应当每2个月进行疗效评估,一旦发现具备手术条件,尽快进行手术。对于本患者,根据这一共识,我们在治疗开始2个月(4个周期)后开展了MDT会议进行疗效评估,发现患者病情显著缓解,具备手术条件。但患者考虑之前的治疗疗效显著,要求继续药物治疗,拒绝手术,并转入外院,从而失去了最佳根治性手术的机会。这与之后的肝转移灶复发可能存在着一定的联系。可见,及时、尽早手术对于延长患者生存是十分重要的。早期肿瘤退缩(early tumor shrinkage,ETS)这一新概念对于转化治疗效果的判断也有一定的帮助。目前ETS主要定义为治疗6至8周时肿瘤最大直径缩小超过20%。据此标准该患者一线治疗2个月(4个周期)后MDT评估即出现ETS。研究显示,出现ETS的患者,其最终治疗反应率、无病生存、总生存均显著优于无ETS的患者[9-10],提示ETS作为一项短期指标,可以用于预测转化治疗的效果,并判断手术时机。而对于出现ETS的患者,应当以治愈为目标进行最为积极的治疗。
多学科团队(multidisciplinary team,MDT)作为一种新型诊疗模式在结直肠癌肝转移的诊疗中起到了重要作用。Lordan等[11]研究显示,MDT可以显著提高结直肠癌肝转移患者的5年生存率,英国也已将MDT写入国家健康服务计划(The National Health Service,NHS)[12]。可见,MDT已得到了广泛的认同与应用。本病例中,患者从入院开始,全程接受中山医院结直肠癌肝转移MDT的诊疗,所有影像学资料及诊疗计划均经过MDT会议判断和讨论,是MDT规范化、个体化治疗的典范。然而对于本病例,MDT工作也存在着不足。在诊疗过程中,我院MDT注重了循证医学与个体化诊疗,却一定程度上放松了与患者的沟通和宣教,未能使患者充分了解转移性结直肠癌的诊疗关键。患者对于把握手术时机的必要性缺乏认识,因而一再拒绝手术,并一度放弃规范化治疗,导致了不良的预后。这也提示,在注重医疗技术的同时,MDT也应当充分重视对于患者和家属的人文关怀,积极与患者沟通,使患者了解治疗的意义与必要性,从而使患者积极配合治疗,改善患者的依从性。(点评专家:上海复旦大学附属中山医院 许剑民教授)
[1] Schmoll HJ,Van Cutsem E,Stein A,et al.ESMO Consensus Guidelines for management of patients with colon and rectal cancer.a personalized approach to clinical decision making.Ann Oncol,2012,23(10):2479-2516.
[2] Adam R,Aloia T,Levi F,et al.Hepatic resection after rescue cetuximab treatment for colorectal liver metastases previously refractory to conventional systemic therapy.J Clin Oncol,2007,25(29):4593-4602.
[3] Souglakos J,Androulakis N,Syrigos K,et al.FOLFOXIRI(folinic acid,5-fluorouracil,oxaliplatin and irinotecan)vs FOLFIRI(folinic acid,5-fluorouracil and irinotecan)as flrst-line treatment in metastatic colorectal cancer(MCC):a multicentre randomised phase III trial from the Hellenic Oncology Research Group(HORG).Br J Cancer,2006,94(6):798-805.
[4] Saltz LB,Clarke S,Diaz-Rubio E,et al.Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer:a randomized phase III study.J Clin Oncol,2008,26(12):2013-2019.
[5] Macedo LT,da Costa Lima AB,Sasse AD.Addition of bevacizumab to first-line chemotherapy in advanced colorectal cancer:a systematic review and meta-analysis,with emphasis on chemotherapy subgroups.BMC Cancer,2012,12(89).
[6] Gerlinger M1,Rowan AJ,Horswell S,et al.Intratumor heterogeneity and branched evolution revealed by multiregion sequencing.N Engl J Med,2012,366(10):883-892.
[7] Kreso A1,O’Brien CA,van Galen P,et al.Variable clonal repopulation dynamics influence chemotherapy response in colorectal cancer.Science,2013,339(6119):543-548.
[8] Adam R,De Gramont A,Figueras J,et al.The oncosurgery approach to managing liver metastases from colorectal cancer:a multidisciplinary international consensus.Oncologist,2012,17(10):1225-1239.
[9] Giessen C,Laubender RP,Fischer von Weikersthal L,et al.Early tumor shrinkage in metastatic colorectal cancer:retrospective analysis from an irinotecan-based randomized first-line trial.Cancer Sci,2013,104(6):718-724.
[10] Modest DP,Laubender RP,Stintzing S,et al.Early tumor shrinkage in patients with metastatic colorectal cancer receiving first-line treatment with cetuximab combined with either CAPIRI or CAPOX:an analysis of the German AIO KRK 0104 trial.Acta Oncol,2013,52(5):956-962.
[11] Lordan JT,Karanjia ND,Quiney N,et al.A 10-year study of outcome following hepatic resection for colorectal liver metastases-The effect of evaluation in a multidisciplinary team setting.Eur J Surg Oncol,2009,35(3):302-306.
[12] 叶颖江,王杉.多学科专家组诊疗模式的组织和规范实施.中国实用外科杂志,2011,31(1):22-24.

