结肠癌组织中SLP-2蛋白的表达及SLP-2基因对HCT-116细胞侵袭、迁移力的影响
张 剑,吴 敏,张自森,王利娟,张红巧,师广勇,巴 楠,闫 琳,郑晓珂,邢 鑫
郑州大学第五附属医院肿瘤科 郑州 450052
结肠癌组织中SLP-2蛋白的表达及SLP-2基因对HCT-116细胞侵袭、迁移力的影响
张 剑△,吴 敏,张自森,王利娟,张红巧,师广勇,巴 楠,闫 琳,郑晓珂,邢 鑫
郑州大学第五附属医院肿瘤科 郑州 450052
△女,1977年6月生,硕士,主治医师,研究方向:消化道肿瘤,E-mail:bluemoon630@163.com
结肠癌;SLP-2;siRNA;HCT-116细胞
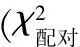
结肠癌是常见的消化系恶性肿瘤, 其在欧美国家发病率较高, 在发展中国家发病率较低, 但近30 a来, 随着生活水平及饮食习惯的改变, 我国结肠癌的发病率和病死率明显升高。SLP-2基因属于stomatin基因家族成员,是最近发现的一个新基因[1]。近年来的研究[2-6]显示,SLP-2在多种恶性肿瘤组织中过表达,可能是一个新的肿瘤相关基因。该研究采用免疫组化法检测SLP-2蛋白在人结肠癌组织中的表达情况,并通过小干扰RNA(small interfering RNA, siRNA)下调结肠癌细胞HCT-116中SLP-2的表达,检测转染后HCT-116细胞中SLP-2的表达情况及细胞侵袭、迁移力的变化,旨在探讨结肠癌组织中SLP-2的表达特点及SLP-2对结肠癌细胞的影响。
1 材料与方法
1.1结肠癌组织中SLP-2蛋白的表达
1.1.1 病例来源 结肠癌组织及距离癌组织边缘>5 cm的癌旁正常结肠组织为郑州大学第五附属医院2010年1月至2011年1月手术切除结肠癌标本,共50例患者,其中男27例,女23例;年龄40~72岁,中位年龄63岁,≤50岁21例,>50岁29例;肿瘤直径≤5 cm 32例,>5 cm 18例;高-中分化35例,低分化15例;有淋巴结转移34例,无淋巴结转移16例;TNM分期Ⅰ+Ⅱ期13例,Ⅲ+Ⅳ期37例。所有患者均经病理学检查确诊为结肠癌,术前未接受过放、化疗。
1.1.2 结肠癌组织中SLP-2蛋白表达的测定 鼠抗人SLP-2单克隆抗体稀释度为1:200,购自美国Proteintech公司。免疫组化试剂盒购自迈新公司。用已知阳性切片作为阳性对照,用PBS代替一抗作为阴性对照。操作步骤按试剂盒说明书进行。结果判定标准参照文献[7],由2位高年资病理科医师在双盲条件下进行评分,每张切片选取5个100倍视野进行观察,根据阳性细胞百分比及阳性细胞染色程度进行评分。细胞染色评分:无着色,0分;浅黄色,1分;黄色,2分;棕黄色,3分。阳性细胞百分比评分:无阳性细胞,0分;阳性细胞百分比<25%,1分;25%~,2分;50%~,3分;75%~,4分。2项评分相乘为总分,≥8分为高表达,<8分为阴性或低表达。
1.2SLP-2siRNA转染后HCT-116细胞中SLP-2mRNA及蛋白的表达
1.2.1 细胞培养 结肠癌细胞系HCT-116购自上海中国科学院典型培养物保藏委员会细胞库。用含青霉素、链霉素和体积分数10%胎牛血清的RPMI 1640培养液于37 ℃、体积分数5% CO2培养箱中培养,3~5 d传代1次。
1.2.2 siRNA转染 SLP-2 siRNA序列:上游5’-UGCUGCCUGAUUUAUCUGUUCAGCC-3’,下游5’-GGCUGAACAGAUAAAUCAGGCAGCA-3’,由上海吉玛公司设计合成。细胞按5×104孔-1接种于24孔板上。参考LipofectamineTM2000 说明书, 50 μL的RPMI 1640无血清培养液中加入20 pmol SLP-2 siRNA混匀,混匀Lipofectamin试剂,用50 μL无血清的RPMI 1640培养液稀释1 μL Lipofectamin试剂,混匀。将稀释好的SLP-2 siRNA和Lipofectamin试剂混合,轻柔混匀,室温放置20 min,以形成siRNA/Lipofectamin复合物。将以上混合液加到含有细胞和培养基的培养孔中,在体积分数5% CO2培养箱中37 ℃温育24 h后更换完全培养基继续培养。实验设阴性对照组和空白对照组。实验重复3次。
1.2.3 RT-PCR及Western blot检测 于转染后48 h收集细胞,进行RT-PCR及Western blot检测。①SLP-2扩增片段长度500 bp,上游引物5’-CTG GAGCCTGGTTTGAACAT-3’,下游引物5’-AGGATCT GGGCCTGTTTCTT-3’;内参β-actin扩增片段长度242 bp,上游引物5’-ACACTGTGCCCATCTACGACC-3’,下游引物5’-AGGGGCCGGACTCGTCATAGA-3’。引物均由上海生工生物工程技术服务有限公司合成。PCR反应体系:2×Taq PCR MasterMix 12.5 μL,SLP-2及内参上、下游引物(10 μmol/L)各 1 μL,cDNA 2 μL,ddH2O补至25 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸50 s,共30个循环;72 ℃延伸7 min。扩增产物经15 g/L琼脂糖凝胶电泳,凝胶成像仪扫描电泳图,以SLP-2与β-actin条带灰度值的比值表示SLP-2 mRNA的相对表达量。②抗β-actin单克隆抗体及二抗均购自美国Santa Cruz公司。提取HCT-116细胞总蛋白,经120 g/L SDS-PAGE电泳,稳流冰浴电转膜,分别与抗辣根过氧化物酶连接、孵育,DAB显色。采用Image分析软件分析条带的灰度值。以SLP-2与β-actin条带灰度值的比值表示SLP-2蛋白的相对表达量。
1.3SLP-2siRNA转染对HCT-116细胞迁移力的影响用胰蛋白酶消化转染48 h后的各组HCT-116细胞,计数后用无血清RPMI 1640培养液稀释,调整细胞密度为1×107mL-1。在24孔Transwell小室(美国Costar公司)内下层加入含体积分数10%胎牛血清的培养液500 μL,上室加入细胞悬液200 μL,置细胞培养箱培养36 h。弃去上室液体,用棉签拭去未穿过滤膜的细胞,经固定液固定,结晶紫染色。选择5个200倍视野,计数移至微孔膜下层的细胞数,取平均值表示细胞迁移能力。实验重复3次。
1.4SLP-2siRNA转染对HCT-116细胞侵袭力的影响在冰浴条件下取400 μL无血清培养液,加入50 μL Matrigel基质(美国BD公司),混匀后加入24孔Transwell小室的聚碳酯膜上各100 μL,Transwell小室置细胞培养箱中孵育30 min以上,使Matrigel基质成固态。细胞加入、固定、染色等步骤同1.3。选择5个200倍视野,计数移至微孔膜下层的细胞数,取平均值表示细胞侵袭力。实验重复3次。
1.5统计学处理采用SPSS 13.0进行统计分析。结肠癌及配对正常组织中SLP-2蛋白表达的比较采用配对χ2检验,结肠癌组织中SLP-2蛋白的表达与临床病理特征的关系采用χ2检验进行分析,转染SLP-2 siRNA后各组HCT-116细胞SLP-2 mRNA和蛋白的表达量以及细胞迁移、侵袭能力的比较采用单因素方差分析和LSD-t检验。检验水准α=0.05。
2 结果

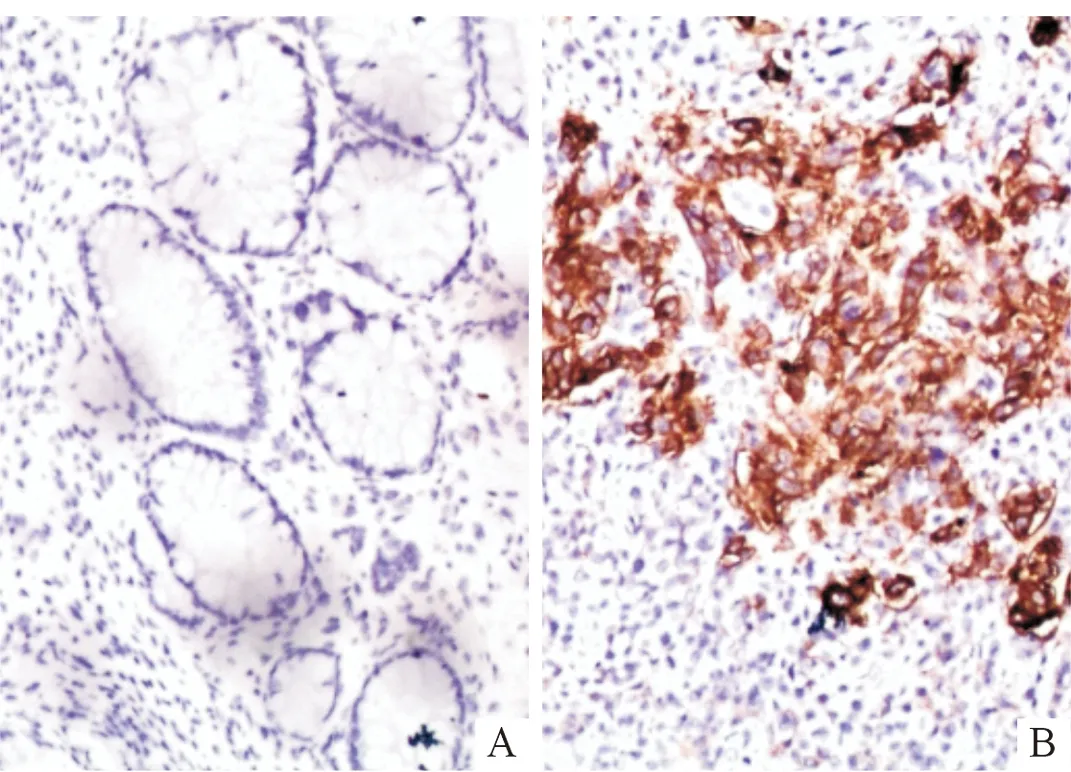
图1 正常结肠黏膜(A)及结肠癌(B)组织中SLP-2蛋白的表达(SP,×100)

表1 正常结肠黏膜及结肠癌组织中SLP-2蛋白的表达 例
2.2SLP-2蛋白表达与结肠癌临床病理特征的关系结果见表2。
2.3SLP-2siRNA转染后HCT-116细胞中SLP-2mRNA及蛋白的表达结果见图2、3和表3。
2.4转染SLP-2siRNA后HCT-116细胞迁移、侵袭力的变化结果见图4、表4。
表2SLP-2蛋白表达与结肠癌临床病理特征的关系例
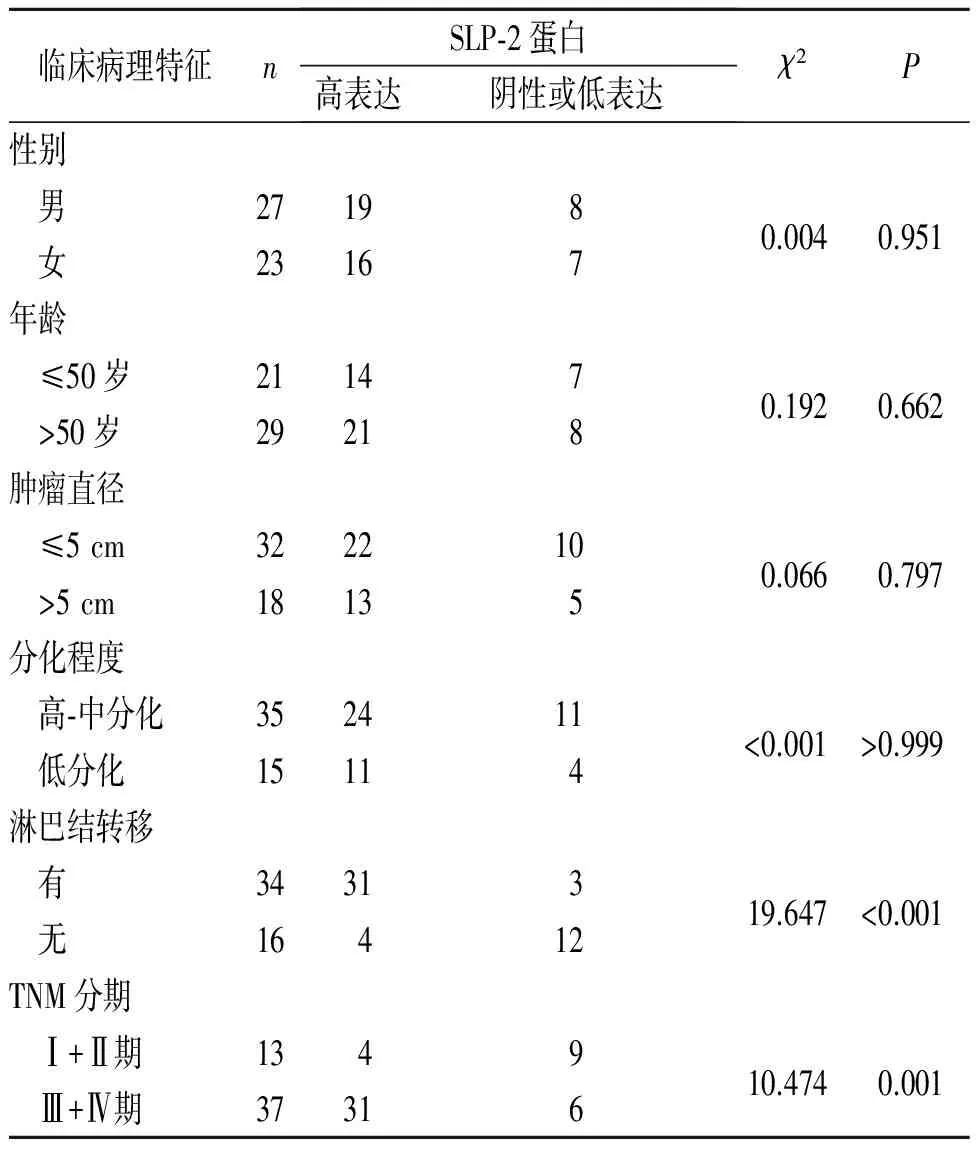
临床病理特征nSLP⁃2蛋白高表达阴性或低表达χ2P性别男271980.0040.951女23167年龄≤50岁211470.1920.662>50岁29218肿瘤直径≤5cm3222100.0660.797>5cm18135分化程度高⁃中分化352411<0.001>0.999低分化15114淋巴结转移有3431319.647<0.001无16412TNM分期Ⅰ+Ⅱ期134910.4740.001Ⅲ+Ⅳ期37316

图2 转染48 h后各组HCT-116细胞中SLP-2 mRNA的表达
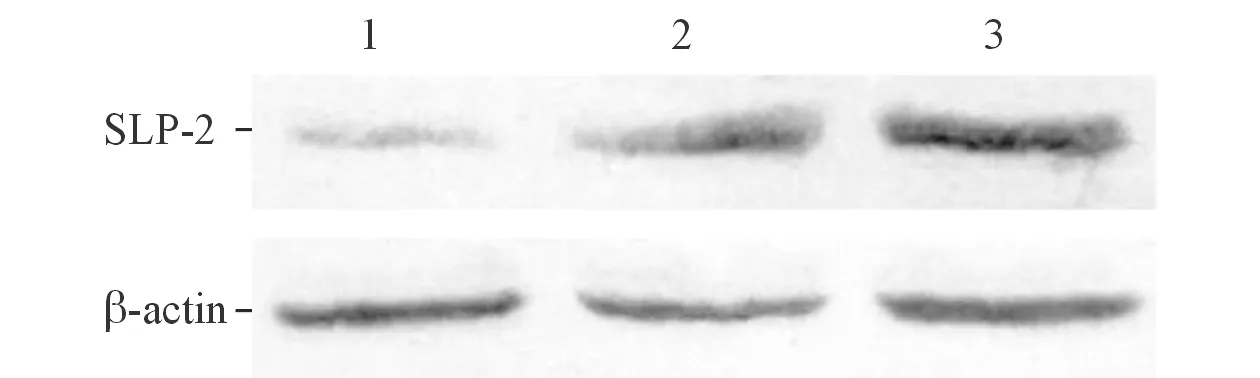
图3 转染48 h后各组HCT-116细胞中SLP-2蛋白的表达
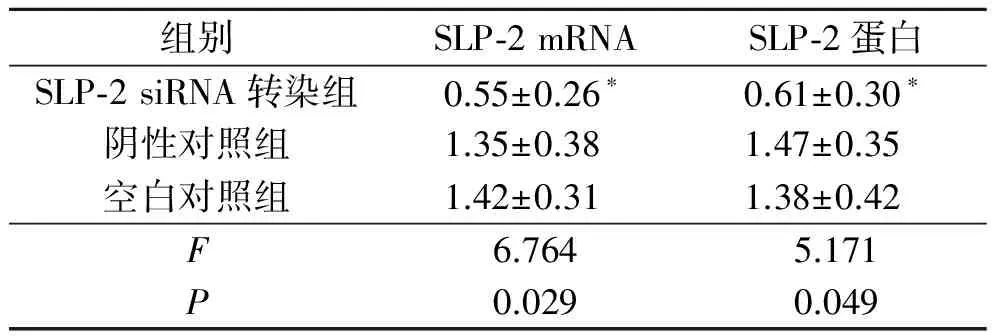
表3 转染48 h后各组HCT-116细胞中SLP-2 mRNA及蛋白的表达(n=3)
*:与其他2组比较,P均<0.05。

图4 SLP-2 siRNA对HCT-116细胞体外侵袭力的影响(结晶紫染色,×200)
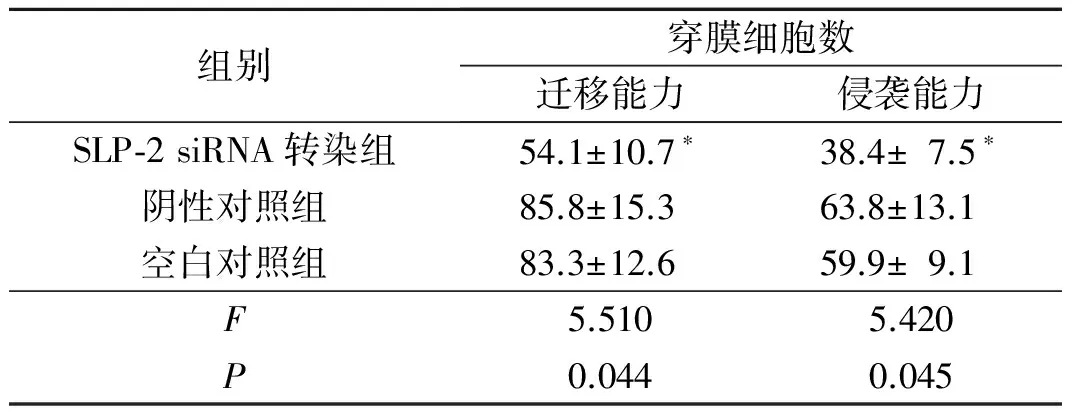
表4 3组SLP-2 siRNA对HCT-116细胞迁移能力和侵袭能力的影响(n=3)
*:与其他2组比较,P均<0.05。
3 讨论
SLP-2基因是2000年首次发现并命名的一个新基因,在多种恶性肿瘤组织中呈高表达,可能是一个新的恶性肿瘤相关基因。该研究发现,结肠癌组织中SLP-2呈高表达,而且其高表达与结肠癌TNM分期和淋巴结转移有关,提示SLP-2可能参与结肠癌的侵袭、转移。为进一步明确SLP-2对结肠癌侵袭、转移的影响,设计合成SLP-2 siRNA,将其转染结肠癌细胞HCT-116,结果显示转染SLP-2 siRNA后HCT-116细胞体外迁移和侵袭能力均较对照组减弱。由此推测,SLP-2基因可能促进结肠癌细胞的侵袭和转移。
综上,该研究发现SLP-2蛋白在结肠癌组织中表达升高,并发现SLP-2可能参与促进结肠癌细胞的侵袭和迁移。该结果对寻找新的判断结肠癌预后的指标及发现新的结肠癌治疗的分子靶点具有一定意义。
[1]Wang Y, Morrow JS. Identification and characterization of human SLP-2, a novel homo-logue of stomatin (band 7.2b) present in erythrocytes and other tissues[J]. J Biol Chem, 2000, 275(11):8062
[2]张剑,李建生,吴敏,等.SLP-2在胃癌组织中的表达及对胃腺癌细胞SGC7901运动侵袭的影响[J].中华消化杂志,2013,33(1):37
[3]Chang D,Ma K,Gong M,et al.SLP-2 overexpression is associated with tumour distant metastasis and poor prognosis in pulmonary squamous cell carcinoma[J].Biomarkers,2010,15(2):104
[4]Liu DN,Zhang L,Shen ZY,et al.Increased levels of SLP-2 correlate with poor prognosis in gastric cancer[J].Gastric Cancer,2013,16(4):498
[5]Cao WF,Zhang B,Li J,et al.SLP-2 overexpression could serve as a prognostic factor in node positive and HER2 negative breast cancer[J].Pathology,2011,43(7):713
[6]张剑,李建生,吴敏,等.胃腺癌组织中SLP-2的表达及其对SGC7901细胞增殖能力的影响[J].郑州大学学报:医学版,2013,48(1):73
[7]Wang YQ, Cao WF, Yu ZC, et al. Downregulation of a mitochondria associated protein SLP-2 inhibits tumor cell motility, proliferation and enhances cell sensitivity to chemo-therapeutic reagents[J]. Cancer Biol Ther, 2009, 8(17):1651
(2013-11-26收稿 责任编辑姜春霞)
Expression of SLP-2 protein in colorectal cancer tissue and its effects on migration and invasion of HCT-116 cells
ZHANGJian,WUMin,ZHANGZisen,WANGLijuan,ZHANGHongqiao,SHIGuangyong,BANan,YANLin,ZHENGXiaoke,XINGXin
DepartmentofOncology,theFifthAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
coloretal cancer; SLP-2; siRNA; HCT-116 cell
10.13705/j.issn.1671-6825.2014.04.019
R73-3

