先天性巨结肠肠壁组织中L1CAM的表达
曹振杰,杜俊鹏,杨婵婵,孙雪花,黄 华,谷雅川,陈 琦#
1)郑州大学第三附属医院小儿外科 郑州 450052 2)郑州市中心医院外科 郑州 450007
先天性巨结肠肠壁组织中L1CAM的表达
曹振杰1),杜俊鹏1),杨婵婵2),孙雪花1),黄 华1),谷雅川1),陈 琦1)#
1)郑州大学第三附属医院小儿外科 郑州 450052 2)郑州市中心医院外科 郑州 450007
#通讯作者,男,1963年4月生,硕士,主任医师,研究方向:小儿消化道畸形,E-mail:chen63qi@126.com
先天性巨结肠;L1CAM
目的:探讨先天性巨结肠(HD)肠壁组织中L1CAM的表达情况,从而分析L1CAM与HD的关系。方法利用免疫组化SP法和RT-PCR法检测48例HD患儿狭窄段和扩张段肠壁组织以及46例正常结肠肠壁组织中L1CAM蛋白和mRNA的表达。结果HD狭窄段肠壁组织中L1CAM蛋白表达量为(13.147 0±0.519 8),低于HD扩张段及正常结肠肠壁组织的(16.961 8±0.905 4)、(17.908 3±0.740 6)(t配对/t=27.697、25.346,P均<0.001)。HD狭窄段肠壁组织中L1CAM mRNA表达量为(4.316 4±0.387 0),低于HD扩张段及正常结肠肠壁组织的(5.717 8±0.486 0)、(6.344 3±0.236 6)(t配对/t=19.661、14.237,P均<0.001)。狭窄段肠壁组织中L1CAM蛋白和mRNA的表达呈正相关(r=0.968,P<0.001)。结论L1CAM蛋白和mRNA的异常低表达可能参与了HD的发生过程。
先天性巨结肠(Hirschsprung disease,HD)是儿科多发病之一,发病率居先天性消化道畸形第2位,占存活婴儿的1/5 000~1/2 000[1]。HD主要的病理变化是患儿在胚胎发育过程中神经嵴细胞迁移障碍,肠神经发育出现停顿,肠壁肌间神经丛的神经节细胞缺失,以致受累肠段异常收缩,其近端结肠代偿性扩张与肥厚而形成巨结肠。无神经节细胞肠段内肌间及黏膜下神经丛神经节细胞的缺失是由于胚胎早期发育停顿所致[2-3]。HD的病因尚不完全清楚,目前对于HD的研究主要集中在病因遗传学。国外近来相继报道[4-5]X染色体连锁脑积水患儿同时患有HD者占至少3%,并且发现这些患儿的L1CAM基因存在突变,因此推测L1CAM和HD的发病关系密切。该研究旨在探讨L1CAM蛋白在散发性HD肠壁组织中能否正常表达,并应用一步法RT-PCR方法半定量分析其mRNA的表达情况,从而探讨L1CAM与HD的关系。
1 对象与方法
1.1研究对象收集2004年11月至2005年3月郑州大学第三附属医院收治的经钡灌肠、直肠黏膜活检和术后病理检查证实为散发性的HD患儿48例,男29例,女19例,年龄14 d~13 岁。每例患儿均收集HD狭窄段(无神经节细胞段)和扩张段(有神经节细胞段)肠壁组织标本。收集同期在郑州大学第三附属医院行结肠套叠肠切除吻合术、剖腹探查肠造瘘术术中切除的正常结肠肠壁组织46例作为对照,患儿男27例,女19例,年龄14 d~12岁,均未发现合并HD,且均无HD家族史。
1.2主要试剂兔抗人L1CAM单克隆抗体、SP免疫组化试剂盒购自武汉博士德生物工程有限公司,DAB显色剂购自北京中杉金桥生物技术有限公司;总RNA提取试剂Trizol、RT-PCR相关试剂盒均购自大连宝生物公司,引物合成也由该公司完成。
1.3L1CAM蛋白的免疫组化检测所有肠壁组织经40 g/L中性多聚甲醛固定,石蜡包埋组织3 μm厚连续切片,脱蜡水化;体积分数为3% H2O2室温5~10 min以灭活内源性过氧化物酶;95 ℃加热10 min修复抗原;滴加体积分数为0.5%正常羊血清室温下封闭30 min;弃去羊血清,滴加一抗,4 ℃过夜,PBS洗涤3次,再加二抗,37 ℃ 40 min,PBS洗涤2次后滴加辣根酶标记链霉卵白素(1:200),37 ℃ 40 min;自来水中止反应,DAB显色,苏木素轻度复染,常规脱水后封片。以试剂盒提供的已知阳性切片作为阳性对照,以PBS代替一抗作为阴性对照。L1CAM蛋白阳性染色为细胞质出现棕黄色颗粒。采用日本JVC-F30B 3-CCD彩色摄像仪录入L1CAM免疫组化染色结果,并以此进行真彩色图像分析处理,采用德国Kontron Elektronik公司KONTRON IBAS 2.5全自动图像分析系统测定免疫组化图片灰度值,取5个200倍视野下灰度值的平均值作为该标本的测定值。
1.4L1CAMmRNA表达的RT-PCR检测所取标本置于经DEPC水处理过的冻存管中,置于-80 ℃冰箱中备用。用Trizol试剂盒一步法提取肠壁组织总RNA,并用紫外分光光度计测总RNA浓度。 L1CAM上游引物为5’-GGGAAAGATGGTCGTG GCGCTC-3’,下游引物为5’-TGTAGTCTGAGTGGTT GTCGGAGGTGA-3’,产物大小608 bp;内参β-actin上游引物为5’-GTGGGCATGGGTCAGAAG-3’,下游引物为5’-GAGGCGTACAGGGATAGCA-3’,产物大小302 bp。取总RNA 20 μL,按操作说明书逆转录,取逆转录产物2 μL,加入20.5 μL反应体系。反应条件为:94 ℃ 2 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 40 s,35个循环。取扩增产物5 μL加样,75 g/L聚丙稀酰胺凝胶电泳,拍照,计算机扫描,由于目的基因表达较弱,故计算(L1CAM灰度值×10)/β-actin灰度值比值,即为目的基因的相对表达量。
2 结果
2.1L1CAM蛋白在不同肠壁组织中的表达见图1、表1。
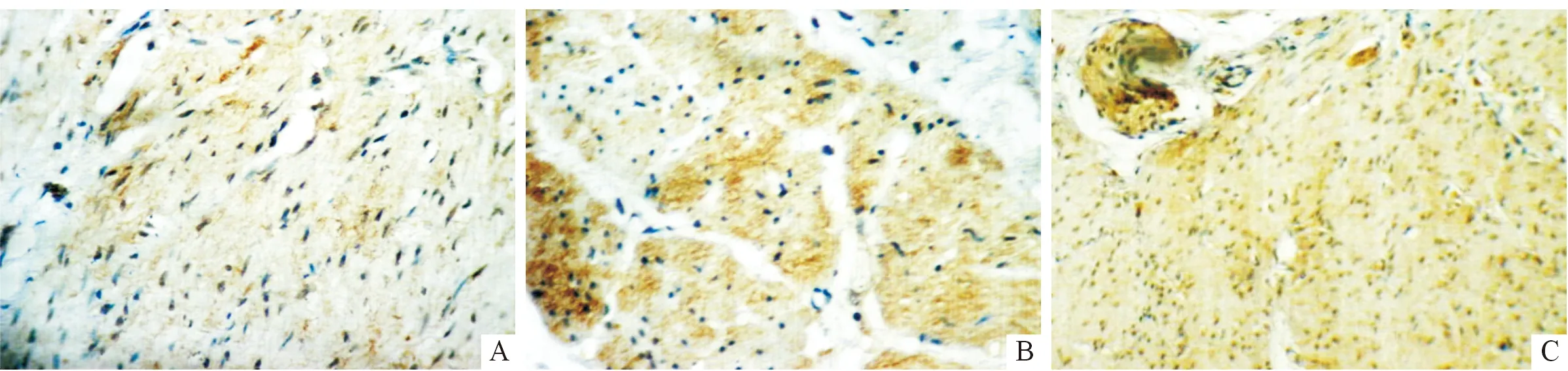
图1 L1CAM蛋白在HD狭窄段(A)、扩张段(B)以及正常结肠(C)肠壁组织中的表达(SP,×200)
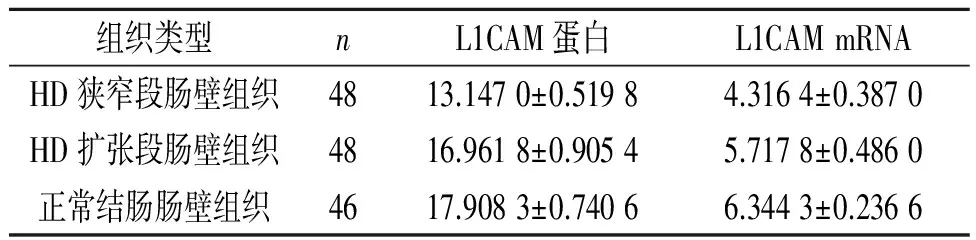
表1 L1CAM蛋白和mRNA在不同肠壁组织中的表达
L1CAM蛋白:HD狭窄段肠壁组织与HD扩张段肠壁组织比较,t配对=27.697,P<0.001;HD狭窄段肠壁组织与正常结肠肠壁组织比较,t=25.346,P<0.001;HD扩张段肠壁组织与正常结肠肠壁组织比较,t=0.894,P=0.374。L1CAM mRNA:HD狭窄段肠壁组织与HD扩张段肠壁组织比较,t配对=19.661,P<0.001;HD狭窄段肠壁组织与正常结肠肠壁组织比较,t=14.237,P<0.001;HD扩张段肠壁组织与正常结肠肠壁组织比较,t=0.640,P=0.524。
2.2L1CAMmRNA在不同肠壁组织中的表达见图2、表1。
2.3HD狭窄段肠壁组织中L1CAM蛋白和mRNA表达的相关性HD狭窄段肠壁组织中L1CAM蛋白与mRNA的表达呈正相关(r=0.968,P<0.001)。

图2 L1CAM mRNA在不同肠壁组织中的表达
M:Marker;k1~k3:扩张段肠壁组织;x1~x3:狭窄段肠壁组织;Z:正常结肠肠壁组织。
3 讨论
HD是一种以肠道末端神经节细胞完全缺如为特征的常见消化道发育畸形,发病率极高,男女比例为4:1,大多数为散发性。HD发病过程中导致神经节细胞缺如的原因说法不一。在胚胎形成过程中,黏膜下层的神经节细胞是由肌间的神经母细胞移行过去的,在此过程中任何原因造成神经发育停顿,则使停顿的远端肠段缺乏神经节细胞,即可致HD[6-8]。L1CAM是CAM家族重要成员,人类L1CAM基因定位于Xq28处,长4 860 bp,其编码的蛋白与神经元的黏附、识别及迁移关系密切。近年来的研究[9-10]表明,L1CAM在肠道正常神经发育及功能发挥中通过以下途径起作用:L1CAM通过参与神经细胞生长的信号转导途径影响神经节细胞的头尾向迁移、分化;与RET基因相互作用,维持正常神经系统功能的发挥;通过与神经生长因子信号通路相互作用,调节神经生长发育。这提示一旦L1CAM mRNA或蛋白发生异常,极可能引起肠道神经发育异常,造成HD。
该组患儿临床资料显示,男性发病率高于女性,这可能与L1CAM位于Xq28,而X染色体在男女体内不对称分布有关。该研究结果还显示:L1CAM mRNA和蛋白在正常结肠肠壁组织中表达稳定、均一,在HD扩张段肠壁组织中L1CAM mRNA和蛋白的表达也未见明显增加,而HD狭窄段肠壁组织中L1CAM mRNA和蛋白表达明显下降,低于HD扩张段和正常结肠肠壁组织。这种HD狭窄段L1CAM mRNA和蛋白表达下降而HD扩张段表达正常的现象可能与机体自身存在的因子表达反馈过度有关。作者还发现,L1CAM蛋白和mRNA在HD狭窄段肠壁组织中的表达有关。综上所述,作者认为,HD的发生可能与L1CAM的低表达有关,而且L1CAM蛋白的低表达可能是其mRNA的异常低表达有关。
[1]陈卫坚,刘筱娴.先天性巨结肠发病影响因素研究进展[J].中国社会医学杂志,2008,25(5):311
[2]Moore SW.The contribution of associated congenital anomalies in understanding Hirschsprung's disease[J].Pediatr Surg Int,2006,22(4):305
[3]Moore SW,Zaahl MG.Tissue specific somatic mutations and aganglionosis in Hirschsprung's disease[J].J Pediatr Surg,2014,49(2):258
[4]Heiz M,Grünberg J,Schubiger PA,et al.Hepatocyte growth factor-induced ectodomain shedding of cell adhesion molecule L1: role of the L1 cytoplasmic domain[J].J Biol Chem,2004,279(30):31149
[5]Fernández RM,Núez-Torres R,García-Díaz L,et al.Association of X-linked hydrocephalus and Hirschsprung disease: report of a new patient with a mutation in the L1CAM gene[J].Am J Med Genet A,2012,158A(4):816
[6]陈琦,王志,曹振杰,等.先天性巨结肠患儿结肠肌间神经丛内神经节细胞中NKX2-1的表达[J].郑州大学学报:医学版,2012,47(3):365
[7]杨合英,刘秋亮,王家祥,等.多发性节段型肠无神经节细胞症的临床分析[J].中华医学杂志,2005,85(39):2772
[8]Boman F,Corsois L,Paraf F.Hirschsprung's disease: practical considerations[J].Ann Pathol,2004,24(6):486
[9]彭梓月,韩毅敏,王晶.L1-CAM在肿瘤组织中的研究进展[J].现代肿瘤医学,2013,21(3):665
[10]Anderson RB,Turner KN,Nikonenko AG,et al.The cell adhesion molecule 11 is required for chain migration of neural crest cells in the developing mouse gut[J].Gastroenterology,2006,130(4):1221
(2013-07-28收稿 责任编辑姜春霞)
Expression of L1CAM in intestinal wall tissues of Hirschsprung disease
CAOZhenjie1),DUJunpeng1),YANGChanchan2),SUNXuehua1),HUANGHua1),GUYachuan1),CHENQi1)
1)DepartmentofPediatrics,theThirdAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
2)DepartmentofSurgery,theCentralHospitalofZhengzhou,Zhengzhou450007
Hirschsprung disease; L1CAM
Aim: To investigate the expression of L1CAM in intestinal wall tissues of Hirschsprung disease(HD), and to analyze the relationship between L1CAM and HD. Methods: SP method and RT-PCR were used to detected the protein and mRNA expression of L1CAM in the stenotic and ectatic intestinal wall tissues of 48 patients with HD and 46 cases of normal colon intestinal wall tissues. Results: The protein expression of L1CAM in the stenotic intestinal wall tissues of HD was (13.147 0±0.519 8),which was lower than those of the ectatic intestinal wall tissues of HD (16.961 8±0.905 4) and the normal colon intestinal wall tissues (17.908 3±0.740 6) (tpaired/t=27.697, 25.346,P<0.001). The mRNA expression of L1CAM in the stenotic intestinal wall tissues of HD was (4.316 4±0.387 0),which was lower than those of the ectatic intestinal wall tissues of HD (5.717 8±0.486 0) and the normal colon intestinal wall tissues (6.344 3±0.236 6) (tpaired/t=19.661, 14.237,P<0.001). The protein and mRNA expression of L1CAM in the stenotic intestinal wall tissues of HD had the positive relationship(r=0.968,P<0.001). Conclusion: Abnormal low expression of L1CAM mRNA and protein in the stenotic intestinal wall tissues may be involved in the pathogenesis of HD.
10.13705/j.issn.1671-6825.2014.04.032
R726.5

