重庆地区非小细胞肺癌表皮生长因子受体突变检测与临床病理特征分析
王晓慧 陈 虹
肺癌已跃居我国城乡恶性肿瘤病死率的首位。因为多数患者在初次诊断时已处于晚期,且晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)对放化疗敏感性不高,故5年生存率低,预后差。表皮生长因子受体(epidermal growth factor receptor,EGFR)及表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EGFR-TKI)如厄洛替尼、吉非替尼的研究的不断深入和临床使用,让晚期NSCLC的治疗见到了曙光。而EGFR基因突变的患者对EGFR-TKI更敏感[1-3]。因此,EGFR突变检测成为肺癌靶向治疗的预测手段[4-5]。研究表明,EGFR基因的突变种类及突变率具有地区和种族差异。中国NSCLC患者EGFR突变率大于美国NSCLC患者[6]。在中国各省市的NSCLC患者EGFR突变的具体表现也不完全一致,安徽省以外显子19突变为主。台湾地区则以外显子21突变为主,而上海的资料显示两者之间无差异[7-9]。外显子19、21的突变特征也存在矛盾。Li等[10]对中国大陆的NSCLC患者EGFR突变研究显示,在女性、有淋巴结转移或Ⅲ-Ⅳ期NSCLC患者以外显子21突变为主,外显子19突变更常见于Ⅰ和Ⅱ期。而李梅芳等[11]研究发现外显子19、21突变与患者年龄、性别、肿瘤TNM分期、吸烟状态、标本来源、组织学类型均无明显相关性。为进一步探讨EGFR基因突变的差异,本研究用扩增阻滞突变系统(amplification refractory mutation system,ARMS)检测重庆地区EGFR突变。了解重庆地区NSCLC患者EGFR基因突变情况及其与临床病理特征的关系。
材料与方法
一、 临床资料
回顾性分析2011年9月至2013年1月经病理或细胞学检查确诊为NSCLC,并在重庆医科大学分子检测中心行EGFR基因突变检测的病例55例。其中,男32例,女23例。大于60岁29例,小于等于60岁26例。吸烟27例,不吸烟28例。非鳞癌42例(腺癌40例,腺鳞癌2例),鳞癌13例。甲醛固定石蜡标本40例,胸水标本15例。依据国际防癌联盟2009版对所有NSCLC患者进行临床分期。Ⅰ期6例,Ⅱ期5例,Ⅲ期16例,Ⅳ期28例。依据1997年WHO吸烟定义:一生中吸烟连续或累积吸烟6个月或以上者,反之为非吸烟者。
二、 DNA提取及检测方法
1. 石蜡组织标本DNA提取:经病理确认为肿瘤组织的石蜡标本,脱蜡后利用凯杰公司QIAamp FFPE组织DNA提取试剂盒(Cat NO.56404)提取DNA。所有步骤按石蜡样品DNA 提取试剂盒操作说明操作。所提DNA需用紫外分光光度计测定浓度,其OD260/OD280在1.8~2.0内。提取完的DNA立即进行EGFR检测。
2. 胸水标本DNA提取: 收集经镜下脱落细胞检测确定含肺癌细胞的新鲜胸水标本。以离心半径 8 cm,2000 r/min常温下离心15 min,去上清液,收集沉淀物。采用凯杰公司QIAamp组织DNA提取试剂盒(Cat NO.69506)提取DNA,所有步骤按组织标本提取试剂盒操作说明进行。所提取的DNA需用紫外分光光度计测定浓度,其OD260/OD280在1.8~2.0内。提取完的DNA立即进行EGFR检测。
3. ARMS法检测EGFR:所有提取DNA均采用ADx-ARMS人类EGFR基因29种突变检测试剂盒(厦门艾德生物医药科技有限公司),检测EGFR基因外显子18、19、20、21共29种权威机构提供的已知常见突变。所有步骤及结果解读均按ADx-ARMS 试剂盒操作说明书进行操作。
三、 统计学分析
采用SAS统计学分析软件处理检测数据,组间率的比较行χ2检验,P<0.05为差异有统计学意义;外显子19、21突变特征分析采用Fisher精确检验法(总例数小于40),P<0.05为差异有统计学意义。
结 果
一、 EGFR突变位点分析
在55例NSCLC患者中,检测出EGFR突变14例(25.45%),其中外显子19突变8例(57.14%,8/14),外显子21突变5例(35.71%,5/14),外显子18、20同时突变1例(7.15%,1/14),见表1。
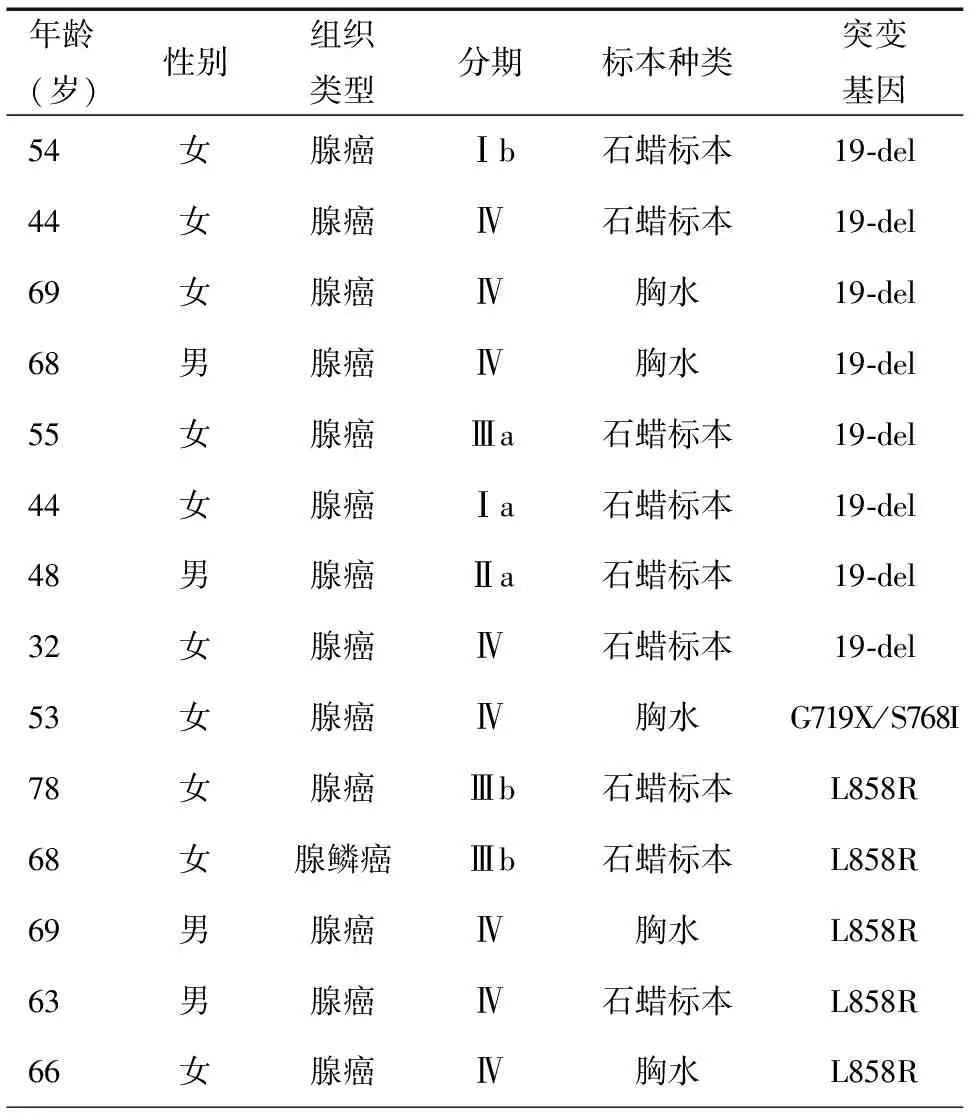
表1 14例NSCLC患者EGFR体细胞突变位点
二、EGFR突变与临床特征的关系分析
非鳞癌(腺癌、腺鳞癌)EGFR突变率为33.33%(14/42),13例鳞癌无突变(0/13)。女性NSCLC患者EGFR基因突变率显著大于男性患者(P=0.009)。不吸烟NSCLC患者EGFR突变率大于吸烟患者(P=0.017)。非鳞癌(腺癌、腺鳞癌)突变大于鳞癌患者(P=0.041),差异均有统计学意义。对于年龄、TNM分期、标本种类、病理类型分组EGFR基因突变率差异无统计学意义,见表2。
三、 EGFR基因外显子19、21突变特征分析
外显子19、21突变与年龄相关。60岁以下以外显子19突变为主,60岁以上的则以外显子21多见。外显子19、21突变与性别、吸烟状态、TNM分期、病理类型、标本种类无明显相关,见表3。
讨 论
EGFR基因突变的晚期NSCLC患者用EGFR-TKI比使用化疗具有更长的无进展生存期[12]。Heon等[13]也研究证实,EGFR基因突变的晚期NSCLC患者,用易瑞沙治疗组较化疗组相比,具有更低的中枢神经系统转移的风险。EGFR基因敏感突变的晚期NSCLC患者使用EGFR-TKI比化疗具有更好的临床获益。

表2 NSCLC患者EGFR基因突变与临床病理特征的关系[n(%)]
EGFR基因突变具有种族及地区差异。Sekine等[14]研究发现,在亚洲NSCLC患者EGFR总的突变率为31%,远高于欧美患者的7%。本研究中,NSCLC总的突变率25.45%,较亚洲多中心调查的平均突变率稍低,但仍较欧美国家突变率高。Xu等[15]针对中国大陆NSCLC患者的研究提示,总突变率30.2%,女性患者突变率30.2%。本研究中,女性患者EGFR基因突变率为43.48%,处于较高水平。
多项研究提示,NSCLC患者EGFR突变与临床特征相关。台湾地区大样本、多中心研究提示女性、腺癌、非吸烟患者使用厄洛替尼治疗,具有更长的无进展生存期[16]。Kim等[17]对202例肺癌患者研究发现,女性(52.1vs. 13.0%)、非吸烟(47.8vs. 15.8%)、腺癌(35.2vs. 5.2%)患者具有更高的EGFR突变率。这一结论也多次得到其它研究证实[1,18]。本研究亦同样提示女性(43.48vs. 12.5%)、非吸烟(39.29vs. 11.11%)、非鳞癌(腺癌、腺鳞癌)(33.33vs. 0.00%)患者的EGFR突变率更高,与前面研究结果相一致。Shiozawa等[19]对67例腺鳞癌患者研究证实,腺鳞癌EGFR基因突变与腺癌具有相似的临床病理特征,故推测腺鳞癌中EGFR突变来自腺癌成分可能性大。该实验进一步说明EGFR基因突变与病理类型相关。也有研究提出不同观点,Kim等[20]检测57例晚期腺癌、鳞癌患者血清中EGFR基因突变,两者突变差异无统计学意义。其发生机制及结果准确性需进一步大样本研究证明。另外,本研究发现胸水标本与石蜡组织标本EGFR突变差异无统计学意义。魏冰等[21]采用直接测序法检测109例合并胸腔积液的肺腺癌患者的胸腔积液和组织标本外显子19、21突变,发现两者突变率分别为56.88%、53.21%(P=0.35),与本研究结果相符。何臣等[22]用同样方法检测30例NSCLC患者的恶性胸腔积液EGFR突变率为35%。这些研究均提示恶性胸腔积液中EGFR突变仍有较高的检出率,对于难以获取组织标本的晚期NSCLC患者可以通过恶性胸腔积液进行EGFR检测,从而预测EGFR-TKI的疗效。
研究表明,外显子19、21的突变也具有一定的临床病理特征。目前发现EGFR突变位以外显子19、21突变为主,与本研究结果相符[23]。Li等[10]对中国大陆的NSCLC患者EGFR突变研究显示,在女性、有淋巴结转移或Ⅲ-Ⅳ期患者以外显子21突变为主,而外显子19突变更常见于I和II期NSCLC患者,提示外显子19突变比外显子21突变具有较低的恶性倾向。另外,外显子19突变更常见于左肺肺癌,外显子21突变更常见于右肺肺癌。也有研究呈现相反的观点,李梅芳等[11]研究发现外显子19、21突变与患者年龄、性别、肺癌TNM分期、吸烟状态、标本来源、组织学类型均无明显相关性。本研究首次发现60岁以下以外显子19突变为主,60岁以上以外显子21突变为主。考虑这些差异与病例遗传背景、检测方法、样本量、EGFR突变机制等多因素相关,仍需进一步大样本研究探索EGFR外显子19、21突变与年龄相关的机制及临床意义。研究发现,不同的外显子突变具有不同的临床意义。Fukuoka等[24]研究发现,外显子19、21突变对化疗的有效率为43.2%、53.2%,对易瑞沙治疗的有效率为84.8%、60.9%。Jackman等[25]也研究证实,外显子19突变比外显子21突变的患者用厄洛替尼或吉非替尼治疗具有更好的无进展生存期和总生存期获益。故外显子19比外显子21在疗效上更具优势。多项研究表明,外显子20的T790M突变与EGFR-TKI的获得性耐药有关[26-27]。本研究发现外显子18、20同时突变1例,其突变的临床意义仍需要进一步研究。
EGFR-TKI已成为晚期NSCLC的主要治疗方式。目前关于EGFR基因突变的状态、与临床病理特征的关系及其临床意义的报道结果存在相互矛盾的地方,这可能与各地患者的遗传背景、生活环境及肺癌的EGFR突变的发生机制相关。为进一步优化EGFR-TKI治疗方案,延长NSCLC 患者的PFS 和OS,改善生活质量,获得更高的社会经济学价值,仍需进一步深入研究EGFR基因的突变。
参 考 文 献
1 Sholl L M,Xiao Y,Joshi V,et al. EGFR mutation is a better predictor of response to tyrosine kinase inhibitors in non-small cell lung carcinoma than FISH,CISH,and immunohistochemistry[J]. Am J Clin Pathol,2010,133(6): 922-934.
2 Dahabreh IJ,Linardou H,Siannis F,et al. Somatic EGFR mutation and gene copy gain as predictive biomarkers for response to tyrosine kinase inhibitors in non-small cell lung cancer [J]. Clin Cancer Res,2010,16(1): 291-303.
3 谢 强,陈 群,孙卫红,等. 内科胸腔镜非小细胞肺癌活检标本的表皮生长因子受体基因检测[J/CD]. 中华肺部疾病杂志:电子版,2013,6(4):338-340.
4 Penzel R,Sers C,Chen Y,et al. EGFR mutation detection in NSCLC-assessment of diagnostic application and recommendations of the German Panel for Mutation Testing in NSCLC[J]. Virchows Arch,2011,458(1): 95-98.
5 王 沣,操乐杰. 晚期非小细胞肺癌患者体液标本EGFR检测进展[J/CD]. 中华肺部疾病杂志:电子版,2012,5(4):380-384.
6 Mu XL,Li LY,Zhang XT,et al. Gefitinib-sensitive mutations of the epidermal growth factor receptor tyrosine kinase domain in chinese patients with non-small cell lung cancer[J]. Clin Cancer Res,2005,11(12): 4289-4294.
7 王继灵,操乐杰,伍 权,等. 安徽省非小细胞肺癌表皮生长因子受体基因的突变[J]. 中国老年学杂志,2012,32(9): 1822-1824.
8 Huang SF,Liu HP,Li LH,et al. High frequency of epidermal growth factor receptor mutations with complex patterns in non-small cell lung cancers related to gefitinib responsiveness in Taiwan[J]. Clin Cancer Res,2004,10(24): 8195-8203.
9 Qin BM,Chen X,Zhu JD,et al. Identification of EGFR kinase domain mutations among lung cancer patients in China: implication for targeted cancer therapy [J]. Cell Res,2005,15(3): 212-217.
10 Li M,Zhang Q,Liu L,et al. The different clinical significance of EGFR mutations in exon 19 and 21 in non-small cell lung cancer patients of China [J]. Neoplasma,2011,58(1): 74-81.
11 李梅芳,欧阳学农,余宗阳. 非小细胞肺癌EGFR突变及临床病理特征分析[J]. 中国肿瘤,2012,21(7): 539-542.
12 Paz-Ares L,Soulières D,Melezínek I,et al. Clinical outcomes in non-small-cell lung cancer patients with EGFR mutations: pooled analysis [J]. J Cell Mol Med,2010,14(1-2): 51-69.
13 Heon S,Yeap BY,Lindeman NI,et al. The impact of initial gefitinib or erlotinib versus chemotherapy on central nervous system progression in advanced non-small cell lung cancer with EGFR mutations [J]. Clin Cancer Res,2012,18(16): 4406-4414.
14 Sekine I,Yamamoto N,Nishio K,et al. Emerging ethnic differences in lung cancer therapy[J]. Br J Cancer,2008,99(11): 1757-1762.
15 Xu JM,Han Y,Duan HQ,et al. EGFR mutations and HER2/3 protein expression and clinical outcome in Chinese advanced non-small cell lung cancer patients treated with gefitinib [J]. J Cancer Res Clin Oncol,2009,135(6): 771-782.
16 Perng RP,Yang CH,Chen YM,et al. High efficacy of erlotinib in Taiwanese NSCLC patients in an expanded access program study previously treated with chemotherapy[J]. Lung Cancer,2008,62(1): 78-84.
17 Kim HJ,Oh SY,Kim WS,et al. Clinical investigation of EGFR mutation detection by pyrosequencing in lung cancer patients [J]. Oncol Lett,2013,5(1): 271-276.
18 Li Y,Li Y,Yang T,et al. Clinical Significance of EML4-ALK Fusion Gene and Association with EGFR and KRAS Gene Mutations in 208 Chinese Patients with non-small cell lung cancer [J]. PLoS One,2013,8(1): e52093.
19 Shiozawa T,Ishii G,Goto K,et al. Clinicopathological characteristics of EGFR mutated adenosquamous carcinoma of the lung[J]. Pathol Int,2013,63(2): 77-84.
20 Kim ST,Sung JS,Jo UH,et al. Can mutations of EGFR and KRAS in serum be predictive and prognostic markers in patients with advanced non-small cell lung cancer (NSCLC)?[J]. Med Oncol,2013,30(1): 328.
21 魏 冰,马 杰,马智勇,等. 肺腺癌患者恶性胸腔积液中EGFR突变状况分析[J]. 临床与实验病理学杂志,2012,28(3): 323-326.
22 何 臣,刘 明,徐 军. 应用酶切富集PCR法检测非小细胞肺癌患者胸腔积液表皮生长因子受体基因突变[J]. 中国呼吸与危重监护杂志,2009,8(5): 446-450.
23 Sahoo R,Harini VV,Babu VC,et al. Screening for EGFR mutations in lung cancer,a report from India [J]. Lung Cancer,2011,73(3): 316-319.
24 Fukuoka M,Wu YL,Thongprasert S,et al. Biomarker analyses and final overall survival results from a phase Ⅲ,randomized,open-label,first-line study of gefitinib versus carboplatin/paclitaxel in clinically selected patients with advanced non-small-cell lung cancer in Asia (IPASS)[J]. J Clin Oncol,2011,29(21): 2866-2874.
25 Jackman DM,Miller VA,Cioffredi LA,et al. Impact of epidermal growth factor receptor and KRAS mutations on clinical outcomes in previously untreated non-small cell lung cancer patients: results of an online tumor registry of clinical trials[J]. Clin Cancer Res,2009,15(16): 5267-5273.
26 Taus A,Vollmer I,Arriola E. Activating and resistance mutations of the epidermal growth factor receptor (EGFR) gene and non-small cell lung cancer: a clinical reality [J]. Arch Bronconeumol,2011,47(2): 103-105.
27 Arcila ME,Oxnard GR,Nafa K,et al. Rebiopsy of lung cancer patients with acquired resistance to EGFR inhibitors and enhanced detection of the T790M mutation using a locked nucleic acid-based assay[J]. Clin Cancer Res,2011,17(5): 1169-1180.

