外周血单核细胞数量与肺癌放疗近、远期疗效的相关性分析
徐燕梅 崔天祥 张晓晶 李德志 孙建国
肺癌是全球肿瘤致死最主要的原因,其病理类型分为非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer,SCLC)[1]。经统计,约57%~65%的肺癌患者在整个治疗期间会接受放射治疗,尤其是局部晚期NSCLC患者,同步放化疗是NCCN指南规范的标准治疗方案[2-3]。尽管三维适形放疗(three dimensional conformal radiation therapy,3D-CRT)、调强放疗(intensity modulated radiation therapy,IMRT)、图像引导放疗(image guided radiation therapy,IGRT)、立体定向放射治疗(stereotactic body radiation therapy,SBRT)等先进技术的广泛应用,但肺癌放疗后2年内局部复发率仍高达37%~40%[4-5]。关于肿瘤放疗后复发机制的最新研究显示,外周血髓系细胞(peripheral blood myeloid cells,pbMC),主要为外周血单核细胞(pbMXD),向放疗部位迁徙并聚集,从而促进肿瘤局部血管新生(vasculogenesis),诱导肿瘤复发[6]。在包括肺癌的多个瘤种的动物实验显示,肿瘤组织中单核、巨噬细胞的数量,与放疗疗效呈负相关[7-9],阻断pbMXD向肿瘤组织的迁徙,则可显著抑制血管新生和肿瘤复发[6]。由此我们推论,放疗前后pbMXD的数量和变化,是否与肺癌放疗近、远期疗效相关?同步放化疗优于单纯放疗,是否部分因为化疗药物杀伤、减少了pbMXD向肿瘤局部的迁徙?放疗过程中pbMXD的监测,是否可以作为疗效和预后判断的一个指标?为此,我们对肺癌放疗患者进行随访和血象动态监测,以期对上述问题进行回答。
资料与方法
一、一般资料
收集我院2011年1月至2013年6月经病理学或细胞学确诊为肺癌,并行3D-CRT或IMRT放疗的患者共105例。男性91例,女性14例;中位年龄59岁(39~83岁);腺癌31例,鳞癌39例,腺鳞癌1例,SCLC 34例。
二、治疗方法
所有患者热塑膜固定后,飞利浦大孔径模拟CT扫描,扫描层厚5 mm;在Elekta计划系统完成靶区勾画及计划制定。肿瘤靶区(gross tumor volume,GTV) 为CT上可见肿瘤(包括肺内病灶和纵隔淋巴结),临床靶区(clinical target volume,CTV)为GTV外扩6~8 mm,计划靶区(planing target volume,PTV)为CTV 外扩5~10 mm;放疗剂量为2 Gy/次,5次/周,总剂量60~70 Gy。同步放化疗的患者,化疗方案为含铂剂标准一线/二线治疗方案。
三、观察指标
收集患者放疗前、中、后血常规,并进行CT复查和生存期随访。
近期疗效按照RECIST1.1标准,判定为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和进展(PD),分为显效(RR,CR+PR)和效差(SD+PD)两组。
远期疗效以无进展生存时间(progress free survival,PFS)进行分析,随访截止2013年11月30日,因病情未进展删失22例。
四、统计学方法
结 果
一、pbMXD计数与近期疗效的关系
105例患者中CR 1例(NSCLC 0例,SCLC1例),PR 64例(NSCLC 38例,SCLC 26例),SD 27例(NSCLC 22例,SCLC 5例),PD 13例(NSCLC 11例,SCLC 2例),RR为61.9%。放疗显效组(RR)与效差组(SD+PD)相比,治疗前、后pbMXD绝对值及相对值均无统计学意义(P>0.05),LC、NSCLC治疗后WBC显效组较效差组低,最低pbMXD显效组较效差组低,差异有统计学意义(P<0.05),见表1。
二、pbMXD计数与PFS的关系
全部患者的中位PFS 5.0个月(1~20.3个月),按中位PFS将患者分为两组(A组≤中位PFS,B组>中位PFS),两组治疗前后WBC及pbMXD绝对值、相对值均无统计学意义(P>0.05),见表2。
三、放疗前后pbMXD中位值与PFS的关系
放疗前中位pbMXD 0.345×109/L(0~1.36×109/L);放疗后中位pbMXD 0.385×109/L(0.04×109/L~1.12×109/L);放疗后-前pbMXD中位差值0.035 ×109/L[(-0.86×109/L)~1.05×109/L]。按中位pbMXD水平分为2组(A组≤中位pbMXD,B组>中位pbMXD),比较2组PFS,均无显著差异(P>0.05),见表3、图1。
四、pbMXD变化与同步放化疗的关系
基于NCCN指南,进一步分析pbMXD与局部晚期(Ⅲ期)NSCLC放疗的关系,探讨化疗在同步方案中对pbMXD的影响。本组病例中全部71例NSCLC,中位PFS为5个月(1~20.3个月),共筛查到局部晚期病例28例,其中同步放化疗12例,PR 8例,SD 2例,PD 2例,RR为 66.7% (8/12),中位PFS 6.5个月(1.5~14.2个月);单纯放疗16例,PR 9例,SD 6例,PD 1例,RR为 56.3% (9/16),中位PFS 5.15个月(2.2~9.2个月)。同步放化疗与单纯放疗相比,近期疗效提高10.4%,但统计结果无显著差异(P>0.05)。中位PFS延长1.35个月,生存曲线显示有一定分叉,但PFS统计结果无显著差异(P>0.05),见图2。同步放化疗组的白细胞总数下降(1.55±2.91)×109/L,单纯放疗组的白细胞总数下降(0.61±2.13)×109/L,两组无统计学差异。

疗前P=0.903

放疗后-前,P=0.854

全部NSCLC,P=0.782

局部晚期NSCLC,P=0.320
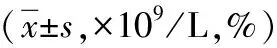
表1 放疗显效组与效差组pbMXD绝对值、相对值水平比较
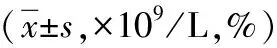
表2 两组pbMXD绝对值、相对值水平比较

表3 放疗前后pbMXD中位值与PFS的关系月)
同步放化疗中,放疗显效组与效差组相比,治疗前、后白细胞、pbMXD绝对值及相对值均无显著差异(P>0.05)。单纯放疗中,放疗显效组与效差组相比,治疗前、后WBC、pbMXD绝对值及相对值均无显著差异(P>0.05),pbMXD最低值显效组较效差组低,差异有统计学意义(P<0.05),见表4。由于病例数较少,无法比较放疗显效组与效差组间pbMXD与PFS的相关性。
讨 论
肿瘤血管形成是实体瘤放化疗后复发、转移的重要机制。肿瘤血管形成主要包括出芽式血管生成(angiogenesis)和募集髓系循环细胞的血管新生(vasculogenesis)[10]。正常情况下,肿瘤形成脉管是通过血管生成完成,当血管生成被抑制时,血管新生即可作为一个“备份”通路形成脉管。Stephens等[11]最早发现辐照后肿瘤组织内巨噬细胞的水平高于照射前。Ahn等[7-8]发现胶质瘤小鼠移植瘤模型辐射后,肿瘤组织内CD11b+髓系单核细胞数量明显增加。Kioi等[6]发现射线可诱导骨髓来源细胞向放射区域迁徙,通过修复放射损伤的血管导致肿瘤复发,放疗的同时,阻断骨髓来源细胞的迁徙可以预防肿瘤复发,提高放疗疗效。
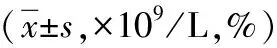
表4 局部晚期NSCLC放疗前后血象变化与疗效的关系
研究表明,CD11b+髓样细胞向肿瘤组织富集,不仅是放疗后肿瘤复发的重要原因[12],而且是抗VEGF治疗抵抗的重要机制[13-14]。还有研究认为集落刺激因子(CSF)可促进放疗后肿瘤血管新生,抑制CSF的药物也能通过抑制血管新生来提高疗效[15]。由于髓系单核-巨噬细胞与放疗后肿瘤复发的密切关系,因肿瘤组织不易获得,肿瘤组织中MXD的监测在临床不易开展,那么,pbMXD水平是否可以作为疗效预判、预后评估的一个简便、易行的监测指标呢?因此,本研究不考虑放疗过程中其它治疗对疗效的干扰,初步探讨了pbMXD作为肺癌放疗疗效预测指标的可行性。
本组数据均来自本科肺癌放疗住院患者,并进行了长期随访和血象监测。资料详实完整,整体客观缓解率(RR)达到61.9%,PFS达到5.0个月,与既往文献结果一致[16]。尤其对局部晚期NSCLC患者同步放化疗病例进行分析,PFS达到6.5个月,也与既往文献相近[17],生存曲线也显示与单纯放疗相比有分叉趋势,虽然统计学分析未显示出显著差异,但很可能是该类病例样本量较小所致。因此,本组资料的数据是可信的,我们在此基础上对pbMXD与放疗疗效的相关性进行了分层研究。
本研究中,我们分别按照PFS分层和pbMXD分层两种方式进行分析(部分资料未显示),统计结果大体上一致:放疗前后pbMXD及变化量的均值与放疗近、远期疗效无关,但疗程中pbMXD的最低值在整体NSCLC和局部晚期NSCLC单纯放疗组中与近期疗效相关,pbMXD最低值越低,RR越高。我们认为,由于该组资料中不少患者在治疗过程中使用口服或针剂进行升白细胞治疗,治疗前后pbMXD平均值未能体现出与疗效的关系。但对于升白细胞治疗前的pbMXD最低值,则在一些组别中反映出pbMXD与放疗疗效的相关性。可能的原因在于,仅在pbMXD低于一定限度时,肿瘤组织对MXD的富集作用会有所减弱,从而在一定程度上延缓肿瘤放疗耐受。
然而,临床上不可能在有较大血象风险的情况下实施放疗,更不能一味追求化疗后血象的低水平,保障骨髓安全仍是必要的。因此,选择性杀伤或阻断pbMXD向肿瘤组织的迁徙,可能较之化疗药物,更能促进放疗疗效。至于pbMXD能否作为肺癌放疗疗效预判和预后监测的指标,本研究结果显示出一定的积极意义,但尚需要更大规模的临床样本,甚至前瞻性研究,才能得出更加可靠的结论。
参 考 文 献
1 Jemal A,Bray F,Center MM,et al. Global cancer statistics[J]. CA Cancer J Clin,2011,61(2): 69-90.
2 Tyldesley S,Boyd C,Schulze K,et al. Estimating the need for radiotherapy for lung cancer: an evidence-based,epidemiologic approach [J]. Int J Radiat Oncol Biol Phys,2001,49(4): 973-985.
3 邹 晶,徐兴祥,王大新,等. 肺癌放化疗“实时”疗效评估方法的研究进展[J/CD]. 中华肺部疾病杂志: 电子版,2013,6(4): 360-363.
5 Osti MF,Agolli L,Valeriani M,et al. Image guided hypofractionated3-dimensional radiation therapy in patients with inoperable advanced stage non-small cell lung cancer [J]. Int J Radiat Oncol Biol Phys,2013,85(3): e157-163.
6 Kioi M,Vogel H,Schultz G,et al. Inhibition of vasculogenesis,but not angiogenesis,prevents the recurrence of glioblastoma after irradiation in mice [J]. J Clin Invest,2010,120(3): 694-705.
7 Ahn GO,Brown JM. Matrix metalloproteinase-9 is required for tumor vasculogenesis but not for angiogenesis: role of bone marrow-derived myelomonocytic cells [J]. Cancer Cell,2008,13(3): 193-205.
8 Chen FH,Chiang CS,Wang CC,et al. Radiotherapy decreases vascular density and causes hypoxia with macrophage aggregation in TRAMP-C1 prostate tumors [J]. Clin Cancer Res,2009,15(5): 1721-1729.
9 Priceman SJ,Sung JL,Shaposhnik Z,et al. Targeting distinct tumor-infiltrating myeloid cells by inhibiting CSF-1 receptor: combating tumor evasion of antiangiogenic therapy [J]. Blood,2010,115(7): 1461-1471.
10 Tang DG,Conti CJ. Endothelial cell development,vasculogenesis,angiogenesis,and tumor neovascularization: an update [J]. Semin Thromb Hemost,2004,30(1): 109-117.
11 Stephens TC,Currie GA,Peacock JH. Repopulation of gamma-irradiated Lewis lung carcinoma by malignant cells and host macrophage progenitors [J]. Br J Cancer,1978,38(5): 573-582.
12 Chiang CS,Fu SY,Wang SC,et al. Irradiation promotes an m2 macrophage phenotype in tumor hypoxia [J]. Front Oncol,2012,2: 89.
13 Shojaei F,Wu X,Qu X,et al. G-CSF-initiated myeloid cell mobilization and angiogenesis mediate tumor refractoriness to anti-VEGF therapy in mouse models [J]. Proc Natl Acad Sci U S A,2009,106(16): 6742-6747.
14 Bergers G,Hanahan D. Modes of resistance to anti-angiogenic therapy[J]. Nat Rev Cancer,2008,8(8): 592-603.
15 Xu J,Escamilla J,Mok S,et al. CSF1R signaling blockade stanches tumor-infiltrating myeloid cells and improves the efficacy of radiotherapy in prostate cancer [J]. Cancer Res,2013,73(9): 2782-2794.
16 O′Rourke N,Roqué I Figuls M,Farré Bernadó N,et al. Concurrent chemoradiotherapy in non-small cell lung cancer[J]. Cochrane Database Syst Rev,2010 (6): CD002140.
17 Brown T,Pilkington G,Boland A,et al. Clinical effectiveness of first-line chemoradiation for adult patients with locally advanced non-small cell lung cancer: a systematic review [J]. Health Technol Assess,2013,17(6): 1-99.

